Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамические процессы в реальных газах и парахСодержание книги
Поиск на нашем сайте
В качестве реального газа рассмотрим водяной пар, который наиболее широко используется в теплотехнике. Это объясняется, главным образом, повсеместным распространением воды, ее дешевизной, безвредностью и некоторыми термодинамическими свойствами. Рассмотрим процесс получения пара: для этого 1кг воды при 0 оС поместим в цилиндр и приложим к поршню постоянную силу (т. е. вода будет находиться под постоянным давлением p=P/F).(При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твердое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (температура 0 °C и 100 °C были специально выбраны как температура таяния льда и кипения воды при создании температурной шкалы «по Цельсию» в системе СИ). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такое давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар.) При подводе теплоты температура воды повышается до тех пор пока не достигнет температуры кипения. При дальнейшем подводе теплоты идет кипение с сильным увеличением объема. Теперь в цилиндре находится двухфазная среда - смесь воды и пара - называемая влажным насыщенным паром. По мере подвода теплоты количество жидкой фазы уменьшается, а паровой - растет. Температура же смеси остается неизменной, т. к. вся теплота идет на испарение жидкости. То есть процесс является изобарно-изотермическим. Когда последняя капля жидкости превратиться в пар, то цилиндр будет заполнен только паром – сухим насыщенным паром (т. е. отсутствуют частицы жидкой фазы). Таким образом, при испарении жидкости в ограниченное пространство одновременно происходит и обратное ему явление, т. е. процесс сжижения. Конденсация пара вызывается тем, что некоторые из молекул, движущихся в паровом пространстве по всем направлениям, ударяясь о поверхность жидкости и попадая при этом в сферу влияния ее молекул, возвращаются обратно в жидкость. В некоторый момент, когда скорость конденсации станет равной скорости испарения, в системе наступает динамическое равновесие.
Насыщенным называется пар, находящийся в термическом и динамическом равновесии с жидкостью, из которой он образуется. Динамическое равновесие в том, что количество молекул, вылетающих из воды, равно количеству молей, конденсирующихся на поверхности. Сухой насыщенный пар получается при испарении всей жидкости. Объем и температура сухого пара являются функциями давления. Вследствие этого состояние сухого пара определяется одним параметром, например давлением или температурой. Влажный насыщенный парполучается при неполном испарении жидкости и является смесью пара с мельчайшими капельками жидкости, распространенными равномерно во всей его массе и находящимися в нем во взвешенном состоянии. Состояние влажного насыщенного пара характеризуется степенью сухости:
Х=Мн.п./(Мн.п.+Мж.)
где Мн.п., Мж .- массы насыщенного пара и жидкости. Массовая доля кипящей воды во влажном паре равная (1- Х) называется степенью влажности. Для кипящей жидкости Х= 0, для сухого насыщенного пара Х= 1. Перегретый пар.При сообщении сухому пару теплоты при постоянном давлении температура его будет увеличиваться. Пар, температура которого выше температуры насыщенного пара при данном давлении, называется перегретым паром. В отличие от насыщенного пара перегретый пар имеет температуру, зависящую от давления и объема. Состояние перегретого пара определяется двумя любыми независимыми параметрами, например давлением и температурой.
p-υ диаграмма водяного пара
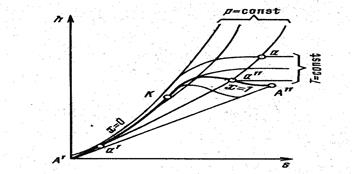
Из рассмотрения процесса образования перегретого пара при постоянном давлении следует, что этот процесс состоит из трех последовательно осуществляемых различных физических процессов, а именно: подогрева жидкости до температуры кипения, парообразования и пароперегрева. График этого процесса в p-v - координатах (рис. 20) будет линия а-b-c-d, отрезок аb -соответствует подогреву жидкости, bc - парообразованию и cd - пароперегреву. Обозначим объемы воды при 0ºС и температуре кипения соответственно через υ0 и υ, а объемы влажного, сухого и перегретого пара - через υх, υ``и υ.

Если процесс парообразования будет осуществляться при более высоком давлении, то объем воды v 0 при 0ºС практически не изменится, а объем v ` воды увеличится, а объем v ` сухого пара уменьшится. Следовательно, при возрастании давления разность объемов v `- v 0 (отрезок а-b) увеличивается, а разность объемов v ``- v ` (отрезок b-c) уменьшается. Таким образом, при возрастании давления точки a и b будут постепенно расходиться, а точки b и c – сближаться. При каком-то давлении можно достигнуть состояния, когда точки bи c сольются в одну. Эта точка обозначается К и называется критической. Ее особенность в том, что в ней различия между жидкостью и паром. Соединив одноименные точки, лежащие на изобарах различных давлений, получим линии, каждая из которых имеет определенное значение. Для каждого вещества критические параметры имеют определенные значения. Для воды pк =22,129 МПа (218 атм), v к=0,00326 м3/кг, t к=374,15ºС (647 К). При критической температуре жидкость и пар имеют одинаковую плотность. На этом основан один из экспериментальных методов определения критических параметров вещества. Из изложенного следует, что критическая температура является максимальной температурой насыщенного пара. При температурах выше критической могут быть лишь перегретые пары и газы. (В момент достижения критической точки вода характеризуется крайне низкой вязкостью, непрозрачностью, резким падением скорости распространения звуковых волн и в три раза более низкой плотностью, чем при обычных условиях. Сверхкритическое состояние представляют собой нечто среднее между жидкостью и газом. Вода в сверхкритическом состоянии может сжиматься, как газ, и в тоже время, способна растворять твердые вещества, что не характерно для газов.)
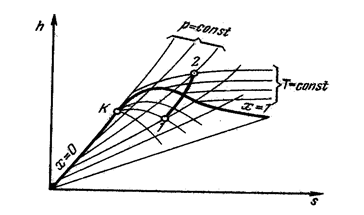
Линия а0 выражает зависимость удельного объема воды при 0 ºС от давления. Эта линия будет почти параллельна оси ординат, имея незначительный к ней наклон. Линия а΄ устанавливает зависимость удельного объема воды при температуре кипения от давления. Эта линия, называемая нижней пограничной кривой, отделяет в системе координат p-υ область воды от области насыщенных паров. Линия а`` выражает зависимость удельного объема сухого пара от давления. Эта линия, называемая верхней пограничной кривой, отделяет область насыщенных паров от области перегретых. T-s диаграмма водяного пара Для исследования различных процессов, связанных с водяным паром часто, используется T-s диаграмма (рис. 21). За начальное состояние в T-s диаграмме принимают воду при t = 0 ºC и любом давлении, для которого s =0. Это состояние отметим точкой a0. Пользуясь таблицами, можно графически представить произвольный процесс нагревания воды, парообразования и перегрева пара при постоянном давлении (соответственно a0-a ’, a' - a'', a'' - a).
Таким образом, как наглядно видно из диаграммы, при повышении давлении точка a΄΄ смещается вверх и вправо, ибо с ростом давления увеличивается температура кипения, а жидкость при повышении температуры расширяется. Точка a '', несмотря на увеличение температуры кипения, смещается влево, т. к. удельный объем пара падает из-за более сильного влияния растущего давления. При каком-то давлении можно достигнуть состояния, когда точки a ' и a '' сольются в одну. Эта точка обозначается Kи называется критической. Ее особенность в том, что в ней различия между жидкостью и паром.
Если соединить линией точки a ', то получим нижнюю пограничную кривую a0K,на которой располагается кипящая жидкость (х=0). Если соединить линией точки a '', то получим верхнюю пограничную кривую Ka '', на которой располагается сухой пар (х=1). Между этими линиями располагается область влажного пара. Выше линии х=1 располагается область перегретого пара. По свойству T-s диаграммы площади в ней измеряют количества теплоты в процессах. Так, площадь под линией a 0 a ' - измеряет количество теплоты, подведенное к воде при нагревании ее от 0ºС до состояния кипения, площадь под линией a '- a '' - теплота парообразования (обозначается буквой r), площадь под линией a ''- a - теплота перегрева. Теплота, расходуемая на нагревание 1 кг жидкости от 0ºC до температуры кипения, обозначается q, называется теплотой жидкости и может быть определена по уравнению
q=∫cdt,
или ее можно определить через разность энтальпий q=i’- i0. Энтропия жидкости
s’=c ln Tн/ 273.
Теплота, расходуемая на превращение 1 кг жидкости при температуре кипения в сухой насыщенный пар, называется теплотой парообразования, обозначается r и определяется по уравнению r =i’’- i’ .
Энтропия влажного пара
sх=s’+ r х/Tн.
Энтальпия влажного пара
iх=i’ +r х.
Энтальпия сухого пара
i’’ = i’ +r. Энтропия сухого пара
s’’ =s’+ r /Tн. Количество теплоты, необходимое для перевода 1 кг сухого насыщенного пара в перегретый пар при постоянном давлении, называют теплотой перегрева, обозначают q nn и определяют по уравнению
qпп=∫ ср dt
или через разность энтальпий
qпп=iпп – i’’.
Энтропия перегретого пара
s =s’’ +∫ cp dT/T.
Широкое распространение при решении задач по водяному пору получила i-s диаграмма (рис. 22). Она строится на основании таблиц термодинамических свойств воды и пара. За начало отсчета принимаются энтальпия и энтропия воды в тройной точке i '=0, s '=0.
Пользуясь этой диаграммой можно, легко определить p, v, t, i, s, x - для любой точки. Большое достоинство диаграммы заключается в том, что количества теплоты при p =const изображаются отрезками, а не площадями как на T-s диаграмме. Поэтому i-s диаграмма исключительно широко используется при проведении тепловых расчетов. Рассмотрим, как выглядят основные термодинамические процессы для водяного пара (рис. 23):
- изобарный процесс - будет идти по линии соответствующего давления; - изохорный процесс - будет идти по линии соответствующего объема; - адиабатный процесс - будет вертикальная линия с s =const; - изотермический процесс - будет идти по линии соответствующей температуры до пересечения с линией насыщения x =1, а затем по линии соответствующего давления (т. е. в области влажного пара линии давлений и температур совпадают).
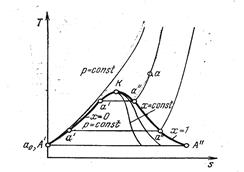
Рис. 23 ФАЗОВАЯ ДИАГРАММА ВОДЫ Области фазовой диаграммы, ограниченные кривыми, соответствуют тем условиям (температурам и давлениям), при которых устойчива только одна фаза вещества. Например, при любых значениях температуры и давления, которые соответствуют точкам диаграммы, ограниченным кривыми ВТ и ТС, вода существует в жидком состоянии. При любых температуре и давлении, соответствующих точкам диаграммы, которые расположены ниже кривых AT и ТС, вода существует в парообразном состоянии. Кривые фазовой диаграммы соответствуют условиям, при которых какие-либо две фазы находятся в равновесии друг с другом. Например, при температурах и давлениях, соответствующих точкам кривой ТС, вода и ее пар находятся в равновесии. Это и есть кривая давления пара воды. точка X представляет собой точку кипения воды при давлении 1 атм. Кривая AT является кривой давления пара льда; такую кривую обычно называют кривой сублимации. Кривая ВТ представляет собой кривую плавления. Она показывает, как давление влияет на температуру плавления льда: если давление возрастает, температура плавления немного уменьшается. Такая зависимость температуры плавления от давления встречается редко. Обычно возрастание давления благоприятствует образованию твердого вещества. В случае воды повышение давления приводит к разрушению водородных связей, которые в кристалле льда связывают между собой молекулы воды, заставляя их образовывать громоздкую структуру. В результате разрушения водородных связей происходит образование более плотной жидкой фазы
В точке У на кривой ВТ лед находится в равновесии с водой при температуре 273 К (О 0C) и давлении 1 атм. Она представляет собой точку замерзания воды при давлении 1 атм. Кривая ST указывает давление пара воды при температурах ниже ее точки замерзания. Поскольку вода в нормальных условиях не существует в виде жидкости при температурах ниже ее точки замерзания, каждая точка на этой кривой соответствует воде, находящейся в метастабилъном состоянии. Это означает, что при соответствующих температуре и давлении вода находится не в своем наиболее устойчивом (стабильном) состоянии. Явление, которое соответствует существованию воды в метастабильном состоянии, описываемом точками этой кривой, называется переохлаждением. На фазовой диаграмме имеются две точки, представляющие особый интерес. Прежде всего отметим, что кривая давления пара воды заканчивается точкой С. Она называется критической точкой воды. При температурах и давлениях выше этой точки пары воды не могут быть превращены в жидкую воду никаким повышением давления. Другими словами, выше этой точки паровая и жидкая формы воды перестают быть различимыми. Критическая температура воды равна 647 К, а критическое давление составляет 220 атм.
Точка Г фазовой диаграммы называется тройной точкой. В этой точке лед, жидкая вода и пары воды находятся в равновесии друг с другом. Этой точке соответствуют температура 273,16 К и давление 6,03 • 1000 атм. Лишь при указанных значениях температуры и давления все три фазы воды могут существовать вместе, находясь в равновесии друг с другом. Иней может образовываться двумя способами: из росы либо непосредственно из влажного воздуха. Образование инея из росы. Роса-это вода, образующаяся при охлаждении влажного воздуха, когда его температура понижается, пересекая (при атмосферном давлении) кривую TC. Иней образуется в результате замерзания росы, когда температура понижается настолько, что пересекает кривую ВТ. Образование инея непосредственно из влажного воздуха. Иней образуется из росы только в том случае, если давление пара воды превышает давление тройной точки Г, т.е. больше 6,03-10~3 атм. Если же давление паров воды меньше этого значения, иней образуется непосредственно из влажного воздуха, без предварительного образования росы. В таком случае он появляется, когда понижающаяся температура пересекает кривую AT. В этих условиях образуется сухой иней.
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 379; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.62.63 (0.012 с.) |