Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Структура та функції біологічних мембран
План 1. Основні функції біологічних мембран. 2. Різні моделі структури мембран. 3. Модельні ліпідні мембрани та фазові переходи у мембранах. Біологічна мембрана - ультратонка бімолекулярна плівка фосфоліпідів, інкрустована білками й полісахаридами. Ця клітинна структура лежить в основі бар'єрних, механічних і матричних властивостей живого організму. Вступ Важко повірити, що 50-60 років тому існування мембран на поверхні живої клітини ставилося під сумнів, а структури, спостережувані під електронним мікроскопом, ніяк не зв'язували із численними функціями живої клітини. Особливо гарячі суперечки стосувалися мембранного механізму виникнення й поширення біопотенціалів. Очевидно, із цієї причини розділ клітинної біофізики, присвячений мембранному електрогенезу, виявився найбільше фундаментально дослідженим і досяг високого ступеня наукової глибини і ясності. Слід зазначити, що для дослідження мембран потрібна була інтеграція знань багатьох областей природних наук. Щоб зрозуміти, як функціонують мембрани, треба знати такі теми як "Електрика" (фізика), "Ліпіди й білки" (органічна хімія), уміти вирішувати хоча б найпростіші диференціальні рівняння (математика). Основні функції біологічних мембран Елементарна жива система, здатна до самостійного існування, розвитку й відтворенню - клітина - основа будови всіх тварин, рослин і мікроорганізмів. Найважливіші умови існування клітини (і клітинних органел), з одного боку, - автономність стосовно навколишнього середовища (речовина не повинне змішуватися з речовиною оточення, повинна дотримуватися автономність хімічних реакцій у клітині і її окремих частинах); з іншого боку, - зв'язок з навколишнім середовищем (безперервний, регульований перенос речовини й енергії між клітиною й навколишнім середовищем). Жива клітина - термодинамічно відкрита система. Єдність автономності від навколишнього середовища й тісного зв'язку з навколишнім середовищем - необхідна умова функціонування живих організмів на всіх рівнях їхньої організації. Тому найважливіша умова існування клітини й, отже, життя - біологічні мембрани. Три основних функції біологічних мембран Бар'єрна функція забезпечує селективний, регульований, пасивний й активний обмін речовин клітини з навколишнім середовищем (селективний - значить виборчий: одні речовини переносяться через біологічні мембрани, інші - ні); регульований - проникність мембрани для певних речовин міняється залежно від функціонального стану клітини; активний - перенос від місць, де концентрація речовини мала, до місць із більшою концентрацією. Матрична функція забезпечує взаємне розташування й орієнтацію мембранних білків, забезпечує їхню оптимальну взаємодію (наприклад, взаємодія мембранних ферментів). Механічна функція забезпечує міцність й автономність клітин і внутрішньоклітинних структур.
Крім того, біологічні мембрани виконують функції: енергетичну - синтез АТФ на внутрішніх мембранах мітохондрій і фотосинтез вуглеводів у мембранах хлоропластів; генерацію й проведення біопотенціалів; рецепторну (механічна, акустична, нюхова, зорова, хімічна, терморецепція - мембранні процеси) і багато інших функцій. Величезна роль мембран у життєвих процесах пов'язана з їх великою сукупною площею. Так, загальна площа всіх біологічних мембран в організмі людини досягає десятків тисяч квадратних метрів. Структура мембран Перша модель будови біологічних мембран була запропонована в 1902 році. Овертон помітив, що через мембрани найкраще проникають речовини, добре розчинні в ліпідах, і на підставі цього припустив, що біологічні мембрани складаються з тонкого шару фосфоліпідів. Насправді, на поверхні роздягнула полярного й неполярного середовищ (наприклад, води й повітря) молекули фосфоліпідів утворять мономолекулярний (одномолекулярний) шар. Їх полярні "голови" занурені в полярне середовище, а неполярні "хвости" орієнтовані убік неполярного середовища. Тому можна було припустити, що біологічні мембрани побудовані з моношару ліпідів. В 1925 році Гортер і Грендел показали, що площа моношару ліпідів, екстрагованих з мембран еритроцитів, у два рази більше сумарної площі еритроцитів. Гортер і Грендел екстрагували ліпіди з гемолізованих еритроцитів ацетоном, потім випарювали розчин на поверхні води й вимірювали площу мономолекулярної плівки ліпідів, що утворилася. На основі результатів цих досліджень було зроблене припущення, що ліпіди в мембрані розташовуються у вигляді бімолекулярного шару. Це припущення підтвердили дослідження електричних параметрів біологічних мембран (Коул і Кертис, 1935 рік): високий електричний опір ~107 Ом · м2 і більша електроємність ~ 0,5 ·10-2 Ф/м2.
Біологічну мембрану можна розглядати як електричний конденсатор. Провідникові пластини конденсатора утворюють електроліти зовнішнього й внутрішнього розчинів (позаклітинного й цитоплазми). Провідники розділені ліпідними бішаром. Ліпіди - діелектрики з діелектричною проникністю Ємність плаского конденсатору становить Питома ємність (на одиницю площини)
Звідси можна знайти відстань між пластинами конденсатору, відповідну у нашому випадку товщині мембрани,
Це якраз відповідає за порядком величини товщині неполярної частини бімолекулярного шару ліпідів, складених визначеним чином. Разом з тим були експериментальні дані, які свідчили про те, що біологічна мембрана містить у своєму складі й білкові молекули. Наприклад, при вимірі поверхневого натягу клітинних мембран було виявлено, що вимірювані значення коефіцієнта поверхневого натягу істотно ближче до коефіцієнта поверхневого натягу на границі розділу білок-вода (близько 0,1 Н/см), ніж на границі розділу ліпід-вода (близько 10 Н/см). Ці протиріччя експериментальних результатів були усунуті Даниеллі й Девсоном, що запропонували в 1935 році так називану "бутербродну" модель будови біологічних мембран, що з деякими несуттєвими змінами протрималася в мембранології майже 40 років. Відповідно до цієї моделі, мембрана - тришарова: вона утворена двома розташованими по краях шарами білкових молекул, з ліпідним бішаром посередині; утвориться щось подібне до бутерброда - ліпіди, на зразок масла, між двома "скибами" білка. Однак у міру накопичення експериментальних даних довелося зрештою відмовитися й від "бутербродної" моделі будови біологічних мембран. Величезну роль у розвитку уявлень про будову біологічних мембран зіграло все більше проникнення в біологію фізичних методів дослідження. Більшу інформацію про структуру мембран, про взаємне розташування атомів мембранних молекул дає рентгеноструктурний аналіз, заснований на дифракції короткохвильових рентгенівських променів на атомах. Рентгеноструктурний аналіз дозволяє виявляти впорядкованість у розташуванні атомів і визначати параметри впорядкованих структур (наприклад, відстані між кристалографічними площинами). Дослідження дифракції рентгенівських променів підтвердили відносно впорядковане розташування ліпідних молекул у мембрані (було показане існування подвійного молекулярного шару з більш-менш паралельно розташованими жирнокислотними хвостами), дали можливість точно визначити відстань між полярною головою ліпідної молекули й метильною групою наприкінці вуглеводневого ланцюга. Найбільш вражаючі результати були отримані в електронно-мікроскопічних дослідженнях. Як відомо, світловий мікроскоп не дозволяє розглянути деталі об'єкта менше приблизно половини довжини хвилі світла (близько 200 нм). У світловому мікроскопі можна розглянути окремі клітини, однак він зовсім не придатний для вивчення біологічних мембран, товщина яких в 20 разів менше межі дозволу світлового мікроскопа. Роздільна здатність мікроскопа обмежена явищем дифракції. Тому, чим менше довжина хвилі в порівнянні з деталями досліджуваного об'єкта, тим менше викривлення. Межа дозволу Z пропорційний довжині хвилі l.
Електронам, розігнаним до більших швидкостей, теж властиві хвильові властивості, у тому числі явище дифракції, однак при досить більших швидкостях довжина хвилі де Бройля досить мала й відповідно мала межа дозволу електронного мікроскопа. Так, якщо електрони прискорюються в електричному полі з напругою U = 105 B, швидкість їх досягає 106 м/с (e - заряд електрона, m - маса електрона), а довжина хвилі зменшується та межа дозволу Z становить не тисячні частки нанометрів, а біля одного десятої нанометра (Z ї 0,1 нм), що, однак, уже дозволяє розглянути окремі деталі будови біологічних мембран. До методів вивчення динаміки мембран, що дають можливість досліджувати їх, не руйнуючи, ставляться флюоресцентный метод і методи радіоспектроскопії - електронний парамагнітний резонанс (ЭПР) і ядерний магнітний резонанс (ЯМР). Ці методи дають відомості про рух і взаємодію мембранних молекул й окремих частин молекули. Було з'ясовано, що при фізіологічних умовах ліпідні молекули перебувають у рідкому агрегатному стані. Метод ЭПР показав, що не вся поверхня біологічної мембрани покрита білками. Так, наприклад, більше половини поверхні мембрани кишкової палички утворена полярними головами ліпідів. Сукупність результатів, отриманих фізичними й хімічними методами дослідження, дала можливість запропонувати нову модель будови біологічних мембран - рідинно-мозаїчну (Сингер і Никольсон, 1972 рік) [1 - 3]. Згідно Сингеру й Никольсону, структурну основу біологічної мембрани становить подвійний шар фосфоліпідів, інкрустований білками, подібно тому, як інкрустація кольоровими камінчиками й скельцями створює мозаїчну картину. При цьому розрізняють поверхневі (або периферичні) і інтегральні білки (рис. 2.1).
Рис. 2.1. Будова мембрани за Сингером та Нікольсоном. Мембранні білки можуть пронизувати бислой наскрізь (інтегральний білок - 1), примикати до бішару (периферичний білок - 2) або поринати в нього. Багато білків мембрани є глікопротеїнами (3), а мембраноутворюючі ліпіди - гліколіпідами (4). На схемі також показаний: холестерол (5); вуглевод (6); елементи цитоскелету (7).
Ліпіди перебувають при фізіологічних умовах у рідкому агрегатному стані, це дозволяє зрівняти мембрану з фосфоліпідним морем, по якому плавають білкові "айсберги". Одним з підтверджень рідинно-мозаїчної моделі є й той факт, що, як установлено хімічним аналізом, у різних мембранах співвідношення між змістом білків і фосфоліпідів сильно коливається: кількість білків у миєліновій мембрані в 2,5 рази менше, ніж ліпідів, а в мітохондріях, навпроти, білків в 2,5 рази більше, ніж ліпідів, у той час як, згідно "бутербродної" моделі, співвідношення кількості білків і ліпідів у всіх мембранах повинне бути однаковим. Крім фосфоліпідів і білків у біологічних мембранах містяться й інші хімічні сполуки. У мембранах тваринних клітин багато холестерину (у порівнянній кількості з фосфоліпідами й білками). Є в мембранах й інші речовини, наприклад, гликоліпіди, глікопротеїди. Рідинно-мозаїчна модель будови мембрани в цей час загальноприйнята. Однак, як усяка модель, вона дає досить спрощену й схематичну картину будови мембрани. Зокрема, виявлено, що білкові "айсберги" не завжди вільно плавають у ліпідному морі, а можуть бути "заякорені" на внутрішні (цитоплазматичні) структури клітини. До таких структур відносяться мікрофіламенти й мікротрубочки. Мікротрубочки - порожні циліндри діаметром близько 300 нм із особливого білка тубуліну відіграють, очевидно, важливу роль у функціонуванні клітини. Фізико-хімічні властивості мембрани (рідинність, флексибільність, здатність до агрегації тощо) визначаються, зокрема, її фосфоліпідним складом. Фосфоліпіди є структурними компонентами біологічних мембран (рис. 2.2). Один кінець їх молекули містить два ліпофільні жирно-кислотні ланцюги, другий — гідрофільну іонізовану групу (залишок фосфорної кислоти та основи). Ці молекули впорядковані у фосфоліпідний бішар, який має вигляд сендвіча. На рисунку круглі «головки» представляють іонізовану частину молекули, а «хвости» — ацильні залишки жирних кислот. Центральна частина мембрани містить ліпофільні молекули холестерину, який ущільнює її. Завдяки цьому феномену взаємодія між ліпофільними компонентами мембрани посилюється, мембрана ефективно утримує внутрішній вміст клітини, не даючи йому «вилитися».
Рис. 2.2. Хімічна структура фосфоліпіду: а – полярна (гідрофільна) «головка» (залишок фосфорної кислоти та основи); б, в – неполярні (ліпофільні) ланцюги жирних кислот; г – схематичне зображення молекули фосфоліпіду. (Додатково. Одним із найбільш метаболічно активних фосфоліпідів є фосфатидилінозитол. Під впливом фермента фосфоліпази С від нього відщеплюється інозитолтрифосфат, який стимулює вихід кальцію в клітину із внутрішньоклітинних депо, що може спричинити скорочення гладких м’язів судин. Тому в лікуванні серцево-судинних захворювань особливого значення надають пригніченню цього шляху обміну фосфатидилінозитолу, що ефективно здійснюється антагоністами кальцію. Крім того, посилений метаболізм фосфатидилінозитолу відіграє важливу роль в патогенезі маніакальних станів. Солі літію, ефективні при біполярних розладах, пригнічують цей біохімічний процес.
Оскільки полярні (іонізовані) головки фосфоліпідів знаходяться на зовнішній та внутрішній поверхні мембранного «сендвіча», то з ними активно взаємодіють позитивно та негативно заряджені іони. Товща ліпідного матриксу мембрани пронизана білковими молекулами, які виконують у клітині різноманітні функції (див. рис. 2), зокрема рецепторні, ферментативні, канальні тощо. Деякі білки, змінюючи свою динамічну структуру під дією відповідних фармакологічно активних сполук, виконують канальну функцію, формуючи мембранні пори для іонів та малих молекул. Зовнішня та внутрішня гідрофільна поверхня мембрани вкрита водною кристалічною решіткою. Перш ніж молекула лікарського засобу зв’яжеться зі специфічним мембранним рецептором або пройде через мембрану, водна кристалічна решітка має бути частково зруйнована. Речовини перетинають мембранний бар’єр за допомогою активного їх транспорту всередину клітини. Цей процес здійснюється за допомогою спеціальних білків-насосів — натрієвого, кальцієвого, хлорного, протонного та ін. У складі зовнішнього листка плазматичної мембрани знаходяться також вуглеводи, які ковалентно приєднані до білків (глікопротеїди) та ліпідів (гліколіпіди). Вважають, що основна їх функція — участь у процесах міжклітинного розпізнавання, рецепції біологічно активних молекул та забезпеченні імунологічних властивостей клітин).
Модельні ліпідні мембрани Ліпосоми (штучні мембранні частки) використаються в медицині з метою спрямованої доставки ліків. Вікова мрія фармакологів про інструмент, за допомогою якого можна впливати на окрему клітину, близька до здійснення. Плоскі бішарові фосфоліпідні мембрани (БЛМ) - тип модельних мембран. Такі мембрани одержують на маленьких отворах діаметром близько 1 мм, у пластинці із пластику (наприклад, фторопласта), зануреної у водне середовище. На отвір наносять краплю розчину ліпіду (у спирті, хлороформі, гептані або інших розчинниках). Розчинник дифундує з розчину у воду й на отворі залишається плівка ліпіду. Ця плівка спонтанно тоншає доти, поки не утвориться бімолекулярний шар товщиною близько 6 нм. Зайвий ліпід збирається у вигляді ободка - торуса в країв отвору. Плоскі ліпідні мембрани, поряд з ліпосомами, широко використаються як моделі для вивчення електричних властивостей мембрани, їхньої проникності для різних речовин і для інших наукових досліджень. Модельні мембрани моделюють ряд функцій біологічних мембран, у тому числі бар'єрну: наприклад, селективність проникності - гарну проникність для води, погану для іонів. Можна моделювати регульований транспорт, впливаючи на модельну мембрану білками - іонофорами [3, 4], зміною температури, хімічного складу навколишнього середовища, електричним полем [5]. Можна при цьому спостерігати зміну іонної проникності модельних мембран. Як показано фізичними методами дослідження - дилатометрією (виміром коефіцієнта об'ємного розширення) і калориметрією (виміром теплоємності), рентгеноструктурного аналізу й ін. - ліпідна частина біологічних мембран при певних температурах зазнає фазовий перехід першого роду. Згідно даним рентгеноструктурного аналізу, радіоспектроскопії, флюоресцентного аналізу, інфрачервоної спектроскопії й інших фізичних досліджень у фосфоліпідній мембрані при зниженні температури відбувається перехід з рідкокристалічного до гель-стану, що умовно іноді називають твердокристалічним. У гель-стані молекули розташовані ще більш упорядковано, чим у рідко кристалічному. Всі гідрофобні вуглеводневі хвости фосфоліпідних молекул у гель-фазі повністю витягнуті строго паралельно один одному (мають повністю трансконформацию). У рідкому кристалі за рахунок теплового руху можливі структурні переходи: хвости молекул вигинаються, їхня паралельність один одному в окремих місцях порушується, особливо сильно в середині мембрани. Товщина мембрани тому в гель-фазі більше, ніж у рідкому кристалі. Однак при переході із твердого в рідкокристалічний стан, об'єм трохи збільшується, тому що значно збільшується площа мембрани, що доводиться на одну молекулу (від 0,48 нм2 до 0,58 нм2). Для нормального функціонування мембрана повинна бути в рідкокристалічному стані. Тому в живих системах при тривалому зниженні температури навколишнього середовища спостерігається адаптаційна зміна хімічного складу мембран, що забезпечує зниження температури фазового переходу. Температура фазового переходу знижується при збільшенні числа ненасичених зв'язків у жирно-кислотних хвостах. У хвості молекули може бути до чотирьох ненасичених зв'язків. Залежно від хімічного складу ліпідних мембран температура фазового переходу гель-рідкий кристал може мінятися від - 20?З (для мембран ненасичених ліпідів) до + 60?З (для насичених ліпідів). Збільшення числа ненасичених ліпідів у мембрані при зниженні температури перебування спостерігається в мікроорганізмів, рослинних і тварин клітин. Цікавий приклад пристосування клітинних мембран до температурних умов - зміна температури фазового переходу (за рахунок зміни хімічного складу мембранних ліпідів) ноги полярного оленя. Температура уздовж ноги полярного оленя від копита до тулуба взимку може мінятися від - 20°С до + 30°С. Клітинні мембрани в дистальної частини ноги оленя містять більше ненасичених фосфоліпідів. Очевидно, первинний механізм кріопошкоджень (ушкоджень при охолодженні) біологічних мембран пов'язаний з фазовим переходом у гель-стан. Тому біологічні мембрани містять велика кількість холестерину, що зменшує зміни в мембрані, що супроводжують фазовий перехід. Молекули холестерину, розташовуючись між фосфоліпідними молекулами, упорядковують бішар у рідкому й розупорядковують у твердому стані й у такий спосіб зменшують розходження рідко кристалічної і гель-структур. У деяких мікроорганізмів біологічні мембрани перебувають при температурах, що лише небагато перевищують температуру фазових переходів ліпідів. Мембрана містить десятки різних ліпідів, яким відповідають різні температури фазового переходу, у тому числі близькі до фізіологічного. При зниженнях температури в мембрані відбуваються фазові перетворення в ліпідному бішарі. У роботах В.Ф. Антонова й співробітників [5] доведено, що при фазових переходах з гель- у рідкокристалічний стан і назад у ліпідному бішарі утворяться наскрізні канали радіусом 1 - 3 нм, по яких через мембрану можуть переноситися іони й низькомолекулярні речовини. Внаслідок цього при температурі фазового переходу різко збільшується іонна провідність мембрани. Збільшення іонної провідності мембран може врятувати клітину від кріопошкоджень за рахунок збільшення виходу із клітини води й солей - привести до порушення її бар'єрної функції, що перешкоджає кристалізації води усередині клітини. Підвищення іонної провідності мембран при фазовому переході, можливо, дозволяє підтримати на високому рівні метаболічний обмін деяких організмів. Великий інтерес представляє цей ефект для пояснення термо- і хеморецепції. Відомо, що перенос іонів через мембрану лежить в основі формування біопотенциалів, зміна іонної провідності обумовлює нервовий імпульс. Не виключено, що нервовий імпульс, що свідчить про зниження або підвищення температури, утворюється за рахунок зміни іонної проникності ліпідного бішару при фазовому переході мембранних ліпідів нерва. Очевидно, і деякі види хеморецепції можуть бути пов'язані з фазовим переходом мембранних ліпідів, оскільки фазовий перехід може бути викликаний не тільки зміною температури, але й зміною хімічного складу навколишнього середовища. Наприклад, доведено, що при даній температурі фазовий перехід з рідкокристалічного стану в гель-стан може бути викликаний збільшенням концентрації Ca2+ у фізіологічному діапазоні від 1 до 10 мм у водяному розчині, що оточує мембрану. Питання до самоконтролю 1. Основні функції біологічних мембран. 2. Різні моделі структури мембран. 3. Модельні ліпідні мембрани та фазові переходи у мембранах. 4. Модельні ліпідні мембрани.
Лекція 3
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 655; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.186.173 (0.027 с.) |
 .
. , де електрична стала
, де електрична стала 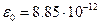 Ф/м, d – відстань між конденсатору, S – площа пластини.
Ф/м, d – відстань між конденсатору, S – площа пластини. .
.