
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы выражения концентрацииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Молярная концентрация, сВ, моль/дм3, ммоль/см3 – это отношение числа молей растворенного вещества к объему его раствора.
где nB – количество растворенного вещества, моль; V - объём раствора, дм3; mB – масса растворенного вещества, г; МB – молярная масса вещества, г / моль. Этот термин распространяется на любой вид условных частиц (атомы, ионы, молекулы, части молекул и т.д.). В аналитической практике молярную концентрацию выражают в моль/дм3. Например с(НCl) = 0,1 моль/дм3; с(Н2SO4) = 0,2 моль/дм3. Массовая концентрация – это отношение массы растворенного вещества «m » к объему раствора «V », единицы измерения: кг/дм3; а также кратные и дольные единицы. Массовую концентрацию, выраженную в г/cм3 называют титром (ТВ). Эта единица дала название классическому методу анализа – титриметрия. Титр вещества (ТB, г/cм3) – это число граммов растворенного вещества (mВ) в 1 см3 раствора V:
Титр связан с молярной концентрацией эквивалента с(
с молярной концентрацией раствора Сх:
При массовых анализах очень удобно выражать концентрацию рабочих растворов через так называемый титр по определяемому веществу. Он показывает массу (г) определяемого вещества, которая соответствует 1 см3 рабочего раствора. Титр по определяемому компоненту связан с молярной концентрацией эквивалента раствора формулой:
Например, титр рабочего раствора AgNO3, употребляемого при массовых определениях Зная молярную концентрацию эквивалента раствора, очень легко перейти к его титру по определяемому веществу. В данном случае, если молярная концентрация эквивалента раствора AgNO3 равна 0,1100 моль/дм3, то 1 см3 его содержит 0,1100/1000 моль AgNO3 и реагирует с таким же количеством моль
Если при определении
При титровании объёмы растворов обратно пропорциональны их молярным концентрациям эквивалента (Принцип эквивалентности).
или где Объемная концентрация – отношение объема растворенного вещества к объему раствора. Доля компонента от общего количества вещества. Доля означает отношение числа частей компонента к общему числу частей объекта. В зависимости от выбранной единицы различают массовую (ω), молярную (α), объемные доли (φ).
Долю выражают: -в процентах (доля умноженная на 100); -миллионных долях (ppm, доля умноженная на 106); -миллиардных долях (ppb, доля умноженная на 109); -триллионных долях (ppt, доля умноженная на 1012). Моляльность – количество вещества в единице массы (1 кг) растворителя. Преимущество моляльности – в независимости от температуры. Молярная концентрация эквивалента (устаревшее название “нормальность”) - это отношение количества вещества эквивалента в растворе к объему этого раствора. Единица измерения – моль/дм3.
где V – объём раствора, дм3; mВ – масса растворенного вещества, г; М( Эквивалент. Между условными частицами в соединениях существуют определенные соотношения, называемые стехиометрическими. Например в молекуле Н2СО3 два протона связаны с одной частицей СО32-. Между реагирующими частицами также устанавливаются стехиометрические отношения, например в реакции aА + bВ = сС + dD «a» условных частиц вещества А реагируют с «b» условными частицами вещества В. Следовательно одна частица А эквивалентна b/a частицам вещества В. Отношение b/aназывают фактором эквивалентности вещества В и обозначают fэкв(В), а условную частицу В, соответствующую в данной реакции частице А, обозначают b/aВ или fэкв(В)В. Например, в реакции 2NaOH + H2SO4 = Na2SO4 + 2H2O fэ кв (H2SO4) = Вещества реагируют между собой в эквивалентных количествах. Этот закон кратных отношений Дальтона служит основой всех расчетов результатов титриметрического анализа. Эквивалент одного и того же вещества может быть разным в зависимости от реакции. Например в реакции: 2NaOH + H2SO4 = Na2SO4 + 2H2O эквивалент H2SO4 - условная частица а в реакции: NaOH + H2SO4 = NaНSO4 + H2O эквивалент H2SO4 - условная частица H2SO4 (fэкв = 1). Однако, для расчета фактора эквивалентности и эквивалента необходима фиксированная основа, так как одного стехиометрического уравнения реакции для проведения расчета не всегда бывает достаточно. Такой основой в реакциях кислотно-основного взаимодействия является ион водорода, а в окислительно-восстановительных реакциях – электрон. Это и позволяет сделать определение фактора эквивалентности и эквивалента. Фактор эквивалентности ( fэ кв ) – число, обозначающее, какая доля реальной частицы веществ (х) эквивалентна одному иону водорода (z) в кислотно-основных реакциях или одному электрону (z) в окислительно-восстановительной реакции.
где zx – число ионов водорода (кислотно-основные реакции) или число электронов (окислительно-восстановительные реакции), х - химическая формула вещества Эквивалентом называют реальную или условную частицу вещества х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной реакции окисления восстановления – одному электрону. Молярной массой эквивалента вещества х (г/моль) называют массу одного моль эквивалента этого вещества, равную произведению фактора эквивалентности на молярную массу вещества х. М( Под молярной массой эквивалента понимают некоторую реальную частицу, которая может присоединять, высвобождать или быть эквивалентной одному иону водорода или одному электрону. Она зависит от типа реакции, т.е. не является величиной постоянной. На основе закона эквивалентов можно вывести следующие формулы для вычисления эквивалентных масс сложных веществ: для оксида
для кислоты
для основания
для соли
Пример 1. Определить молярную массу эквивалента хлора, серы, азота и углерода в соединениях HCl, H2S, NH3, CH4. Решение. В данных соединениях с 1 моль атомов водорода соединяется с 1 моль хлора, 1/2 моль серы, 1/3 моль азота, 1/4 моль углерода. Следовательно, молярные массы эквивалентов элементов равны: М( М( В окислительно-восстановительных реакциях молярные массы эквивалентов восстановителя и окислителя должны быть отнесены к числу электронов, участвующих в переносе заряда. Например, реакция 5Fe2+ + MnO4 - + 8H+ = 5Fe3+ + Mn2+ + 4H2O состоит из полуреакций: Fe2+- 1е- = Fe3+ MnO4 - + 8H+ + 5е- = Mn2+- + 4H2O Молярная масса эквивалента: 1) железа – М( 2) перманганата калия – М(
|
||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 1622; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.011 с.) |

 ,
,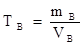 ,
, ) формулой:
) формулой: ,
, .
. .
.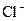 , обычно выражают по хлору, т.е. указывают, со сколькими граммами
, обычно выражают по хлору, т.е. указывают, со сколькими граммами  , г/см3) равен:
, г/см3) равен: .
. :
: = ТAgNO3/НCl · VAgNO3 = 0,003901 · 20,00 = 0,07802.
= ТAgNO3/НCl · VAgNO3 = 0,003901 · 20,00 = 0,07802.

 - молярная концентрация эквивалента титранта (известная величина);
- молярная концентрация эквивалента титранта (известная величина);  - объём титранта (устанавливают титрованием);
- объём титранта (устанавливают титрованием); 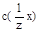 - молярная концентрация эквивалента определяемого вещества х;
- молярная концентрация эквивалента определяемого вещества х;  - объём анализируемого раствора (известная величина)
- объём анализируемого раствора (известная величина)



 , эквивалентом является условная частица
, эквивалентом является условная частица 
 ;
; ;
;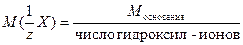 ;
; .
. HCl) = 1·36,45 = 36,45 г/моль; М(
HCl) = 1·36,45 = 36,45 г/моль; М( H2S) =
H2S) =  ·34 = 17 г/моль
·34 = 17 г/моль NH3) =
NH3) =  ·17= 5,67 г/моль; М(
·17= 5,67 г/моль; М( CH4) =
CH4) = 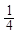 ·16 = 4 г/моль
·16 = 4 г/моль Fe) = 55,85 г/моль;
Fe) = 55,85 г/моль; КMnO4) =
КMnO4) =  ·158,04 = 31,61 г/моль.
·158,04 = 31,61 г/моль.


