
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Задачи 151-175 (Метод осадительного титрования)Содержание книги
Поиск на нашем сайте
151. Для полного осаждения ионов хлора из раствора содержащего 0,7142 г KCl, потребовалось 10,00 см3 раствора AgNO3 с молярной концентрацией эквивалента 1,0000 моль/дм3. При осаждении образовалось 1,4334 г AgCl. Сколько процентов хлора содержит образец хлорида калия? Расчет выполнить исходя из 1) массы осадка AgCl; 2) израсходованного объёма раствора AgNO3. 152. Сколько см3 раствора, содержащего 17,0000 г/дм3 AgNO3, потребуется для полного осаждения Cl- ионов из 20,00 см3 раствора соляной кислоты, с массовой концентрацией 73,0000 г/дм3 HCl? 153. Сколько см3 раствора с массовой концентрацией 20,8000 г/дм3 BaCl2 потребуется для полного осаждения SO42- - ионов из 20,00 см3 раствора серной кислоты, с массовой концентрацией 9,8000 г/дм3? 154. Сколько см3 раствора с массовой концентрацией 17,0000 г/дм3 AgNO3 потребуется для полного осаждения 155. Для осаждения AgCl из 15,00 см3 раствора, содержащего 2,5350 г AgNO3, потребовалось 30,00 см3 раствора HCl. Какова молярная концентрация раствора соляной кислоты? 156. Для осаждения BaSO4 из 20,00 см3 раствора, содержащего 0,4200 г BaCl2, потребовалось 20,00 см3 раствора Н2SO4. Какова молярная концентрация эквивалента раствора серной кислоты? 157. Сколько см3 раствора с массовой концентрацией AgNO3 17,0000 г/дм3 потребуется для полного осаждения 158. Сколько см3 раствора BaCl2 с массовой концентрацией 20,8000 г/дм3, потребуется для полного осаждения SO42- - ионов из 20,00 см3 раствора серной кислоты с массовой концентрацией 98,0000 г/дм3 H2SO4? 159. На титрование раствора AgNO3 требуется 25,20 см3 раствора KCl (ТKCl = 0,007400 г/см3). Сколько граммов AgNO3 содержится в растворе? 160. На титрование раствора KCl расходуется 30,20 см3 раствора AgNO3 (Т = 0,124300 г/см3). Сколько граммов KCl содержится в растворе? Можно ли рассчитать молярную концентрацию эквивалента этого раствора? 161. Из 2,9010 г NaCl квалификации «х.ч.» приготовлен раствор в мерной колбе вместимостью 1000,00 см3. На 25,00 см3 этого раствора расходуется 25,80 см3 раствора AgNO3. Вычислить молярную концентрацию эквивалента и титр раствора AgNO3. 162. В колбе вместимостью 250,00 см3 приготовлен раствор из 1,4265 г исследуемого хлорида. На титрование 20,00 см3 этого раствора израсходовано 19,95 см3 раствора AgNO3 с молярной концентрацией эквивалента 0,1055 моль/дм3. Какова массовая доля хлорид-иона в исследуемом хлориде в процентах? 163. Навеска 2,4080 г NaCl растворена в воде. Объём раствора доведен до метки в мерной колбе вместимостью 500,00 см3. На титрование 25,00 см3 этого раствора расходуется 20,35 см3 раствора AgNO3 с молярной концентрацией 0,0986 моль/дм3. Какова массовая доля хлорид-иона в NaCl в процентах? 164. Навеска 6,7000 г хлорида бария растворена в воде, и объём раствора доведен до 1000,00 см3 (в мерной колбе). На титрование 25,00 см3 этого раствора расходуется 28,95 см3 раствора нитрата серебра. Титр раствора нитрата серебра по серебру равен 0,005120 г/см3. Какова массовая доля хлорид-иона в хлориде бария в процентах? 165. Из навески 1,5150 г соли серебра приготовлено 250,00 см3 раствора. На титрование 15,00 см3 этого раствора расходуется 11,25 см3 раствора роданида аммония (NH4NСS) с массовой концентрацией 0,003568 г/см3. Рассчитайте массовую долю AgNO3 в образце в процентах. 166. Из навески 0,9330 г KCl приготовлен раствор в мерной колбе вместимостью 250,00 см3. Сколько см3 раствора AgNO3 с молярной концентрацией 0,1000 моль/дм3 потребуется для осаждения хлорид-ионов из 25,00 см3 полученного раствора, чтобы на оттитровывание избытка AgNO3 затрачивалось ровно 25,00 см3 раствора роданида с молярной концентрацией эквивалента 0,0500 моль/дм3? 167. Рассчитать навеску поваренной соли, массовая доля NaCl в которой составляет 80 %, необходимую для определения содержания хлора, если вместимость мерной колбы, в которой будет приготовлен раствор, равна 500,00 см3 и при анализе применят раствор AgNO3 с молярной концентрацией эквивалента 0,0500 моль/дм3. 168. Какую навеску технического хлорида аммония с массовой долей хлора 50 % следует взять для определения содержания хлора, если использовать раствор AgNO3 с молярной концентрацией эквивалента 0,1000 моль/дм3 и мерную колбу вместимостью 250,00 см3. 169. Для определения концентрации основного вещества в тех-ническом бромиде калия растворена в воде навеска 0,3038 г соли и полученный раствор оттитрован 23,80 см3 раствора AgNO3 (ТAgNO3/Cl = 0,003546 г/см3). Рассчитайте массовую долю KBr в образце в процентах. 170. Навеска соли цинка массой 0,2775 г растворена в воде. Раствор, подвергнутый соответствующей обработке, титруют раствором ферроцианида калия, содержащим 0,038760 г/см3 K4[Fe(CN)6]. Какова массовая доля ZnO в соли в процентах, если на титрование израсходовано 6,48 см3 раствора ферроцианида калия? 171. Навеска серебряного сплава массой 0,1900 г растворена и раствор оттитрован 21,12 см3 раствора роданида аммония с молярной концентрацией эквивалента 0,0500 моль/дм3. Рассчитайте массовую долю серебра в сплаве в процентах. 172. Сколько см3 раствора, с массовой концентрацией BaCl2 15,6000 г/см3 потребуется для полного осаждения SO42- -ионов из 15,00 см3 раствора серной кислоты с массовой концентрацией 98,0000 г/см3 H2SO4? 173. Для полного осаждения ионов хлора из раствора, содержащего 0,9546 г KCl, потребовалось 10,00 см3 раствора AgNO3 с молярной концентрацией 0,5000 моль/дм3. При осаждении образовалось 1,4000 г AgCl. Какова массовая доля ионов хлора в образце в процентах? Расчёт выполнить, исходя из массы осадка AgCl. 174. Сколько см3 раствора с массовой концентрацией 17,0000 г/дм3 AgNO3, потребуется для полного осаждения 175. Навеска 5,3000 г хлорида бария растворена в воде, и объём раствора доведен до 1000,00 см3 (в мерной колбе). На титрование 20,00 см3 этого раствора расходуется 23,50 см3 раствора нитрата серебра. Титр раствора нитрата серебра по серебру равен 0,005120 г/см3. Рассчитайте массовую долю хлора в процентах в хлориде бария.
|
||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 594; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.81.172 (0.009 с.) |

 - ионов из 20,00 см3 раствора бромоводородной кислоты с массовой концентрацией 105,4000 г/дм3 HBr?
- ионов из 20,00 см3 раствора бромоводородной кислоты с массовой концентрацией 105,4000 г/дм3 HBr?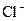 - ионов из 20,00 см3 раствора соляной кислоты с массовой концентрацией HCl 73,0000 г/дм3?
- ионов из 20,00 см3 раствора соляной кислоты с массовой концентрацией HCl 73,0000 г/дм3?


