

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Загрузка геля. Ширина белковых зон
Очевидно, что разделение близко идущих зон белков будет
тем успешнее, чем уже сами эти зоны, поэтому при электрофо-
резе следует заботиться о максимальном сужении белковых зон
(полос). Это накладывает ограничения на допустимую загрузку
геля. Разумеется, строгость таких ограничений зависит от со-
става белковой смеси и характера разделения полос. В качестве
ориентировочного максимума можно принять загрузку порядка
1 мг суммарного препарата белка на 1 см2 сечения геля. Для
кармана шириной 5 мм в пластине толщиной 1,5 мм это соответ-
ствует примерно 75 мкг белка, а для трубки диаметром 6 мм —
до 200 мкг. Идентификацию полос белка по их окраске можно
проводить при загрузках, в 10 раз меньших. При перегрузке бел-
ковые полосы бывают резкими в передней своей части и размы-
тыми сзади. При этом следует всегда считаться с возможностью
преципитации белка в момент вступления его в гель, когда все
макромолекулы стягиваются в узкую полоску и локальная кон-
центрация их сильно увеличивается.
Чем меньше загрузка геля, тем лучше разделение близких
зон. Ограничения в этом случае накладываются только метода-
ми обнаружения слабых полос. Поскольку диффузия зон идет
во времени, всегда желательно сокращение продолжительности
электрофореза, но не за счет чрезмерно высокой силы тока, вы-
зывающей неравномерный нагрев геля и искажение полос.
Электрофорез при пониженной температуре в этом плане дает
немного. Интенсивность диффузии уменьшается, но вместе с тем
снижается и электрофоретическая подвижность белков, а следо-
вательно, увеличивается продолжительность электрофореза.
В простом варианте электрофореза желательно наносить бел-
ковую смесь на гель в минимальном объеме, чтобы высота ис-
ходного слоя препарата была не более 2 — 3 мм. Выполнить это
условие нередко бывает затруднительно ввиду недостаточной
концентрации исходного препарата. На основании приведенных
выше цифр легко рассчитать, что концентрация белка в препа-
рате должна составлять 3 — 5 мг/мл. Ряд мер позволяет обойти
эту трудность; они направлены на концентрирование белкового
препарата в узкую зону в момент вступления его в рабочий гель.
Основной прием заключается в том, чтобы создать перед гелем
область с повышенной напряженностью поля, где белки мигри-
руют намного быстрее, чем в рабочем геле. В момент перехода
из этой области в рабочий гель они будут стягиваться в узкую
полосу, так как находившиеся первоначально далеко позади
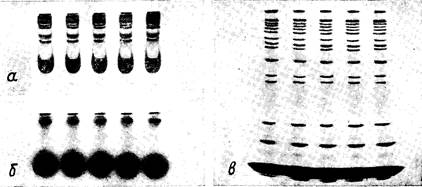
Рис. 16. Концентрирующий эффект электрофореза в градиентном геле (4 —
30% ПААГ)
а — начало фракционирования белков сыворотки; б — тот же гель после 60 ч диффузии
при комнатной температуре и выключенном напряжении; в — через 6 ч после возобновле-
ния электрофореза
молекулы белка «догонят» впереди идущие молекулы, замедлив-
шие свое движение при вступлении в рабочий гель.
Область с повышенной напряженностью поля можно создать
в крупнопористом геле, полимеризованном в буфере с малопод-
вижными ионами (см. выше, вариант 2). Такой подход исполь-
зован в системе ступенчатого электрофореза, рассмотренного
ниже. Этого же можно добиться и путем растворения исходного
препарата белка в том же рабочем буфере, но в 5 — 10 раз ме-
нее концентрированном (вариант 1). Нанесение препаратана
гель в разбавленном рабочем буфере нашло широкое примене-
ние в силу простоты и достаточно хорошей эффективности этого
приема.
Другой очень эффективный способ сужения полос — исполь-
зование градиента пористого геля. В этом случае при миграции
вдоль геля передний край каждой полосы все время оказывает-
ся в области чуть более концентрированного геля, чем задний.
Молекулы белка, расположенные ближе к переднему краю по-
лосы, тормозятся трением о гель сильнее, чем идущие сзади, что
и приводит к непрерывному сужению полос в ходе их продви-
жения по гелю. Силу этого эффекта убедительно продемонстри-
ровали специалисты фирмы «Рharmaciа» на выпускаемых этой
фирмой стандартных пластинах с градиентом концентрации
ПААГ (4 — 30%). Начав электрофоретическое фракционирова-
ние белков сыворотки, они затем прерывали его и оставляли
пластину на 60 ч при комнатной температуре. За это время диф-
фузия полностью размывала сформировавшиеся было белковые
полосы. Однако через 6 ч после возобновления электрофореза
удавалось получить четкую картину полос, содержащуювсе
обычно наблюдаемые компоненты сыворотки (рис. 16).
Введение мочевины и b-меркаптоэтанола.
Некоторые артефакты
Высокая концентрация белков в зонах может привести к их
осаждению или, по крайней мере, образованию агрегатов: ди-
мерных, тримерных и более крупных белковых комплексов, ко-
торые могут давать дополнительные полосы. Агрегация проис-
ходит, в основном, за счет водородных связей. Для ее предотвра-
щения в рабочий буфер нередко добавляют мочевину в концент-
рации 4 — 8 М. Она должна быть хорошо очищена, в частности
деионизована. Кроме того, следует всегда иметь в виду возмож-
ность частичного разложения мочевины с образованием циано-
вой кислоты и карбамоилирования белков. Это особенно отно-
сится к долго хранящимся буферам, поэтому лучше добавлять
сухую мочевину в буфер непосредственно перед приготовлением
геля. Если все же возникает подозрение, что некая полоса появи-
лась за счет карбамоилирования, то следует добавить в исход-
ный препарат цианат и посмотреть, не усилится ли подозритель-
ная полоса. Для предварительной деионизации маточный рас-
твор мочевины (10 М) суспендируют с бифункциональной ионо-
обменной смолой (например, AG 501 ´ 8) в соотношении 5 г
смолы на 100 мл раствора в течение часа при комнатной темпе-
ратуре.
b-Меркаптоэтанол в концентрации 1 — 5% нередко вносят в
исходный белковый препарат для предохранения его от окисле-
ния и образования лишних дисульфидных мостиков. Более энер-
гичное воздействие с разрывом нативных дисульфидных связей
и разделением белковых субъединиц производят путем нагрева-
ния белкового раствора до 90 — 100° в присутствии не только b-
меркаптоэтанола или его аналогов, но н ДДС-Na.
В некоторых случаях при использовании боратного буфера
или буферов, содержащих аминокислоты (глицин, аланин), воз-
можно образование комплексов компонентов буфера с белками.
Их электрофоретическая подвижность может оказаться несколь-
ко иной, чем у чистых белков, и соответствующие белковые по-
лосы раздвоятся. Проверить такого рода артефакт можно по-
вторным электрофорезом. В силу равновесного характера про-
цесса образования комплексов каждая из двух полос дублета
при ее повторном электрофорезе в том же буфере даст снова две
полосы.
В главе 1 уже упоминалось об опасности, которую представ-
ляют для белков сохраняющиеся в геле после полимеризации
долгоживущие свободные радикалы. Указывалось также на спо-
соб их удаления — «преэлектрофорез», т. е. пропускание тока
через гель без внесения препарата. Добавим, что в особых слу-
чаях для полной очистки от радикалов во время преэлектрофо-
реза через гель пропускают такие связывающие их соединения,
как цистеин, меркаптоуксусная (тиогликолевая) кислота или
гидрохинон.
При фракционировании очень малых количеств белка может
оказаться заметной сорбция их на геле (белки «размазывают-
ся» по гелю). Блокировать это явление можно, вводя в исход-
ный препарат дополнительный быстро мигрирующий белок. Про-
ходя через гель впереди всех остальных белков препарата, он
насыщает собой центры неспецифической сорбции в геле.
Лидирующие красители
Для наблюдения за ходом электрофореза в исходный препа-
рат вносят краситель, мигрирующий в том же направлении, что
и фракционируемые белки. Он не должен заметным образом свя-
зываться с белками, а скорость его продвижения по гелю долж-
на быть заведомо больше, чем у наиболее быстро мигрирующего
белка. Вместе с тем краситель не должен слишком сильно от-
рываться от белков, чтобы его прохождению до конца пласти-
ны или трубки соответствовало использование большей части
находящегося в них геля для фракционирования белков. Быть
может, по ассоциации с велосипедными гонками за лидером, этот
краситель называют лидирующим («tracker dye»).
В щелочных и нейтральных буферах, когда кислые белки за-
ряжены отрицательно и мигрируют к аноду, а также для любых
белков в комплексе с ДДС-Na (см. ниже) используют отрица-
тельно заряженные красители. Наибольшее распространение по-
лучил бромфеноловый синий, имеющий достаточно сложную
структуру; в его состав, в частности, входят два дибромфеноль-
ных остатка. Иногда используют еще более сложно построен-
ный краситель — ксиленцианол, электрофоретическая подвиж-
ность которого примерно вдвое ниже, чем бромфенолового сине-
го, поэтому его используют при фракционировании крупных бел-
ков и нуклеиновых кислот.

Для характеристики электрофоретической подвижности бел-
ка в данных условиях электрофореза принято указывать отно-
шение расстояния, пройденного белковой полосой от начала ра-
бочего геля, к аналогичному расстоянию до полосы красителя
в этом же геле. Это отношение, как и в хроматографии, обозна-
чают Rf.
В качестве положительно заряженного красителя для элект-
рофореза в кислой среде, когда белки мигрируют в направлении
катода, используют метиловый зеленый или пиронин.

РАЗДЕЛЕНИЕ БЕЛКОВ ПО РАЗМЕРАМ И ЗАРЯДУ
В этом случае в электродных резервуарах и для полимериза-
ции ПААГ используют один и тот же буфер, поэтому такую си-
стему иногда называют непрерывной, или простой. Строго гово-
ря, непрерывность нарушается тем, что буфер, в котором вносят
белковый препарат, с целью концентрирования исходной зоны
разбавляют в 5 — 10 раз водой.
Подбор оптимальных условий электрофореза сводится к вы-
бору следующих параметров: пористости геля и степени его
сшивки, т. е. значений Т и С (см. главу 1); природы, концентра-
ции и рН буфера; диссоциирующих добавок (если это необхо-
димо); максимально допустимой мощности, напряжения и силы
тока, а также продолжительности разделения; объема и кон-
центрации исходного препарата; процедуры предварительной об-
работки препарата.
Выбор значений T и С в зависимости от молекулярных масс
разделяемых белков был подробно обоснован в главе 1. Чаще
всего с белками работают при T = 3,5 — 20 и C = 1 — 3.
Выбор рабочего буфера
Для обеспечения хорошей электрофоретической подвижности
и сохранения вместе с тем ощутимых различий в суммарных
электрических зарядах белков выбирают рН буфера, отличаю-
щийся на 3 — 4 единицы от среднего значения р I для белков дан-
ного типа. Если эти значения неизвестны, то желательно соста-
вить себе представление о характере зарядов белков при раз-
личных рН по характеру их сорбции на ионообменных смолах.
Для кислых белков часто используют буфер с рН 8,9, для
щелочных — с рН 4,3 — 4,5. В качестве слабощелочных буферов
для кислых белков применяют Трис-HCl, Трис-глициновый,
Трис-боратный или Трис-барбитуратный. Для щелочных белков
чаще всего используют К-ацетатный и Трис-ацетатный буферы,
а иногда, если белок это выдерживает, то и просто уксусную
кислоту в концентрации 0,9 М или 5% (0,9 М СН3СООН имеет
рН 2,4; 0,1 М — рН 2,87). О преимуществах буферов, не содер-
жащих легко подвижных ионов (С1–, К+), было сказано выше.
Концентрацию буфера выбирают, исходя из допустимой мощ-
ности тепловыделения, и вместе с тем так, чтобы напряженность
электрического поля в геле не превышала 15 В/см. При более
высоких значениях напряженности возможны искажения формы
белковых полос. Для 0,1 М Трис-глицинового буфера, напри-
мер, такой напряженности отвечает плотность тока 20 мА/см2.
Это означает, что через трубку диаметром 6 мм и длиной 8 см
в этом случае можно пропускать ток до 5,5 мА при напряжении
120 В. Поскольку трубки довольно трудно охлаждать, обычно
используют меньшие величины тока — около 3 мА на трубку.
Для вертикальной пластины размером 10 ´ 14 см и толщиной
1,5 мм в этих же условиях сила тока составит около 30 мА при
напряжении около 210 В. Разумеется, эти цифры приведены
лишь для ориентировки, и для других условий электрофореза
они окажутся иными. Впрочем, вариации для хорошо выбран-
ных систем оказываются не очень значительными, так как для
любой буферной системы сохраняется одна и та же тенденция —
использовать максимально возможную напряженность поля при
максимально допустимой с точки зрения теплоотвода мощности
тока.
В двух приведенных простейших примерах напряженность
поля в геле можно рассчитывать просто путем деления напря-
жения, указываемого источником тока, на длину геля. При этом
пренебрегают падением напряжения в электродных резервуа-
рах — на участке цепи между электродами и гелем. В том слу-
чае, когда электродные буферы находятся в непосредственном
контакте с гелем, это вполне допустимо.
Иначе обстоит дело в приборах с горизонтально расположен-
ными пластинами. Например, для электрофореза в приборе типа
«Мультифор» при ширине пластины 20 см и толщине геля 1 мм
плотности тока 20 мА/см2 соответствует его сила 40 мА. Паде-
ние напряжения в самом геле длиной 10 см при напряженности
поля 15 В/см составит, очевидно, 150 В. Однако напряжение, ко-
торое надо установить на источнике тока, должно быть сущест-
венно выше ввиду значительного падения напряжения на фити-
лях, соединяющих буферные резервуары с гелем. Это падение
напряжения трудно оценить, поэтому для выяснения значения
напряженности поля в самом геле прибор «Мультифор» снабжен
специальным вольтметром, измеряющим падение напряжения
между двумя точками поверхности геля, находящимися на опре-
деленном расстоянии друг от друга. В рассмотренном примере
использовали Трис-глициновый буфер с довольно высоким элект-
рическим сопротивлением. Мощность, расходуемая в приборе
«Мультифор», в этом случае составит всего лишь 6 Вт (150 В ´
´ 0,04 А). Иная картина получится, если тот же гель заполиме-
ризовать в 0,1 М Na-фосфатном буфере с рН 7,1. Электропровод-
ность этого буфера довольно высока за счет легко подвижных ио-
нов Na+. Измерения в том же приборе показывают, что уже при
напряженности поля 5 В/см (падение напряжения — 50 В на
пластину) плотность тока в геле возрастает до 100 мА/см2. Если
довести напряженность поля в геле до 15 В/см, то сила
тока через пластину сечением 2 см2 (20 ´ 0,1 см) составит
600 мА. При падении напряжения на геле, равном 150 В, это
привело бы к совершенно неприемлемому уровню тепловыделе-
ния (мощность 90 Вт). Однако дойти до этого режима практи-
чески невозможно ввиду большого падения напряжения на фи-
тилях, их разогрева, обсыхания и дальнейшего увеличения со-
противления. В итоге, при работе с фосфатным буфером прихо-
дится ограничивать силу тока (~200 мА) и работать при пони-
женных значениях напряженности электрического поля. Соот-
ветственно увеличивается и продолжительность электрофореза.
Еще раз подчеркнем, что электропроводность любого буфера
определяется не только концентрацией, но степенью и характе-
ром его ионизации (близостью рН к р K a буфера и подвижностью
образующих ионов). Концентрации рабочих буферов в пределах
0,05 — 0,1 М можно считать ориентировочно нормальными, хотя
для слабо ионизированных буферов, используемых вблизи гра-
ницы их буферной области, можно встретить в литературе и бо-
лее высокие значения концентрации — вплоть до 0,4 М.
В непрерывной системе сопротивление геля не должно замет-
ным образом изменяться в процессе электрофореза. Как след-
ствие этого, не должна изменяться и расходуемая мощность. По-
вышение напряжения источника, работающего в режиме посто-
янного тока, или уменьшение силы тока при постоянном напря-
жении говорят о каких-то неполадках в электрической цепи, на-
пример: о высыхании фитилей или нарушении контактов между
ними и гелем.
Использование мочевины
Уже указывалось, что для предотвращения агрегации белков
в рабочий буфер геля нередко вводят мочевину в концентрации
от 2 до 8 М. Ее, разумеется, добавляют и в исходный белковый
препарат. В электродные буферы вносить мочевину не нужно,
так как, не будучи заряженной, она не мигрирует в геле, а сле-
довательно, и не нуждается в пополнении. На электропроводно-
сти буфера присутствие мочевины практически не сказывается.
Однако под влиянием нового окружения могут изменяться р К
отдельных групп и суммарный заряд белка. Это может заметно
повлиять на конфигурацию, а следовательно, и на подвижность
белков.
В концентрированных растворах мочевины происходит дена-
турация белков, часть дисульфидных мостиков рвется и полипеп-
тидная цепочка, утратив вторичную структуру, ведет себя как
хаотический клубок. Денатурация не является полной и может
быть обращена. Степень и обратимость денатурации зависят от
природы белка и концентрации мочевины, поэтому при выборе
этой концентрации иногда приходится искать компромисс меж-
ду опасностью агрегации белков и угрозой их необратимой де-
натурации. Об очистке мочевины было сказано выше; добавим
только, что образование цианата в растворах мочевины идет ус-
коренно при щелочных рН, поэтому щелочные буферы с добав-
кой мочевины следует использовать сразу после их приготовле-
ния.
Для составления геля пользуются обычно «маточными» рас-
творами повышенной концентрации. Удобно, например, приго-
товить 40%-ный водный раствор смеси мономеров (T = 40). Ha-
помним, что Т выражает процентное отношение массы обоих мо-
номеров к конечному объему их раствора, а С — отношение мас-
сы NN/-мeтилeнбиcaкpилaмидa к сумме масс двух мономеров.
Отсюда следует, что С не изменяется при разбавлении маточ-
ного раствора. Так, если предполагается иметь для рабочего
геля параметры Т = 10 и С = 2,6, то при составлении маточного
раствора можно взять T = 40 и С = 2,6. Практически это означа-
ет, что надо отвесить (40 ´ 2,6)/100 = 1,04 г метиленбисакрилами-
да и 40 — 1,04 = 38,96 г акриламида и растворить их в воде до ко-
нечного объема 100 мл. Маточный раствор буфера может иметь
двух- или пятикратную концентрацию. В последнем случае по-
лезно проверить, что рН буфера сохраняется при соответствую-
щем разбавлении. Смесь расчетных объемов маточных раство-
ров мономеров и буфера доводят до нужного объема водой.
Персульфат аммония лучше добавлять в минимальном объ-
еме, который можно не учитывать. Для этого готовят концент-
рированный, обычно 10%-ный, маточный раствор персульфата,
остатки которого вскоре приходится выбрасывать, так как он
не хранится. Объемом вносимого в смесь ТЕМЕД также всегда
можно пренебрегать. Выбор содержания персульфата аммония
и ТЕМЕД, порядок их внесения в раствор мономеров, необхо-
димость деаэрации и контроль за процессом полимеризации геля
были подробно рассмотрены в главе 1,
Для приготовления геля с высоким содержанием мочевины ее
добавляют во все маточные растворы. При растворении моно-
меров до Т = 40 концентрацию мочевины приходится ограничи-
вать значением 2 — 3 М. Зато маточный раствор буфера можно
приготовить на 10 М мочевине и такой же концентрации раствор
ее использовать для доведения до расчетного объема вместо
воды.
Особо гидрофобные белки, например тяжелые цепи миозина,
при концентрировании их в полосах агрегируют даже в присут-
ствии 8 М мочевины. Во избежание этого их можно обработать
фенолом, который играет роль мягкого детергента. Белок сна-
чала растворяют в буфере до безопасной концентрации, а потом
переводят в смесь, состоящую из 50% фенола, 25% уксусной
кислоты, мочевины до концентрации 2 М и воды. Электрофорез
проводят в ПААГ, полимеризованном в 35%-ной уксусной кис-
лоте с 5 М мочевины [d'Abbis et al., 1979].
В некоторых случаях бывает необходимо при электрофорезе
сохранить ферментативную активность белка — либо для по-
следующей его элюции и использования, либо для обнаружения
с помощью биологического теста, т. е. по превращению субстра-
та ферментативной реакции (см. ниже). Использование в этом
случае концентрированного раствора мочевины является неже-
лательным, и уменьшать опасность агрегации приходится за счет
снижения загрузки геля. Чувствительность биологических тестов
зачастую позволяет это сделать. Необходимо точно проверить
устойчивость фермента при выбранной величине рН рабочего
буфера. При этом следует иметь в виду, что истинная величина
рН в геле примерно на 0,5 ед. больше, чем у используемого ще-
лочного буфера, и на 0,5 меньше, чем у кислого [Shuster, 1971].
Иногда следует проверить сохранность ферментативной ак-
тивности белка в ходе электрофореза в связи с возможностью
разобщения фермента с другими белками или необходимыми
для его работы кофакторами. Такую проверку можно проводить
следующим образом: на разных стадиях электрофореза выре-
зать и гомогенизировать участки геля, содержащие соответству-
ющую белковую полосу, и прямо в гомогенате, в сопоставимых
условиях, проверять сохранение активности фермента, исполь-
зуя возможность диффузии субстрата реакции в гель, а ее про-
дукта — из геля.
Загрузка геля и подготовка препарата
Исходный белковый препарат растворяют в том же рабочем
буфере, но меньшей концентрации (в 5 — 10 раз). По рассмот-
ренным выше причинам это приводит к значительному сужению
исходной зоны белков при ее вступлении в гель. Если электро-
форез идет в присутствии мочевины, то ее концентрация в раз-
бавленном буфере должна быть такой же, как в рабочем буфе-
ре геля. Еще раз подчеркнем необходимость удаления солей из
препарата; в противном случае эффект концентрирования белка
при вступлении в гель будет смазан. Недавно был предложен
простой и остроумный способ диализа белкового раствора в кап-
ле на плавающем мембранном фильтре [Marusyk, Sergeant,
1980].
Иногда проводят предварительное полное восстановление
белка путем прединкубации его в течение ночи при комнатной
температуре в буфере с рН 8,5 — 9, содержащем 0,1 М (b-меркап-
тоэтанола и 9 М мочевины (щелочное значение рН буфера спо-
собствует восстановительному эффекту b-меркаптоэтанола).
В раствор препарата добавляют до 10% глицерина или саха-
розы, чтобы облегчить его подслаивание под электродный буфер
(см. выше). Наконец, в препарат вносят еще и краситель, на-
пример бромфеноловый синий до концентрации 0,01%. Мигра-
ция этой «лидирующей» зоны до конца геля определяет момент
окончания электрофореза. Заметим кстати, что при последую-
щей фиксации белков бромфеноловый синий обесцвечивается.
Если далее предполагается определение величины Rf, то поло-
жение окрашенной полоски сразу после извлечения геля из фор-
мы следует отметить (например, вколоть в гель тонкую прово-
лочку).
Как уже подчеркивалось, препарат должен быть заведомо
свободен от пыли, нерастворенных белков и других частиц. Пос-
ле внесения препарата в трубку или карман пластины на 5 —
15 мин включают напряжение, пониженное примерно вдвое про-
тив расчетного. За это время лидирующий краситель должен
полностью войти в гель. Такая процедура улучшает условия
формирования исходной белковой полосы в геле. Затем перехо-
дят на расчетный режим электрофореза по напряжению и силе
тока.
Вопросы фиксации, окраски и других методов обработки бел-
ков после электрореза,как и способы определения радиоактив-
ности и элюции белков, рассмотрены отдельно ниже.
Некоторые примеры
Теперь для иллюстрации целесообразно привести некоторые
примеры, отнюдь не отражающие всего безграничного разнооб-
разия приложений электрофореза белков, даже в его простей-
шем, только что рассмотренном варианте.
Обзорный клинический анализ белков сыворотки человека. В приборе с
горизонтальным гелем (типа «Мультифор») одновременно можно обследовать
сыворотку крови 20 пациентов. Условия разделения: гель указанных выше
размеров, T = 3,5, С = 2,6; 0,1 М Трис-глициновый буфер, рН 8,9; напряжен-
ность поля 15 В/см, сила тока 45 мА; температура охлаждающей воды 10°;
преэлектрофорез в течение 30 мин при силе тока 60 мА. Препараты сыворотки
разбавляют в отношении 1: 3 тем же буфером, разведенным в 10 раз. Объем
каждого препарата 5 мкл. В первые 10 мин электрофореза силу тока снижа-
ют до 20 мА. Скорость миграции бромфенолового синего 4,5 см/ч; общая про-
должительность электрофореза 1,3 ч. На рис. 17, A сопоставлены картины
фракционирования белков сыворотки 10 пациентов с различными заболева-
ниями (по два препарата от каждого). Крайние слева и справа пары треков
содержат сыворотку нормальных доноров. Направление миграции белков —
снизу вверх. Интенсивные пятна вверху — низкомолекулярные компоненты
сыворотки.
Заметно лучше, особенно в области крупных белков, те же препараты
разделяются в более концентрированном геле (T = 7,5; С = 2,6), однако в этом
случае часть наиболее крупных белков выпадает в осадок на границе геля

(рис. 17, Б). Скорость миграции бромфенолового синего 1,8 см/ч при рабочей
силе тока 40 мА; продолжительность разделения 2,8 ч [Fehrnström, Moberg,
1977].
|










