Хотя для коротких олигопептидов присутствие мочевины ока-
зывается полезным, при электрофорезе белков ее не следует
вводить в гель. Мочевина вносит конформационные изменения в
структуру белка. Влияние этих изменений как на степень связы-
вания ДДС-Na, так и на характер миграции комплекса белок —
ДДС-Na в геле еще не изучено.
60
Из аналогичных соображений следует удалять из белкового
препарата перед его обработкой ДДС-Na другие детергенты, в
частности неионные. Иногда это удается добиться за счет вне-
сения в препарат еще большего избытка ДДС-Na, с тем чтобы
он вытеснял неионный детергент из связи с белком, образуя с
ним свободно растворенные смешанные мицеллы. Такие мицел-
лы могут «уходить» от комплекса белок — ДДС-Na, быстро миг-
рируя в электрическом поле [Nielsen, Reynolds, 1978]. Широко
используемый для растворения мембранных белков Тритон
Х-100 сильно мешает проведению электрофореза в ПААГ с
ДДС-Na. Его можно извлечь из белкового препарата экстрак-
цией хлороформом. Чтобы предотвратить выпадение плохо рас-
творимых белков в осадок, перед экстракцией к препарату сле-
дует добавить ДДС-Na до 1%, который в хлороформ не перехо-
дит [Horikawa, Ogawara, 1979].
Выбор рабочего буфера геля
Из изложенного ясно, что рН буфера в этом варианте элект-
рофореза не играет существенной роли, так как заряд белка оп-
ределяется его комплексированием с ДДС-Na. Обычно работают
с нейтральными буферами. По традиции, идущей еще от пионер-
ской работы Вебера и Осборн [Weber, Osborn, 1969], часто ис-
пользуют 0,1 М Na-фосфатный буфер, рН 7,1. Его концентрация
обусловлена только желанием обеспечить 10-кратное различие в
электропроводностях буферов геля и препарата. В качестве по-
следнего берут 0,01 М Na-фосфат, рН. 7,1. Как уже указывалось,
такое различие обеспечивает концентрирование исходной поло-
сы при переходе белков из буфера препарата в гель. Однако
ввиду большой электропроводности Na-фосфатного буфера на-
пряженность поля приходится ограничивать значением 5 В/см,
что замедляет процесс разделения, поэтому вместе Na-фосфат-
ного имеет смысл использовать другой, менее проводящий бу-
фер, например имидазолфосфатный, рН 7. Молярность рабочего
буфера можно снизить до 0,05 М, сохранив для буфера препара-
та концентрацию 0,01 М. Это позволит значительно увеличить
напряженность поля и сократить продолжительность электрофо-
реза.
В электродных резервуарах обычно используют тот же буфер,
что и в геле. В буферы вносят и ДДС-Na до концентрации 0,1%.
Необходимость присутствия ДДС-Na в рабочем буфере геля
одно время оспаривалась [Stoklosa, Latz, 1974]. Авторы цити-
руемой работы утверждали, что ДДС-Na образует с белком
прочный комплекс, не разрушающийся в процессе электрофоре-
за. В более поздней работе, напротив, подчеркивается необходи-
мость введения ДДС-Na в буфер геля или хотя бы в катодный
буфер, откуда он будет поступать в гель. Показано, что ДДС-Na
может выходить из комплекса с белком. В тех случаях, когда
скорость миграции детергента в геле намного больше, чем бел-
ка, последний будет терять ДДС-Na и изменять свою подвиж-
ность в геле [Kubo et al., 1979]. Это обстоятельство было пред-
ложено использовать в своеобразном процессе двухстадийного
электрофореза [Sorimachi, Condliffe, 1977]. После обычной об-
работки ДДС-Na и b-меркаптоэтанолом авторы сначала вели
электрофорез в течение 2 ч в 10%-ном ПААГ, полимеризован-
ном, как обычно, в 0,1 М Na-фосфатном буфере (рН 7) с 0,1%
ДДС-Na. Через некоторое время буфер в катодном резервуаре
заменяли на такой же, но без ДДС-Na. Это приводило к быст-
рой очистке геля от детергента, мигрирующего к аноду. Затем
от ДДС-Na освобождались и белки. Дальнейшее разделение шло
уже по заряду белков. При этом рН буфера можно с самого на-
чала выбрать оптимальным именно для второго этапа разделе-
ния, поскольку на первом этапе в присутствии ДДС-Na рН роли
не играет.
Подготовка белкового препарата
На эту операцию следует обратить особое внимание. Сопо-
ставлять молекулярные массы белков по скорости их миграции
можно только в том случае, когда есть уверенность в полной де-
натурации белка при обработке его ДДС-Na.
Вебер и сотрудники ввели широко употребимую до сих пор
процедуру обработки. Белковый препарат диализуют против
0,01 М Na-фосфата, содержащего 0,1% ДДС-Na и 0,1% b-мер-
каптоэтанола, удаляя из него остатки соли. Затем концентрации
ДДС-Na и b-меркаптоэтанола увеличивают до 1% (каждого) и
прогревают препарат при 100° в течение 2 мин. Концентрация
белка при этом должна составлять около 1 мг/мл [Weber et al.,
1972]. Если предполагается присутствие в препарате протеаз,
прогрев можно продлить до 5 мин. Показано, например, что
трипсин и химотрипсин сохраняют значительную каталитиче-
скую активность в.присутствии 1% ДДС-Na, но прогрев при
100° в течение 5 мин эту активность полностью подавляет [Рог-
tci, Preston, 1975]. Если же при высокой температуре наблюда-
ется неферментативный гидролиз белка, то прогревание при 100°
можно заменить инкубацией при 37° в течение 2 ч. Перед нане-
сением препарата на гель в него дополнительно добавляют b-
меркаптоэтанол до концентрации 4 — 5%.
Несмотря на жесткость описанной обработки, авторы метода
рекомендуют при определении молекулярной массы малоизу-
ченного белка проверить полноту его денатурации. Для этой це-
ли они предлагают обрабатывать контрольный препарат белка
по более сложной прописи, гарантирующей его полную денату-
рацию (7 М гуанидинхлорид и 1,5%-ный b-меркаптоэтанол с по-
следующим алкилированием йодацетамидом). После этого фор-
мируют комплекс белка с ДДС-Na и сопоставляют картины
электрофореза белка, обработанного обычным способом, и кон-
трольного препарата.
С другой стороны, некоторые белки, в частности липопротеи-
ды, при кипячении с 1 % ДДС-Na и 1 % b-меркаптоэтанола мо-
гут выпасть в осадок и не войти в гель. В этих случаях прихо-
дится уменьшать концентрацию b-меркаптоэтанола или не вво-
дить его совсем.
При повышенной температуре иногда обнаруживается уси-
ленный протеолиз исходных белков. Известно, что денатурация
белка многократно увеличивает его доступность для атаки про-
теолитическими ферментами. ДДС-Na не входит в число их эф-
фективных ингибиторов. Если опасность протеолиза существу-
ет, в исходный препарат до денатурации белков вводят мощные
ингибиторы протеаз: фенилметилсульфонилфторид (300 мкг/мл) и 1,10-фенантролин (1 мг/мл).
Проведение электрофореза
Что касается режима электрофореза, т. е. выбора рабочего
напряжения, силы тока и продолжительности разделения, то
здесь остаются в силе все те соображения, которые были приве-
дены в предыдущем разделе. Вкладом ДДС-Na в электропро-
водность рабочего буфера можно при этом пренебречь. Электро-
форез не следует вести на холоду, так как это может повлечь за
собой выпадение ДДС-Na в осадок (его растворимость очень
сильно зависит от температуры). При длительном электрофоре-
зе электродные буферы следует обновлять.
Для белков с молекулярной массой менее 12000 определение
ее электрофорезом в ПААГ с ДДС-Na становится ненадежным
даже при высокой концентрации геля. В этом случае локальные
различия в составе и заряде белков, влияющие на их взаимо-
действие с ДДС-Na, уже не усредняются. Степень надежности
определения молекулярной массы малых белков и олигопепти-
дов увеличивается, как было указано, при введении в буфер 8 М
мочевины, а также при увеличении степени сшивки геля.
В 12,5%-ном ПААГ с 0,1% ДДС-Na в присутствии 8 М мочеви-
ны при электрофорезе малых (данзилированных) олигопептидов
с диапазоном М от 1 до 12 тыс. дальтон наблюдалась хорошая
линейная зависимость lg M от Rf [Kato et al., 1975], однако точки
для инсулина (М= 5782) и глюкагона (M = 3483) из графика
этой зависимости выпадали.
Разделение улучшается в случае малых исходных количеств
белка (1 — 5 мкг) и длинных гелей с расстоянием миграции око-
ло 15 см. При определении молекулярной массы неизвестного
белка лучше начать подбор условий с 7,5%-ного ПААГ и соот-
ветствующего набора стандартных маркеров. Затем следует
поварьировать условия — и, в частности, сопоставить значения
молекулярной массы исследуемого белка, получающиеся в ге-
лях с различным содержанием акриламида.
В цитированной выше работе Вебера и др. приведен список
около 40 стабильных белков, которые можно использовать в ка-
честве стандартных маркеров в интервале М 12 — 200 тыс. даль-
тон. Однако молекулярные массы продажных белков, особенно
при М > 70 тыс., далеко не всегда надежно известны, поэтому
фирма BDH при разработке своих стандартных наборов марке-
ров пошла по другому пути. Она готовит каждый из наборов на
основе только одного белка с хорошо известным значением М,
сшивая его в димеры, тримеры и далее вплоть до гексамеров
обработкой глутаровым альдегидом. Аналогичный подход в свое
время был описан и в лабораторной практике [Inouye, 1971].
Кстати, автор цитируемой работы проводил одновременно и дан-
зилирование своих маркерных белков, что позволяло ему фик-
сировать их положение при УФ-освещении без окраски геля.
При определении молекулярной массы коллагена использо-
вание глобулярных белков в качестве маркеров возможно в том
случае, если строить график зависимости от расстояния мигра-
ции. не самой молекулярной массы белка, а длины его полипеп-
тидной цепи (логарифма числа аминокислотных остатков). Ско-
рость миграции зависит именно от размера молекулы белка —
переход к молекулярной массе предполагает некое среднее ее
значение, приходящееся на один остаток. Между тем, в состав
коллагенов входит необычно много легких аминокислот: глици-
на, аланина, пролина [Noelken et al., 1981].
Окрашивание и элюция белков
Эти вопросы рассмотрены ниже в специальных параграфах,
но все же имеет смысл несколько замечаний, связанных с ис-
пользованием ДДС-Na, сделать именно здесь
После электрофореза в присутствии ДДС-Na гель окрашива-
ют, как обычно, например, в 0,25%-ном растворе СВВ R-250
(см. ниже) в 9%-ной уксусной кислоте, содержащей 45% мета-
нола, в течение нескольких часов при комнатной температуре, а
затем отмывают в 7,5%-ной уксусной кислоте с 5% метанола и
добавкой ионообменника AG 501 ´ 8 для связывания красителя.
Фиксация белков идет одновременно с их окрашиванием. Од-
нако следует иметь в виду, что ДДС-Na является эффективным
детергентом и препятствует осаждению, а следовательно, и
фиксации белков. Для малых белков фиксация при окрашива-
нии может оказаться ненадежной. Их лучше фиксировать пред-
варительно, вымачивая гель в 10%-ной трихлоруксусной кисло-
те (ТХУ). ДДС-Na, находясь в комплексе с белком, еще и пре-
пятствует в некоторой мере самому процессу окрашивания.
10%-ная ТХУ частично отмывает белок от ДДС-Na. Еще лучше
это можно делать, вымачивая гель в 50%-ном растворе ТХУ (в
течение ночи). Изопропанол ускоряет вымывание ДДС-Na, по-
этому его целесообразно включить в фиксирующий белки рас-
твор.
Можно окрашивать белки в геле, вымачивая его прямо в
0,05%-ном растворе СВВ R-250 в 10%-ной ТХУ. Краситель до-
вольно плохо растворим в ТХУ, поэтому происходит его распре-
деление между жидкой фазой и белками в пользу последних.
Белковые полосы проявляются очень быстро, и гель можно от
красителя не отмывать. Однако чувствительность окраски не-
сколько снижена по сравнению со стандартной процедурой. Ни-
же будут оценены возможности повышения ее чувствительности
с помощью таких флюоресцентных красителей, как данзилхло-
рид, флюоресцамин, ортофталевый альдегид и др. Здесь умест-
но отметить, что их присоединение к белкам исходного препара-
та не влияет на электрофоретическую подвижность этих белков.
Белок из неокрашенного геля можно извлекать одним из под-
робно рассмотренных ниже способов, в частности повторной
элюцией из кусочков геля встряхиванием в течение 6 — 12 ч при
37° с четырехкратным объемом 0,01 М бикарбоната аммония с
0,1% ДДС-Na. Объединенные элюаты лиофилизируют, удаляя
бикарбонат, и растворяют в воде до 0,1 исходного объема. За-
тем для удаления ДДС-Na добавляют 9 объемов (по отношению
к воде) ацетона, лучше подкисленного, так как в нем хорошо
растворяется ДДС-Na. Белок осаждают центрифугированием и
промывают 90%-ным ацетоном. В случае необходимости более
полного освобождения белков от ДДС-Na лиофилизированный,
как указано выше, элюат из геля растворяют снова в 0,1 объе-
ма, но не воды, а 0,05 М раствора бикарбоната аммония с 6 М
мочевиной (для предотвращения неспецифической сорбции бел-
ка на смоле). Раствор пропускают через микроколонку с Do-
wex 1 ´ 2 (200 — 400 МЕШ), уравновешенную тем же буфером.
Мочевину затем удаляют диализом.
Электрофорез белков в комплексе с ДДС-Na сейчас в подав-
ляющем большинстве случаев ведут в системе, предложенной
Лэммли [Laemmli, 1970]. В этой системе обработка белка
ДДС-Na совмещена с использованием описанной ниже схемы
ступенчатого электрофореза. Такое усложнение не кажется
всегда оправданным, поскольку достаточно хорошее сужение
исходной белковой полосы можно получить просто за счет раз-
бавления буфера, в котором вносится препарат. Больший инте-
рес, по-видимому, представляет сочетание обработки белка
ДДС-Na с использованием градиента пористости геля. Этот при-
ем будет рассмотрен ниже.
Электрофорез белков в комплексе с ДДС-Na был успешно
использован для фракционирования белков хроматина без их
предварительной очистки. Хроматин диализовали в течение 12 ч
против 0,01 М Na-фосфата с 1% ДДС-Na и 1% b-меркаптоэта-
нола при комнатной температуре, а затем еще 12 ч — против
свежей порции такого же раствора при 37°. Только после этого
его прогревали в течение 3 мин при 100° и диализовали еще 2 раза по 12 ч против того же буфера, но содержащего вдесяте-
ро меньше ДДС-Na и (b-меркаптоэтанола. При такой обработке
ДНК отделяется от белка и не мешает протеканию последующе-
го электрофореза белков хроматина [Elgin, 1975].
СТУПЕНЧАТЫЙ ЭЛЕКТРОФОРЕЗ
(DISC-ELECTROPHORESIS)
Отличительной особенностью этой системы является полиме-
ризация в одной трубке или пластине двух гелей: рабочего, мел-
копористого, и непосредственно над ним — «формирующего»,
крупнопористого. Кроме степени пористости, эти два геля резко
различаются по рН и молярности буферов, в которых они поли-
меризуются. Отсюда и название системы — ступенчатый элек-
трофорез. По-английски его сокращенно называют «disc-electro-
phoresis» (от слова «discontinuous»—прерывистый). Этот вид
электрофореза был предложен Орнстейном и Дэвисом еще в са-
мом начале становления метода электрофореза в ПААГ [Ornste-
in, Davis, 1964].
Пористость, длина и выбор буфера для нижнего (рабочего)
геля определяются точно такими же соображениями, что и для
простого непрерывного электрофореза. Единственное, что здесь
своеобразно—это обязательное использование в составе рабо-
чего буфера быстроподвижных ионов, мигрирующих в том же
направлении, что и белки, например: иона Cl- для щелочных бу-
феров или иона К+—для кислых. Выше отмечалось, что ис-
пользование таких ионов невыгодно, так как приводит к огра-
ничению напряженности поля и скорости миграции белков.
Однако в данном случае использование «быстрых» ионов дик-
туется самим существом метода, как это будет ясно из дальней-
шего изложения. Заметим, кстати, что если концентрация этих
ионов и зависит от рН буфера, то их электрофоретическая под-
вижность от рН совершенно не зависит.
В формирующем геле небольшой протяженности (1—3 см)
фракционирования белков не происходит. Наоборот, назначение
этого геля—собрать смесь всех белков перед переходом в ра-
бочий гель в одну узкую полосу, толщина которой может со-
ставлять сотые доли миллиметра независимо от первоначаль-
ного объема препарата. Для рабочего геля она является исход-
ной зоной для фракционирования, а это резко повышает его
разрешающую способность. Поскольку в формирующем геле
белки разделяться не должны, его концентрацию стараются сде-
лать минимальной (Т =2,5—3). Формирующий гель полимери-
зуют обычно в таком же по составу буфере, что и рабочий гель
(следовательно, он тоже содержит быстроподвижный ион), од-
нако по концентрации и значению рН эти буферы не одинаковы.
Буфер формирующего геля, как правило, почти нейтральный,
буфер рабочего геля — щелочной или кислый. Смысл этого раз-
личия будет раскрыт ниже.
Важную роль в ступенчатом электрофорезе играет выбор
электродного буфера, находящегося в контакте с белковым пре-
паратом и формирующим гелем («верхнего» буфера в случае
использования системы с вертикальным расположением геля).
В этом буфере подвижность иона, мигрирующего в том же на-
правлений, что и белок, должна сильно зависеть от рН. Для
этого удобно использовать цвиттерионы, например простые ами-
нокислоты (глицин и р-аланин). Их изоэлектрические точки ле-
жат в нейтральной области рН (для глицина р I =5,97). При
этом диссоциации карбоксила с потерей протона и появлением
отрицательного заряда соответствует p K a1=2,34, а ионизации
концевой аминогруппы с присоединением протона и образова-
нием положительного заряда—р К a2 =9,6. При рН 5,97 все мо-
лекулы глицина ионизированы по обоим концам и их суммар-
ный заряд равен нулю.
При сдвиге рН окружающей среды в щелочную сторону про-
исходит нейтрализация части молекул глицина по аминогруппе,
в то время как карбоксильные остатки всех молекул сохраняют
свой отрицательный заряд. Процесс этот—чисто статистиче-
ский, и для каждой отдельной молекулы можно говорить толь-
ко о большей или меньшей вероятности того, что она превратит-
ся в отрицательный ион или останется нейтральной. В совокуп-
ности же множества молекул при данном рН заряд будет нести
вполне определенная их доля. При незначительном сдвиге рН от
изоэлектрической точки, например при рН 6,8, эта доля будет
очень мала. При рН=р К a2 (9,6), согласно определению р К, уже
половина всех молекул должна быть нейтрализована по амино-
группе и, следовательно, заряжена отрицательно. Для фигури-
рующих ниже значений рН 8,3 и 8,9 количество отрицательных
ионов глицина будет меньше 50%, но все-таки значительным.
Описанные изменения доли заряженных молекул глицина
(или аланина) используются в системе ступенчатого электрофо-
реза. Для разных ступеней используют разные буферы, содер-
жащие, однако, в своем составе одно и то же слабое основание
или слабую кислоту, обеспечивающие собственно буферный эф-
фект: в щелочной буферной системе, где удобно фракциониро-
вать кислые белки, это может быть Трис, а в кислой системе
для разделения гистонов—уксусная кислота.
Рассмотрим для примера щелочную систему Орнстейна и
Дэвиса (рис. 21). Верхним буфером служит 0,005 М Трис, тит-
рованный добавлением глицина до рН 8,3. Глицин по отноше-
нию к Трису выступает в роли слабой кислоты. Для достижения
рН 8,3 концентрацию глицина приходится довести до 0,038 М.
При рН 8,3, как мы видели, значительная доля его молекул
должна быть заряжена отрицательно, что обеспечивает хорошую
электропроводность верхнего электродного буфера.
Крупнопористый формирующий гель полимеризуют в
0,0625 М Трис-HCl, рН 6,8. В таком же буфере вносят и препа-
рат (с добавкой, как обычно, до 10% глицерина или сахарозы).
Первоначально электропроводность этого буфера будет тоже
высокой благодаря ионам С1-. Их концентрация при рН 6,8 до-
статочно высока (см. выше).
Наконец, рабочий гель полимеризуют в 0,375 М Трис-HCl,
рН 8,9. Обращает на себя внимание высокая концентрация бу-
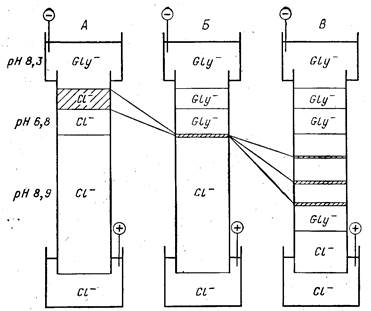
Рис. 21. Схема ступенчатого электрофореза
А — перед включением напряжения; Б — момент концентрирования препарата в тонкую
исходную полоску; В — фракционирование белковых зон
фера, необходимая по двум причинам. Во-первых, при рН 8,9
буферная емкость Трис-НСl уже мала, а в этом буфере должны
мигрировать сконцентрированные белковые полосы. Во-вторых,
относительное содержание ионов С1- при таком значении рН не-
велико, и для обеспечения необходимой электропроводности кон-
центрацию буфера приходится увеличивать. Нижний электрод-
ный буфер существенной роли не играет. Например, можно
взять 0,1 М Трис-HCl, рН 8,1.
Теперь рассмотрим процессы, протекающие в этой системе
после включения электрического напряжения. В первый момент
напряженность поля будет примерно одинаковой во всех ступе-
нях системы и начнется переход белков из буфера препарата в
формирующий гель. В это же время в верхней части формирую-
щего геля начнет развиваться новая ситуация. Под действием
поля ионы Cl- будут быстро уходить в направлении рабочего
геля, а на их место из электродного буфера будут поступать
ионы глицина. Но здесь они окажутся в буфере с рН 6,8. При
этом, как следует из изложенного, большинство молекул глици-
на восстановит заряд своих аминогрупп, нейтрализуется и пере-
станет участвовать в проведении тока. Сопротивление буфера
препарата, а за ним и верхней части формирующего геля резко
возрастет. Вместе с ним возрастет и напряженность поля. He-
многочисленные при рН 6,8 заряженные молекулы глицина
ускорят свое движение к аноду, обеспечивая непрерывность
электрического тока по всему гелю.
Неправильно представлять себе дело так, что только малое
число молекул глицина будет мигрировать в поле, а остальные
останутся на месте. Состояние диссоциации-ассоциации амино-
групп—это статистическое равновесие, захватывающее всю со-
вокупность молекул глицина, находящихся в растворе. Поэтому
все они (рывками) будут мигрировать в направлении анода, но
в каждое мгновение электрический заряд будет переносить лишь
небольшое число молекул, заряженных именно в это мгновение.
Но вернемся к событиям, развивающимся в геле.
Мы видели, что в верхней части формирующего геля возни-
кает область повышенной напряженности поля, в которой ока-
зываются и успевшие перейти в гель белки. Естественно, что
они мигрируют в ней относительно быстро. Так же быстро идет
переход белков из буфера препарата в формирующий гель.
Впрочем, белки мигрируют все же медленнее, чем ионы глици-
на, так как отношение заряда к массе у белков меньше. Описан-
ные явления постепенно распространяются на весь формирую-
щий гель. Ионы хлора, отступая, очищают весь объем этого ге-
ля. Вплотную за ними к границе с рабочим гелем подходит
глицин. Теперь весь формирующий гель находится в зоне повы-
шенной напряженности поля. В этом поле ускоренно движутся
белки, уже перешедшие из исходного раствора препарата в фор-
мирующий гель. Никакого их концентрирования пока не проис-
ходит; оно начнется лишь тогда, когда впереди идущие моле-
кулы белка достигнут границы рабочего геля. Тем временем
линия раздела ионов хлора и глицина уйдет уже в рабочий гель,
где замена одних ионов на другие не вызовет увеличения напря-
женности поля. Дело в том, что здесь молекулы глицина ока-
зываются при рН 8,9, который обеспечивается степенью иони-
зации и высокой концентрацией Триса. При этом рН большая
часть нейтральных молекул глицина снова превращается в ио-
ны. Эти нейтральные молекулы оказались в рабочем геле в силу
статистического характера миграции глицина, который был
описан выше. Электропроводность Трис-глицинового буфера в
верхней части рабочего геля оказывается столь же высокой, как
и Трис-НСl (этого добились подбором рН 8,9 и концентрации
всех компонентов системы). Напряженность электрического по-
ля в рабочем геле соответственно остается низкой, и это обстоя-
тельство играет решающую роль в концентрировании белков.
Впереди идущие молекулы белков достигают границы раз-
дела и переходят в рабочий гель, где попадают в область низ-
кой напряженности поля. Скорость их миграции резко падает.
Между тем следующие за ними молекулы белка еще движутся в
объеме формирующего геля, т. е. в области высокой напряжен-
ности поля, и движутся быстро. Потом и они входят в рабочий
гель и почти останавливаются. Это происходит со всеми моле-
кулами препарата. Находившиеся далеко сзади молекулы бел-
ка догоняют (почти догоняют) ушедшие вперед молекулы. Весь
исходный препарат, каков бы ни был его начальный объем, в
самом верху рабочего геля стягивается в тонкую полоску бел-
ков. Отсюда и начинается их медленная миграция в мелкопори-
стом геле при щелочном значении рН, т. е. фракционирование
белковой смеси. Между тем граница раздела ионов хлора и гли-
цина уходит все дальше вперед, и через какое-то время весь ра-
бочий гель оказывается в Трис-глициновом буфере примерно с
тем же рН. Замена буфера не сказывается на разрешающей
способности рабочего геля, а то обстоятельство, что фракцио-
нирование белков начинается с узкой исходной зоны, дает колос-
сальный выигрыш—разрешающая способность системы в целом
резко увеличивается. Для полноты картины отметим, что заря-
женные ионы Трис+, участвуя в поддержании рН буфера, будут,
замещая друг друга, медленно мигрировать вверх, в сторону ка-
тода. Ввиду малой подвижности этих ионов их вклад в электро-
проводность невелик.
Аналогичную картину ступенчатого электрофореза легко
Представить себе и для кислого буфера рабочего геля. В качест-
ве слабой («буферной») кислоты можно использовать уксусную,
а роль быстро мигрирующего иона «поручить» К+. В качестве
цвиттериона, поставляющего медленно мигрирующие ионы, бе-
рут b-аланин. Подбор количественного соответствия концентра-
ций и рН дает следующую пропись для построения системы. Для
получения буфера рабочего геля 4,3%-ный водный раствор ук-
сусной кислоты титруют КОН до рН 4,3. Буфер формирующего
геля готовят аналогичным титрованием 0,35%-ного раствора ук-
сусной кислоты до рН 5,8. Буфер верхнего электрода (анода)
получают из 0,035 М водного раствора р-аланина, титруя его до
рН 4,5 опять-таки уксусной кислотой. Напомним (и это следует
не упускать из виду, особенно для лабильных белков), что рН
буфера рабочего геля во время фракционирования в нем белков
оказывается несколько иным, чем первоначальный (примерно
на 0,5 выше в случае использования щелочного буфера и на-
столько же ниже — для кислого).
Мочевину, детергенты (ДДС-Na, Тритон Х-100 и Твин-80), а
также b-меркаптоэтанол или дитиотреитол можно вводить в со-
став буферов обоих гелей, например: с целью растворения труд-
норастворимых белков или для защиты их от окисления.
Как уже упоминалось, ступенчатый электрофорез можно ис-
пользовать и для разделения белков, находящихся в комплексе
с ДДС-Na. Такая система была разработана Лэммли еще де-
сять лет назад [Laemmli, 1970]. С тех пор она приобрела чрез-
вычайную популярность. Хотя выше и было высказано некото-
рое сомнение в том, что ее использование всегда оправдано, си-
стема заслуживает подробного описания.
В качестве рабочего геля в ней используют 10%-ный ПААГ,
формирующего—3%-ный; для обоих гелей С =2,6. Буфером
рабочего геля, как и у Ористейна и Дэвиса, служит 0,375 М
Трис-НСl (рМ 8,8) с добавлением ДДС-Na до 0,1%. Попутно
отметим, что 0,1%-ный ДДС-Na не препятствует развитию бак-
териальной флоры при комнатной температуре, поэтому его на-
до хранить на холоду. Электрофорез ведут в трубках диаметром
6 мм и длиной 15 см. Рабочий гель полимеризуют на длину
10 см, формирующий—на 1 см. Для формирующего геля Лэм-
мли использовал буфер вдвое большей концентрации, чем Орн-
стейн и Дэвис (0,125 М Трис-HCl, рН 6,8, с 0,1% ДДС-Na).
Для полимеризации в оба геля он вносил по 0,025% персульфа-
та аммония и ТЕМЕД. Верхний электродный буфер Лэммли
содержал Трис впятеро более высокой концентрации, чем цити-
ровалось выше (0,025 М), титрованный глицином до той же ве-
личины рН (8,3), чему соответствовала и впятеро более высокая
концентрация глицина (0,192 М). 0,1% ДДС-Na присутствовал
и в этом буфере.
Белковый препарат (0,2—0,3 мл) вносят в 0,0625 М Трис-
НС1 (рН 6,8), содержащем 10% глицерина и 0,001% бромфено-
лового синего. В препарат добавляют ДДС-Na до 2% и b-мер-
каптоэтанол до 5%, а затем прогревают его в течение 1,5 мин
на кипящей водяной бане. Цель такой обработки была указана
выше. Если исходный белковый препарат имеется в виде осадка,
то его следует сначала растворить в буфере, а потом уже до-
бавлять ДДС-Na из концентрированного раствора. В противном
случае на поверхности осадка комплекс белок—ДДС-Na может
образовать корку, препятствующую его полному растворению
[Maizel, 1971].
Электрофорез при силе тока 3 мА на трубку занимает 7 ч.
Фиксацию белков в 50%-ном растворе ТХУ ведут в течение ночи,
окрашивание свежеприготовленным 0,1%-ным раствором СВВ
R-250 в 50%-ной ТХУ—в течение часа при 37°. Избыток краси-
теля из геля вымывают диффузией в 7%-ной уксусной кислоте.
Система Лэммли так же успешно используется для электро-
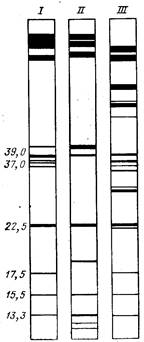
фореза в пластинах ПААГ. Для иллюстрации на рис. 22 пока-
зано расположение полос при сопоставлении субъединичного
состава трех РНК-полимераз амебы [D'Alessio et al., 1979]. Хо-
рошо видна высокая степень разрешения близких по молеку-
лярной массе полипептидов. Иногда ступенчатый электрофорез
по Лэммли используют в сочетании с градиентом пористости
рабочего геля, что еще более повышает разрешающую способ-
ность метода [Mahadik et al., 1976]. В случае угрозы агрегации,
например при фракционировании кислых белков хроматина, в
оба геля системы Лэммли можно ввести мочевину [Wilson, Spel-
sberg, 1975].
Имеются подтвержденные данные о том, что система, пред-
ложенная Лэммли, чувствительна к качеству ДДС-Na [Swaney
et al., 1974; Matheka et al., 1977]. Препараты, полученные от од-
них фирм («Pierce», «Matheson, Coleman and Bell»), дают хоро-
шие результаты, в то время как с другими препаратами ДДС-
Na (BDH, «Serva») разрешение полу-
чается плохое, а белки менее под-
вижны. Этот эффект зависит и от
того, какие белки разделяются. Для
других буферных систем он не наблю-
дается, но белки разделяются в них
зачастую вообще хуже, чем в системе
Леммли. Природа описанного эффек-
та непонятна. По-видимому, при высо-
кой концентрации Триса связывание
ДДС-Na с белками зависит от моле-
кулярного состава детергента. Анализ
методом газовой хроматографии пока-
зывает, что продажные препараты
ДДС-Na неоднородны. В них может
содержаться до 10% примесей, имею-
щих значительно больше чем 12 ато-
мов углерода на молекулу.
|
Отмечено также, что некоторые,
особенно высокомолекулярные, белки
после первоначального полного их
восстановления обработкой b-меркап-
тоэтанолом и ДДС-Na в ходе электро-
фореза снова частично окисляются с
образованием дисульфидных мости-
ков между полипептидными цепями,
что приводит к размыванию полос и не-
воспроизводимости результатов раз-
деления. Рекомендуется восстанов-
ленное состояние белкового препарата
закреплять путем его алкилирования
по SH-группам обработкой йодацета-
мидом. Для этого исходный препарат
| Рис. 22. Фракционирование РНК-полимераз I, II и III амебы в системе Лэммли [D'Alessio et al„ 1979] Цифры слева — молекулярные массы некоторых субъединиц (тыс. дальтон)
|
инкубируют с избытком этого реагента по отношению к количе-
ству внесенного для восстановления белка b-меркаптоэтанола
при 50° в течение 15 мин. От избытка йодацетамида и побочных
продуктов реакции можно не избавляться, а наносить всю инку-
бационную смесь прямо на гель [Lane, 1978].
Ступенчатый электрофорез в сочетании с обработкой ДДС-
Na успешно используется для пептидного анализа и сопоставле-
ния белков по пептидному составу. В 1977 г. группа авторов с
участием Лэммли предложила для этой цели систему двумерно-
го электрофореза, в которой ферментативный гидролиз белков
проводят без их элюции, непосредственно в геле, после чего ве-
дут электрофорез во втором направлении, позволяющий сопо-
ставлять пептиды [Cleveland et al., 1977]. В первом направлении
используют описанную выше систему Лэммли для разделения
смеси сопоставляемых белков. После кратковременной окраски
с целью обнаружения полос индивидуальных белков последние
вырезают и вымачийают в буфере формирующего геля. Затем
их помещают в карманы пластины геля второго направления,
добавляют туда по 10 мкл того же буфера, но содержащего 20%
глицерина, а потом наслаивают еще по 10 мкл буфера, но с 10%
глицерина, в котором растворена сооответствующая протеаза.
Во втором геле снова сформирована система ступенчатого элек-
трофореза по Лэммли. Включают напряжение, а когда бром-
феноловый синий приблизится к границе рабочего геля, напря-
жение на 30 мин отключают. За это время протеаза, которая
тоже перешла в формирующий гель, гидролизует белок непо-
средственно в нем. В присутствии ДДС-Na протеолиз проходит
не полностью, но в определенных условиях воспроизводимо.
В ходе дальнейшего электрофореза пептиды разделяются и мо-
гут быть сопоставлены в параллельных треках пластины.
Без существенных изменений этот подход был использован
и другими авторами [Przybyla et al., 1979; Gadasi et al., 1979].
В аналогичной работе (Bordier, Crettol-Jarvinen, 1979] в первом
направлении использовали систему Лэммли в сочетании с гра-
диентом пористости рабочего геля в пластине—концентрация
ПААГ изменялась от 5 до 17,5%. При внесении в карманы геля
второго направления полоски индивидуальных белков, вырезан-
ные из пластины первого направления, заливали расплавлен-
ным 1%-ным раствором агарозы, чтобы фиксировать их исход-
ное положение на дне кармана. В другой недавней работе
[Nikodem, Fresco, 1979] белки гидролизовали бромистым циа-
ном. Как и в предыдущей работе, в первом направлении белки
фракционировали ступенчатым электрофорезом с обработкой
ДДС-Na в градиенте пористости геля, вырезали слегка окрашен-
ные полоски белков и обрабатывали их BrCN прямо в геле.
Реакцию вели в маленьких пластмассовых флаконах под тягой.
Затем полоски геля вымачивали в буфере и переносили в кар-
маны пластины второго направления для разделения пептидов.
Другие авторы [Boulikas et al., 1980] аналогичным образом про-
водили промежуточный гидролиз белков в геле N-бромсукцин-
имидом. В первом направлении белки разделяли электрофоре-
зом в «кислой мочевине».
Особенно совершенной оказалась двумерная система фрак-
ционирования белков и пептидов, предложенная 0'Фаррелом
[O'Farrel, 1975]. В этой системе во втором направлении также
использована методика Лэммли в сочетании с градиентом пори-
стости ПААГ. Подробный разбор системы 0'Фаррела и ее мо-
дификаций здесь провести нельзя, поскольку в первом направ-
лении в ней используется не электрофорез, а электрофокусиро-
вание.
ГРАДИЕНТ ПОРИСТОСТИ ПААГ
В конце предыдущего раздела было рассмотрено несколько
примеров использования градиентов пористости ПААГ. Теперь
рассмотрим возможности этого метода подробнее.
Техника приготовлений гелей с изменяющимися вдоль на-
правления миграции белков размерами пор, или, как их назы-
вают, «градиентов пористости ПААГ», была подробно описана
в главе 2. Постепенное уменьшение среднего размера пор вдоль
градиента достигается путем увеличения концентрации акрил-
амида. Электрофорез в градиенте пористости ПААГ имеет це-
лый ряд существенных преимуществ.







