

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Двумерный электрофорез в пааг
Полное разделение сложной смеси белков далеко не всегда
удается осуществить в ходе одного опыта даже с применением
описанных выше приемов повышения разрешающей способно-
сти электрофореза в ПААГ. Всегда достаточно высока вероят-
ность того, что в данной системе электрофореза различные бел-
ки мигрируют в одной зоне либо в силу близости их размеров,
либо ввиду совпадения значений их электрофоретических под-
вижностей при выбранном значении рН, либо, наконец, в ре-
зультате неблагоприятной для разделения комбинации этих
параметров. Поэтому в сложных случаях каждую полосу после
первого электрофоретического фракционирования смеси бел-
ков следует проверить на гомогенность, используя ее как исход-
ный препарат для электрофореза в других условиях. Это можно
сделать одновременно для всех полос первого разделения, или,
как его часто называют, «разделения в первом направлении».
Для этого трубку или полоску, вырезанную по всей длине трека
из пластины первого направления, накладывают на стартовую
зону пластины «второго направления». Контакт между двумя
гелями обеспечивают, заливая место их соприкосновения стар-
товым буфером или, для надежности, расплавленным раствором
агарозы в этом же буфере. Электрофорез ведут в направлении,
перпендикулярном длине трубки или полоски. Каждая негомо-
генная белковая полоса может дать несколько пятен, если при
новых условиях электрофореза подвижности первоначально об-
разовавших ее нескольких белков окажутся неодинаковыми.
В результате на пластине второго направления после прокра-
шивания выявляется картина распределенных по всей поверх-
ности пятен, напоминающая «фингерпринт» в двумерной тонко-
слойной хроматографии. Число пятен, которое удается разли-
чить на одной пластине, в некоторых случаях приближается к
двум тысячам (!).
При сочетании гелей двух направлений вовсе не обязательно,
чтобы они были одинаковой толщины. Например, гель из труб-
ки диаметром 6 мм вполне можно совместить с пластиной толщи-
ной 1 мм. Для этого в месте перехода от трубки к пластине сле-
дует образовать продольно расположенную полость, предпочти-
тельно клиновидного сечения, куда можно заложить цилиндрик
геля и залить'его там буфером, агарозой или даже заполиме-
ризовать в переходный, крупнопористый ПААГ. Способ образо-
вания и форма сечения этой полости не играют большой роли.
Необходимо выполнить только одно условие: цилиндрик или по-
лоска геля первого направления должны лежать параллельно
краю геля в пластине второго направления. Можно, например,
воспользоваться простым вкладышем из плексигласа (рис. 23).
Этот вкладыш легко монтируется в обычный прибор для элек-
трофореза в вертикальной пластине [Hoffman, Dowben, 1978a].
Иногда из цилиндрика вдоль его продольной оси вырезают пло-
ский, тонкий слой и накладывают его на гель второго направ-
ления, как и полоску трека, вырезанную из пластины. Для вы-
резания плоского слоя из трубки (в замороженном состоянии)
удобно воспользоваться простым приспособлением, описанным
Уоттсом и др. [Watts et al., 1977].
В каждом из направлений двумерного электрофореза ис-
пользуют одну из рассмотренных выше систем, отвечающую спе-
цифическим особенностям фракционируемых белков. Широкое
применение двумерный электрофорез нашел, например, для
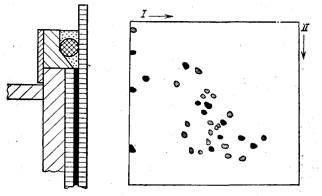
Рис. 23. Вкладыш из плексигласа для двумерного электрофореза [Hoffman,
Dowberi, 1978a]
Рис. 24. Результаты двумерного электрофореза рибосомальных белков [Mets,
Bogorad, 1974]
I—первое направление; II—второе направление
анализа белков рибосом из разных источников. Это, в основном,
слабощелочные белки, и в первом направлении их разделяют ча-
ще всего по заряду. Для этого используют крупнопористый гель,
чтобы различие молекулярных размеров по возможности не
сказывалось на разделении белков в этом направлении, т. е. не
накладывалось на разделение по заряду. Во втором направле-
нии в этом случае белки разделяют по их размерам.
Так, Мете и Богорад электрофорез рибосомальных белков в
первом направлении проводили в трубках диаметром 4 мм и
длиной 10 см [Mets, Bogorad, 1974]. 4%-ный ПААГ полимери-
зовали в буфере с рН 5. При этом все рибосомальные белки за-
ряжены положительно и различия значений их суммарных за-
рядов выражены наиболее ярко. В буфер вводили 8 М мочевину,
чтобы помешать агрегации белков. При полимеризации геля
вносили больше ТЕМЕД, чем персульфата аммония (0,1 и
0,03%), так как в кислой среде каталитическая активность
ТЕМЕД понижена (см. главу 2). 0,1—0,2 мг смеси рибосомаль-
ных белков вносили растворенными в 8 М мочевине с 10 мМ ди-
тиотреитолом. Разделение вели при силе тока 1,5 мА на трубку
в течение 4—5 ч. Во втором направлении использовали ступен-
чатый электрофорез. Рабочим гелем служил 10%-ный ПААГ,
полимеризованный в буфере с рН 6,75. Формирующий гель—
такой же, как гель первого направления (4% ПААГ, рН 5). Его
полимеризовали вокруг геля из трубки, уложенного в клиновид-
ное расширение над пластиной. Концентрацию мочевины в этом
геле снизили до 7 М, чтобы цилиндрик не мог всплыть во время
полимеризации. В качестве медленно мигрирующего иона верх-
него электродного буфера использовали MES (2-(N-морфолино-
этенсульфокислоту) — продажный препарат для составления
буферов с р К а 6,15. Быстрым ионом служил остаток уксусной
кислоты. В состав верхнего буфера ввели также 1% ДДС-Na и
0,01% тиогликолевой кислоты, которая, как уже упоминалось,
служит для очистки гелей от остаточных свободных радикалов
персульфата аммония. Она мигрирует из электродного буфера
в гель, где и движется впереди белков. Отметим, что преэлек-
трофорез в ступенчатой системе невозможен—он нарушил бы
распределение ионов по ступеням. Однако его можно провести
предварительно, использовав в качестве верхнего обычный бу-
фер с быстро мигрирующим ионом, а затем заменить его, как
описано выше. Верхний электрод является катодом, анод рас-
положен внизу. Под действием поля ДДС-Na из верхнего элек-
тродного буфера мигрирует в гель. В цилиндрике геля первого
направления он образует комплексы с белками. Далее отрица-
тельно заряженные комплексы белок — ДДС-Na выходят из ци-
лкндрика и фракционируются ступенчатым электрофорезом в
пластине. Обработка белков ДДС-Na, таким образом, 'происхо-
дит в отсутствие b-меркаптоэтанола. Его отчасти заменяет мо-
чевина; кроме того, исходно, до электрофореза в первом направ-
лении, белки восстанавливают 10 мМ дитиотреитолом. Электро-
форез во втором направлении ведут в течение 5 ч при силе тока
25 мА на пластину. Метод удобен тем, что между разделениями
в первом и втором направлениях нет надобности вымачивать
гель, так как буфер геля первого направления—тот же, что и у
формирующего геля второго направления. Результаты электро-
фореза представлены на рис. 24.
В другой работе [Howard, Traut, 1973] разделение рибосо-
мальных белков по заряду в первом направлении вели тоже в
4%-ном ПААГ в присутствии 6 М мочевины, но в 0,4 М Трис-
боратном буфере, рН 8,7. При этом рН часть белков рибосом
оказывается заряженной отрицательно, а другая часть—поло-
жительно. Белковый препарат смешивали с расплавленной
1%-ной агарозой и вносили в середину трубки, наслаивая его
на заполимеризованный нижний участок ПААГ. После затвер-
девания агарозы в трубку заливали новую порцию смеси моно-
меров и полимеризовали верхний участок ПААГ. При этом в
интересах концентрирования полос на обеих границах с ПААГ
агарозу с белковым препаратом полимеризовали в разбавлен-
ном (0,06 М) Трис-боратном буфере. При включении напряже-
ния миграция белков шла в обе стороны—к катоду и аноду.
Во втором направлении разделение белков вели по их размерам,
но без обработки ДДС-Na. Для этого использовали пластину
еще. более мелкопористого геля, чем в предыдущей работе (T=
=18,25; С =1,37), полимеризованного в 0,9 М уксусной кисло-
те, титрованной КОН до рН 4,5, также с добавлением 6 М моче-
вины. В этом случае все белки были заряжены положительно и
мигрировали к катоду. В качестве лидирующего красителя ис-
пользовали 0,1%-ный раствор пиронина. Из цилиндрика геля
вдоль его продольной оси вырезали плоскую полоску, вымачи-
вали ее в 0,013 М К-ацетатном буфере (рН 5,2) с 8 М мочеви-
ной. Полоску зажимали между стеклянными пластинками фор-
мы и прямо на нее заливали раствор мономеров рабочего геля.
Катионом верхнего электродного буфера служил глицин
(~0,19 М), титрованный уксусной кислотой до рН 4. Таким об-
разом, осуществлялась система ступенчатого электрофореза,
где в качестве быстрого иона выступал К+, а медленного—гли-
цин. Отметим, что в системе Орнстейна и Дэвиса глицин фигу-
рировал в качестве медленного аниона, а здесь он служил ка-
тионом. Возможность такого двоякого использования вытекает
из цвиттерионной природы глицина. Формирующим гелем в этой
системе служила сама полоска, вырезанная из геля первого на-
правления. Аналогичная система двумерного электрофореза ри-
босомальных белков описана и в другой работе [Sherton, Wool,
1974]..
Гамильтон [Hamilton, 1974] при разделении рибосомальных
белков по заряду в первом направлении использовал ступенча-
тый электрофорез в кислом буфере (7,5%-ный ПААГ с рН 4,6—
в рабочем геле, 2,5%-ный ПААГ с рН 6,5—в формирующем).
Во втором направлении он вел разделение белков в комплексе
с ДДС-Na в 15%-ном ПААГ. Обработку детергентом он осуще-
ствлял, вымачивая извлеченный из трубки гель первого направ-
ления в 1%-ном растворе детергента. В работе были определены
молекулярные массы рибосомальных белков (путем сравнения
с маркерами во втором направлении) и оценены их количествен-
ные соотношения в составе малой субъединицы рибосом печени
крысы.
Интересный подход к фракционированию рибосомальных
белков был использован в недавней работе [Hoffman, Dowben,
1978b]. При разделении в первом направлении авторы исполь-
зовали различие в протяженности гидрофобных участков по-
верхности у разных белков рибосомы. Оно проявлялось в степе-
ни связывания этих белков с мицеллами Тритона Х-100, который
вводили при полимеризации геля до концентрации 0,15%. Ком-
плексы белков с Тритоном Х-100 разделяли по размеру в 8%-ном
ПААГ в присутствии 2 М мочевины. Концентрация детергента
была оптимальной; при меньших концентрациях он мало влияет
на подвижность белков, а при больших, как уже отмечалось,
препятствует последующей обработке ДДС-Na, который в этой
работе использовали при фракционировании белков во втором
направлении. Подробнее об использовании Тритона Х-100 в этих
целях будет сказано в следующем разделе.
В качестве лидирующего красителя при фракционировании
рибосомальных белков в кислом буфере недавно было предло-
жено использовать FeCl3. Ионы Fe3+ в присутствии уксусной
кислоты образуют стойкие комплексы коричневого цвета, миг-
рирующие к катоду впереди самого мелкого из рибосомальных
белков [Bernabeu et al., 1979].
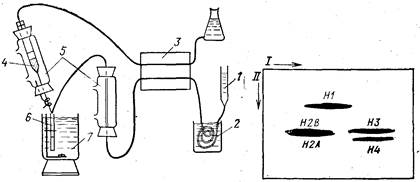
Рис. 25. Сочетание хроматографии с электрофорезом в геле агарозы fBloom,
Anderson, 1979]
1 — хроматографическая колонка; 2 —обессоливавие в «биофибрах», 3 — перистальтиче-
ский насос; 4— раствор агарозы; 5 — нагреватели; 6— трубка для электрофореза; 7 —
охлаждающая смесь
Рис. 26. Разделение гистонов сочетанием хроматографии на оксиапатите (на-
правление I) и электрофореза в градиенте концентрации ПААГ (направление
II) в присутствии ДДС-Na [Bloom, Anderson, 1979]
Двумерным электрофорезом часто разделяют и другие ще-
лочные белки. Например, факторы инициации белкового синте-
за из ретикулоцитов образуют много пятен при фракционирова-
нии каждого из них в первом направлении по заряду в кислой
мочевине, а во втором—по размерам ступенчатым электрофо-
резом в системе Лэммли [Floyd et al., 1979].
Двумерный электрофорез белков хроматина описан Бакае-
вым и соавторами (Bakayev et al., 1978]. В первом направлении
хроматин после обработки его микрококковой нуклеазой фрак-
ционировали в 5%-ном ПААГ и буфере низкой ионной силы
(0,01 М ТЭА-НС1, рН 7,6) на олиго-, моно- и субнуклеосомы за
счет заряда входящей в их состав ДНК, как это было описано
выше. Во втором направлении авторы использовали в одном
случае фракционирование белков хроматина по размеру в си-
стеме Лэммли после вымачивания геля первого направления в
1%-ном растворе ДДС-Na. Детергент обеспечивал и диссоциа-
цию белков от ДНК. В другом варианте разделения диссоциа-
цию осуществляли с помощью цетавлона, а электрофорез во
втором направлении вели в кислой мочевине. Во втором вариан-
те хорошо выявлялась группа быстро мигрирующих негистоно-
•вых белков хроматина (HMG-белков). Для анализа этих белков
авторы экстрагировали их 0,35 М раствором Nad, очищали
осаждением ТХУ (2—20%) и разделяли двумерным электрофо-
резом, причем в первом направлении использовали фракциони-
рование по заряду в кислой мочевине, а во втором — разделение
по размерам в 15%-ном ПААГ после обработки ДДС-Na.
Двумерный электрофорез субъединиц различных РНК-поли-
мераз в уже цитированной работе д'Алессио и соавторов про-
водили в двух вариантах разделения белков по заряду в первом
направлении. В обоих вариантах использовали ступенчатую си-
стему электрофореза: в одном—с кислым буфером (рН 4,3) для
рабочего геля, в другом—со щелочным (рН 9,4). Во втором на-
правлении в обоих случаях белки фракционировали по их раз-
мерам после обработки ДДС-Na в системе Лэммли [d'Alessio et
al., 1979].
Мы не случайно в качестве примеров двумерного электрофо-
реза рассмотрели только случаи фракционирования щелочных
белков. Для кислых белков все другие варианты двумерного
фракционирования вытеснила уже упоминавшаяся система
О'Фарелла. Щелочные белки до последнего времени плохо раз-
делялись в этой системе, однако недавно была предложена ее
модификация, позволяющая успешно вести разделение и щелоч-
ных белков.
Блум и Андерсон предложили оригинальный метод двумер-
ного разделения белков [Bloom, Anderson, 1979]. Собственно,
электрофорез в нем используется только во втором направле-
нии. Фракционирование белков в первом «направлении» осуще-
ствляется на хроматографической колонке (рис. 25). Элюат с
колонки обессоливают, пропуская его через «биофибры», погру-
женные в 10%-ный раствор ДДС-Na с 1% b-меркаптоэтанола.
Затем его подогревают до 96° и по каплям смешивают с раство-
ром расплавленной при такой же температуре агарозы. Оба
раствора подают одним двухканальным перистальтическим на-
сосом, и горячая смесь постепенно заполняет погруженную в лед
трубку. Таким образом, в трубке полимеризуется элюат с хро-
матографической колонки, т. е. по длине геля располагаются
белковые зоны в той последовательности, как они выходят из
колонки. Затем гель извлекают из трубки и накладывают на
пластину ПААГ, заливают расплавленной агарозой и ведут
электрофорез в системе Лэммли. В частности, авторы элюирова-
ли гистоны с колонки оксиапатита линейным градиентом кон-
центрации NaCl (0—1,5 М) в 1 мМ Na-фосфатном буфере
(рН 6) с 6 М мочевиной. Гистоны выходили, не разделившись,
а лишь растянувшись по элюату. Во втором направлении ис-
пользовали электрофорез в присутствии ДДС-Na в градиенте
пористости ПААГ (8—25%). На пластине гистоны оказались
прекрасно отделенными друг от друга (рис. 26). В частности,
гистоны Н2А и Н2В далеко отошли от НЗ благодаря значитель-
ному различию в их сродстве к оксиапатиту.
Исходный препарат в такой постановке опыта может быть
и не элюатом с колонки, а реакционной смесью, в которой со
временем происходят изменения белкового состава, например
в результате протеолиза. Маркерные белки с известной молеку-
лярной массой можно прикалывать при заполнении трубки так,
что их положение по ее длине будет заведомо определенным.
ЭЛЕКТРОФОРЕЗ С ИСПОЛЬЗОВАНИЕМ
ТРИТОНА Х-100 И ЦЕТАВЛОНА
Тритон Х-100
Многие белки, например: рибосомальные и мембранные, пло-
хо растворимы в водных буферах. Добавление Тритона Х-100 за-
частую улучшает их растворимость и,.к тому же, в отличие от
мочевины, не влечет за собой их денатурации. Сохраняются
вторичная и третичная структура белков, а в ряде случаев и их
биологическая активность.
Авторы одной из работ [Hearing et al., 1976] растворяли бел-
ки до концентрации 1 мг/мл в течение нескольких часов в
1%-ном растворе Тритона Х-100. Затем этот раствор смешивали
с равным объемом 20%-ной сахарозы в верхнем электродном
буфере удвоенной концентрации и в таком виде наносили на
формирующий гель в трубке. Тритон Х-100, связавшись с бел-
ком, может мигрировать вместе с ним, сохраняя растворимость
белка, однако разделение полос оказывается более надежным,
если 0,1% Тритона Х-100 вводят в гель. Правда, при фиксиро-
вании белков ТХУ Тритон Х-100 дает опалесцирующий фон, ко-
торый приходится дольше отмывать.
Образование комплексов с Тритоном Х-100 можно использо-
вать не только для растворения, но и для фракционирования
белков. Характер комплекса и количество связавшегося с бел-
ком детергента зависят от протяженности гидрофобного участ-
ка на поверхности белковой глобулы. Некоторые белки могут
связывать по нескольку десятков молекул Тритона Х-100 на мо-
лекулу (родопсин—до 70). Это дает прирост эффективной мо-
лекулярной массы в тысячи, а иногда и в десятки тысяч дальтон
(молекулярная масса Тритона Х-100 равна 632). Такой прирост
легко обнаружить электрофорезом в мелкопористом геле.
В работе Фернандеса и соавторов [Fernandes et al., 1978] бел-
ки из бактериальной мембраны экстрагировали до концентра-
ции 4 мг/мл 5%-ной уксусной кислотой с 4 М мочевиной и 5%
(b-мсркаптоэтанолом. Иногда уже при экстракции добавляли
Тритон Х-100 до концентрации 2%, что улучшало выход белков
из мембраны, но приводило к появлению дополнительных полос
в верхней части геля при электрофорезе. Весьма существенно
вносить Тритон Х-100 и мочевину в сам гель, причем в опреде-
ленной пропорции. Мочевина препятствует связыванию Тритона
Х-100 с белком, тем самым повышая избирательность этого про-
цесса. Оптимальное соотношение концентраций детергента и
мочевины для данного типа белков подбирают эксперименталь-
но. В цитируемой работе использовали пластину 12%-ного
ПААГ (С = 0,8), полимеризованного в 5%-ном растворе уксус-
ной кислоты с 8 М мочевиной и 12 мМ (0,75%) Тритоном Х-100.
Следует иметь в виду, что детергент ухудшает сцепление ПААГ
со стеклом. Этим, по-видимому, и было обусловлено понижен-
ное против обычного содержание метиленбисакриламида. Иног-
да, во избежание выскальзывания мелкопористого геля, содер-
жащего Тритон Х-100, из трубки или пластины под ним прихо-
дится предварительно заполимеризовать «пробку» обычного
ПААГ. Тритон Х-100 усиливает опасность окисления белков за
счет остаточных свободных радикалов, поэтому особое внима-
ние следует уделить преэлектрофорезу. Авторы работы вели его
сначала в течение 3—4 ч при напряжении 240 В до постоянства
силы тока, подключив анод к нижнему электроду. Затем в элек-
тродные резервуары заливали свежую 5%-ную уксусную кисло-
ту, а в карманы пластины вносили 0,2 М цистамина и до 2 мг/мл
протамина, растворенных в 5%-ной уксусной кислоте с 8 М мо-
чевиной. Возобновляли преэлектрофорез еще на 45 мин, поме-
няв полярность напряжения, подаваемого на гель. Только после
этого вносили белковые препараты и вели электрофорез при по-
стоянном напряжении 100 В в течение суток при той же поляр-
ности напряжения (белки мигрируют к катоду).
В рассматриваемой работе удалось наблюдать значитель-
ные различия белкового состава мембран разных штаммов Е. со-
li и даже мутантов одного штамма. Было использовано и дву-
мерное разделение. Полоски геля после электрофореза в при-
сутствии Тритона Х-100 и мочевины вымачивали по 5 мин сна-
чала в 1,5 М Трис-НСl (рН 8,8) с 1% ДДС-Na, потом в 0,5 М
Трис-НСl (рН 6,8) с 1% ДДС-Na и, наконец, в воде. После это-
го их переносили на вторую пластину для ступенчатого электро-
фореза в комплексе с ДДС-Na. Такой двумерный электрофорез
позволяет разделять белки, не поддающиеся разделению одним
только электрофорезом в присутствии Тритона Х-100 и мочеви-
ны или ступенчатым электрофорезом по Лэммли.
Электрофорезом в 12,5%-ном ПААГ, полимеризованном в
5%-ной уксусной кислоте с 0,5% Тритона Х-100 и 6 М мочеви-
ной, удается также хорошо разделять разные формы а- и {b-це-
пей глобина [Rovera et al., 1978]. Предварительную денатура-
цию белков в этом случае проводили в присутствии 5% (b-мер-
каптоэтанола, так как окисление может существенно изменять
гидрофобные свойства белка.
Аналогичное фракционирование гистонов проводили в геле,
полимеризованном в 0,9 М уксусной кислоте с 0,38% Тритона
Х-100 и 8 М мочевиной [Newrock et al., 1978]. Здесь также пре-
электрофорез вели сначала с цистамином, затем с протамином.
В более поздней работе [Levy et al., 1979] для разделения гисто-
нов использовали другую пропорцию тех же компонентов буфе-
ра геля: 7%-ная уксусная кислота+0,22% Тритона Х-100 + 4 М
мочевины.
Электрофорез в кислой мочевине с добавкой Тритона Х-100
использовали и для очистки гистонов от примеси рибосомаль-
ных белков. Тритон Х-100 плохо связывается с последними, по-
этому при электрофорезе в первом направлении благодаря ком-
плексу с Тритоном Х-100 гистоны удается отделить от рибосо-
мальных белков с близкими молекулярными массами. Гистоны
мигрируют вместе с относительно более крупными белками ри-
босом. Во втором направлении электрофорез в пластине 1'5%-
ного ПААГ в присутствии 0,1% ДДС-Na позволяет выявить раз-
личие истинных молекулярных масс этих двух типов белков.
ДДС-Na вытесняет Тритон Х-100 из комплекса с белком, и от-
носительно более низкомолекулярные гистоны уходят вперед,.
отделяясь от рибосомальных белков [Savic, Poccia, 1978].
Вообще, двумерный электрофорез гистонов, включающий
комплексообразование с Тритоном Х-100 в одном из направле-
ний, использовался довольно -часто [Hamana, Iwai, 1976; Gar-
nird, 1976; Franklin, Zweidler, 1977; Blankstein et al., 1977].
В последние годы описано применение в тех же целях других,
сходных с Тритоном Х-100 неионных детергентов. Так, после
обычного электрофореза в кислой мочевине для второго направ-
ления был использован 15%-ный ПААГ, полимеризованный в
0,8 М уксусной кислоте, содержащей 0,4% Lubrol WX (фирмы
«Sigma») и 6 М мочевину [Bhatnagar, Bellve, 1978]. Гистон Н2А
печени и других органов мыши при этом удалось разделить на
два компонента, гистон НЗ—на три или четыре; в ряде случа-
ев расщеплялся и гистон HI. В другой работе [Allis et al., 1979]
был использован Тритон DF-16. В 12%-ном ПААГ, полимеризо-
ванном в 5%-ной уксусной кислоте с 0,4% Тритона DF-16 и 6 М
мочевиной, гистоны мигрируют в следующем порядке: Н4, Н1+
+Н2В, НЗ и Н2А. Электрофорез по размерам во втором направ-
лении (система Лэммли) разделяет их очень хорошо.
Цетавлон
Цетилтриметиламмонийбромид (цетавлон) — положительно
заряженный ионный детергент. Как известно, ДДС-Na раство-
ряет не все щелочные белки, зато хорошо растворяет нуклеино-
вые кислоты, которые могут создавать помехи при электрофоре-
зе белков, входящих в состав нуклеопротеидов. Паним и соавто-
ры предложили заменить ДДС-Na на цетавлон [Panyim et al.,
1977]. Как и ДДС-Na, цетавлон способствует растворению бел-
ков за счет связывания с гидрофобными участками полипепти-
дов. Благодаря электростатическому отталкиванию положитель-
но заряженных аммониевых групп цетавлона белковые цепи рас-
прямляются и приобретают жесткость. Комплекс белка с цетав-
лоном, особенно в кислой среде, заряжен заведомо положитель-
но. Вместе с тем цетавлон взаимодействует с нуклеиновыми
кислотами как «жирный катион» и осаждает их из, раствора.
Использование цетавлона имеет и свои трудности. При взаи-
модействии с персульфатом аммония он довольно легко выпадает
в осадок, поэтому полимеризацию геля приходится вести при
слегка повышенной температуре (37°), в термостате. Кроме то-
го, цетавлон осаждает красители типа СВВ R-250, поэтому окра-
шивание геля ведут при температуре 80—100°.
Паним и соавторы для разделения смеси стандартных белков использова-
ли 10%-ный ПААГ (С =1,5), полимеризованный в 0,09 М Na-ацетатном буфе-
ре (рН 4,6) с 0,09% цетавлона. Примерно таким же буфером заполняли элек-
тродные резервуары. Исходный препарат готовили, растворяя белки до кон-
центрации 0,25—0,5 мг/мл в 0,0.1 М Na-ацетатном буфере (рН 4,6) с 0,5%
цетавлона и 1% р-меркаптоэтанола. Назначение последнего — такое же, как
при обработке белков ДДС-Na. Белковый раствор кипятили 5 мин или инку-
бировали 2 ч при 37°, а затем добавляли мочевину до концентрации 6 М. На
трубку (10x0,6 см) вносили 20 мкл раствора препарата (5—10 мкг белка).
Электрофорез вели при силе тока 8—10 мА на гель и напряженности поля
8—10 В/см. В качестве лидирующего красителя использовали 0,05%-ный рас-
твор Azure А. Белки окрашивали 0,25%-ным раствором СВВ R-250 в 10%-ной
уксусной кислоте, содержащей 45% метанола, в течение 30—60 мин при тем-
пературе 80—100°. Отмывали излишек красителя в 0,9 М уксусной кислоте
при той же температуре.
Как и при электрофорезе с ДДС-Na, в случае обработки це-
тавлоном также наблюдается линейная зависимость между ло-
гарифмом молекулярной массы белка и расстоянием его мигра-
ции в геле. Пользуясь этой зависимостью, удается оценивать
молекулярные массы белков в интервале 15—90 тыс. дальтон.
Эли и соавторы недавно предложили модификацию описан-
ной выше системы [Ely et al., 1979J. Они заменили персульфат
аммония на флавинмононуклеотид (ФМН) в качестве инициа-
тора полимеризации, которая идет при освещении (ФМН рас-
творим лучше, чем рибофлавин). Это снимает проблему осаж-
дения цетавлона при полимеризации геля.
В качестве рабочего буфера геля использовали U,l М Na-фосфат (рН'7)
с 0,l% цетавлона. Белковый препарат перед электрофорезом денатурировали
в течение 1 мин на кипящей водяной бане в том же буфере, но содержащем
0,5% цетавлона и 10—15% р-меркаптоэтанола. Лидирующий краситель-
малахитовый зеленый. Электрофорез в 10%-ном ПААГ при силе тока 8 мА на
трубку (10x0,6 см) занимал около 5 ч. Белки фиксировали в кипящей 10%-
ной ТХУ, затем окрашивали при комнатной температуре 0,5%-ным раствором
СВВ R-250 в 10%-ной уксусной кислоте, содержащей 4'5% этанола, в течение
10ч.
Обработку цетавлоном удобно использовать для диссоциа-
ции белков от ДНК в хроматине с одновременным осаждением
ДНК и последующим электрофорезом комплексов белков с це-
тавлоном. При низких значениях рН связывание цетавлона с ги-
стонами и негистоновыми белками хроматина носит избиратель-
ный характер, что способствует их электрофоретическому раз-
делению.
Фракционирование белков по степени их гидрофобности мож-
но преобразовать в разделение по заряду с помощью следующе-
го приема [Helenius, Simons, 1977]. Для исключения роли раз-
меров белков электрофорез ведут в 1%-ной агарозе, растворен-
ной в 0,05 М глициновом буфере с 0,1 М NaCI и 0,5% Тритона
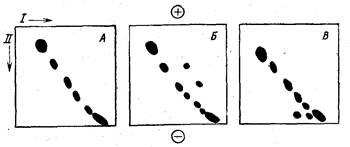
Рис. 27. Обнаружение гидрофобных белков двумерным электрофорезом «со
сдвигом заряда» [Bhakdi et al., 1977]
А — без дополнительных детергентов; Б — с добавлением ДОХ; В —с добавлением це-
тавлона
Х-100 с добавлением в него либо цетавлона до 0,5%, либо дез-
оксихолата натрия (ДОХ) до 0,25%. Тритон Х-100 образует
мицеллы, которые связываются с гидрофобными участками бел-
ка в количестве, пропорциональному размеру этих участков.
Цетавлон или ДОХ объединяются с Тритоном Х-100 в смешан-
ные мицеллы, привнося тем самым в комплекс с белком соответ-
ственно положительный или отрицательный заряд, существенно
превышающий собственный заряд белка. При электрофорезе
белки мигрируют со скоростью, обусловленной знаком и вели-
чиной привнесенного заряда. Такой прием можно назвать «элек-
трофорезом со сдвигом заряда». Необычное введение в буфер
геля 0,1 М NaCl по-видимому, способствует как растворимости
белков, так и образованию, мицелл. Напряженность поля при
этом приходится снижать до 4,5 В/см.
Аналогичный подход был использован для обнаружения гид-
рофобных белков в двумерном варианте электрофореза [Bhakdi
et al., 1977]. Разделение белков в первом направлении (I) вели
в 1%-ной агарозе с 0,5% Тритона Х-100. Вырезали полоску, пе-
реносили ее в форму, куда заливали такой же раствор агарозы,
но с добавлением цетавлона или ДОХ. После электрофореза во
втором направлении (II) все гидрофильные белки ложились на
диагонально расположенную прямую, а гидрофобные выпадали
из нее (рис. 27).
Комбинация электрофореза в кислой мочевине с Тритоном
Х-100 в первом направлении и такой же системы, но с цетавло-
ном вместо Тритона, во втором позволила Боннеру и соавторам
выявить значительное число дополнительных фракций при раз-
делении гистонов двумерным электрофорезом. В обоих направ-
лениях использовалась система ступенчатого электрофореза
(3,3%-ный ПААГ—формирующий, 15 %-ный— рабочий). По-
лимеризацию вели с рибофлавином. После электрофореза в пер-
вом направлении белки фиксировали и окрашивали СВВ. При
этом отпадала необходимость вести электрофорез во втором на-
правлении немедленно по окончании первого разделения И обе-
спечивалась возможность оценить качество последнего. Цетав-
лон, который вносили в верхний электродный буфер (0,15%),
мигрируя под действием поля через полоску препарата, снова
растворял белки и освобождал их от красителя. Во избежание
образования дисульфидных мостиков в раствор красителя для
геля первого направления добавляли до 0,1% цистамина. Для
предупреждения фотоокисления гистонов гели держали вдали
от яркого света [Bonner et al., 1980].
В заключение отметим, что при электрофорезе мембранных
липопротеидов главная проблема связана с их растворением.
Даже в 1%-ном ДДС-Na при 100° не удается добиться надеж-
ного растворения. Между тем липопротеиды хорошо растворя-
ются в смеси 6 г глицина и 10 мл 98%-ной муравьиной кислоты.
Электрофорез можно вести в 13 М НСООН (50%). Для этого
полимеризуют гель в воде, потом его вынимают, вымачивают в
13 М НСООН и с каплей глицерина вставляют в трубку, диа-
метр которой на 0,1—0,2 мм больше, чем у той, которая исполь-
зовалась при полимеризации. В ней и ведут электрофорез [Mok-
rasch, 1978]. В другом варианте электрофореза водонераствори-
мых белков в качестве рабочего буфера геля использовали смесь
фенола, этиленгликоля и воды в соотношении 3:2:3 (масса/объ-
ем/объем). Мономерный акриламид реагирует с фенолом, по-
этому полимеризацию ПААГ в пластинах проводили опять-таки
в водной среде, которую затем путем вымачивания геля заменя-
ли описанной выше смесью [Pusztai, Watt, 1973].
ОКРАШИВАНИЕ БЕЛКОВ В ПААГ
Обнаружение и локализацию белковых зон после их разде-
ления электрофорезом в ПААГ в большинстве случаев осуще-
ствляют путем их прокраски в геле. Зоны проявляются как ок-
рашенные полоски или пятна различной интенсивности, в
зависимости от содержания в них белка. Для окраски гель вы-
мачивают в растворе красителя, который диффундирует внутрь
него и прочно связывается с белками. Процесс диффузии, как
правило, занимает несколько часов. Во избежание размывания
полос за это время белки иногда предварительно фиксируют
осаждением. Для этого гель сначала вымачивают в 10%- или
50%-ной трихлоруксусной кислоте (ТХУ). Чаще фиксацию сов-
мещают с окрашиванием, используя раствор красителя в.смеси
уксусной кислоты и метанола или в ТХУ.
Одновременно с белками окрашенным оказывается и сам
гель. Это происходит как за счет простого замещения буфера ге-
ля на раствор красителя, так и в результате некоторой сорбции
его на геле. Однако связывание красителя с гелем значительно
менее прочно, чем с белками, поэтому от «фона» удается без
особого труда избавиться «отмывкой» геля, например вымачи-
ванием его в относительно большом объеме растворителяс не-
сколькими сменами. Если отмывка идет только за счет диффу-
зии красителя из геля, она занимает несколько часов, обычно ее
ведут в течение ночи. Во избежание растворения осажденных
белков краситель отмывают тоже уксусной кислотой, часто.в
смеси с метанолом, который улучшает растворимость красите-
ля. Отмывка ускоряется при повышенной температуре (37—
50°) и перемешивании растворителя, однако при этом есть опас-
ность ослабления окраски полос.
Все типы обычно используемых красителей для белков несут
на себе электрический заряд того или иного знака, поэтому от-
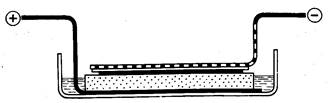
Рис. 28. Устройство для электрофоретической отмывки гелей [Shortess, 1974]
мывкугеля можно еще ускорить, если в растворителе суспенди-
ровать немного ионообменной смолы, связывающей краситель
и тем самым сдвигающей равновесие диффузии. Часто исполь-
зуют для этой цели смолу смешанного типа AG 501х8.
Наконец, процесс отмывки можно сократить до десятков ми-
нут, если воспользоваться электрофорезом. Электрическое поле
накладывают на гель в поперечном направлении — перпенди-
кулярно оси трубки или поверхности пластины. Не связанные с
белками молекулы красителя благодаря своему заряду быстро
выходят из геля. Разумеется, для этой цели нужно иметь специ-
альный, хотя и очень простой, прибор для поперечного электро-
фореза. Такие приборы («дестейнеры») имеются в продаже, но
их легко изготовить и в лаборатории.
Простое устройство для этой цели описано и схематически
изображено на рис. 28 [Shortess, 1974]. На пластинку из нержа-
веющей стали с отогнутым концом кладут кусок поролона, смо-
ченного 10%-ным раствором уксусной кислоты. Его помещают в
ванночку и заливают таким же раствором до уровня чуть ниже
верхней поверхности поролона. Ряд трубок или пластину геля
кладут на поролон, накрывают фильтровальной бумагой, смочен-
ной уксусной кислотой, и прижимают перфорированной алюми-
ниевой пластинкой или сеткой, также с отогнутым концом.
К отогнутым концам обеих пластинок присоединяют провода от
источника тока; стальная пластинка служит анодом. Перфора-
ции в катодной пластинке нужны для выхода пузырей газа. Че-
рез пластину геля размером 12х7х0,3 см нужно пропускать
ток силой 0,6 А. Отмывка занимает 15—20 мин. Находящиеся в
осадке белки и прочно связанный с ними краситель при непро-
должительном поперечном электрофорезе остаются на своих ме-
стах в геле.
До сих пор речь шла о неспецифической окраске белков. Если
в ходе электрофореза ферменты не утрачивают своей биологи-
ческой активности, то их локализацию в геле можно осуществить
с помощью специфической ферментативной реакции или цепи
реакций, дающих окрашенные продукты. В этом случае гель вы-
мачивают в растворе соответствующих субстратов. Разумеется,
фиксировать белки осаждением в этом случае нельзя и прихо-
дится мириться с некоторым размыванием белковых полос.
Впрочем, низкомолекулярные субстраты зачастую диффунди-
руют в гель быстрее, чем довольно крупные молекулы красите-
лей, и продолжительность вымачивания бывает можно сократить.
Иногда возникает необходимость вести наблюдение за миг-
рацией белковых зон в ходе электрофореза. Для этого исходную
смесь белков можно окрасить красителем «Remazol» [Griffith,
1972], который ковалентно связывается с белком и мигрирует
вместе с ним. Реакцию между белком и красителем проводят в
присутствии ДДС-Na, в щелочной среде. Например, к 2 мг бел-
ка, растворенного в 0,2 мл 0,15 М NaCI с 0,2 М NazHPt^ и 10%
ДДС-Na, добавляют краситель до концентрации 0,16% и прогре-
вают при 56° в течение 20 мин. Для очистки от свободного кра-
сителя белок переосаждают ацетоном.
Чувствительность окрашивания белков мно
|










