Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Модуль 3. Получение галогенводородных кислотСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
ПО НЕОРГАНИЧЕСКОМУ СИНТЕЗУ» (часть 2)
УЧЕБНОЕ ПОСОБИЕ на модульной основе для студентов химического факультета ЮФУ
Ростов-на-Дону
Учебное пособие разработано: кандидатом технических наук, старшим преподавателем кафедры общей и неорганической химии ЮФУ Лисневской И.В., кандидатом технических наук, старшим преподавателем кафедры общей и неорганической химии ЮФУ Рыбальченко И.В.
Рецензент: доктор технических наук, профессор Нестеров А.А.
Ответственный редактор доктор химических наук, профессор Лупейко Т.Г.
Печатается в соответствии с решением кафедры общей и неорганической химии химического факультета ЮФУ, протокол № 3 от 31 марта 2010г.
Учебное пособие предназначено для студентов химического факультета университета, изучающих дисциплину «Неорганический синтез»; выполнено на модульной основе с диагностико-квалиметрическим обеспечением. Выполнено в соответствии с программой и состоит из двух частей. В первой части – модули: «Восстановление водородом» и «Синтез безводных хлоридов». Во второй части: «Получение галогенводородных кислот», «Синтез комплексных соединений», «Получение оксидов», «Алюмотермия». Практикум «Неорганический синтез» дает возможность ознакомиться со способами получения и свойствами простых веществ и сложных соединений.
ПРЕДИСЛОВИЕ
Учебное пособие выполнено на модульной основе и предназначено для студентов химического факультета университета, изучающих дисциплину «Неорганический синтез» (цикл СД по специальности 020101 -«Химия»); также может использоваться при проведении практикума по «Основам неорганического синтеза» (цикл ОПД по направлению 020900 – «Химия, физика и механика материалов») Лабораторный практикум «Неорганический синтез» строится так, чтобы студенты могли синтезировать соединения различных классов, используя при этом различные методы синтеза. Практикум в целом состоит из 6 модулей. В каждом модуле содержится краткая теоретическая часть, описание различных методик выполнения синтеза, вопросы для самоподготовки, вопросы для самоконтроля, проектное задание и тест рубежного контроля. Учебное пособие состоит из двух частей; включает в себя рекомендации по технике безопасности и правилам поведения в химической лаборатории, по оказанию первой доврачебной помощи своими силами; рекомендации по оформлению отчетов; программу подготовки к коллоквиумам; список рекомендуемой литературы. В первую часть пособия включено 2 модуля: «Восстановление водородом» и «Синтез безводных хлоридов». Во вторую часть остальные 4 модуля: «Получение галогенводородных кислот», «Синтез комплексных соединений», «Получение оксидов», «Алюмотермия».
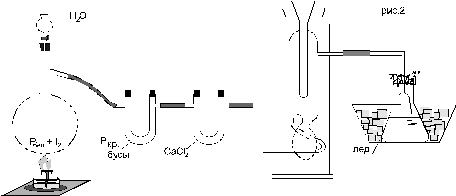
Модуль 3. ПОЛУЧЕНИЕ ГАЛОГЕНВОДОРОДНЫХ КИСЛОТ Комплексные цели: знать методы получении галогеноводородов, их физические и химические свойства, правила работы с бромом, иодом, фосфором и галогеноводородами; уметь собирать установку для получения бромистоводородной или иодистоводородной кислот, определять плотности растворов и рассчитывать концентрацию полученных растворов. Теоретическая часть Методы получения галогеноводородов и их особенности. Галогеноводороды можно получать различными способами: - непосредственный синтез из простых веществ, - гидролиз галогенидов неметаллов, - вытеснение НГ из соответствующих солей нелетучими кислотами, - термическое разложение кислых галогенидсодержащих солей, - восстановление простых веществ сильными восстановителями. Наиболее активные галогены (хлор и фтор) - реагируют с водородом с большой скоростью. Их взаимодействие сопровождается взрывом; поэтому для лабораторного получения фтористого водорода и хлористого водорода применяют более удобные методы, хотя хлороводород получают в промышленности именно этим методом. Остальные галогены соединяются с водородом непосредственно в незначительной мере, реакции обратимы и идут с малым выходом. Поэтому непосредственное взаимодействие водорода с бромом и йодом находит ограниченное применение. Тем не менее, существует лабораторный метод получения бромоводорода на платиновом катализаторе. Большинство галогенидов неметаллов подвергается гидролизу с образованием соответствующих галогеноводородов. Практическое значение имеет получение этим способом бромистого водорода и йодистого водорода из галогенидов фосфора. Взаимодействие галогенидов металлов с кислотами находит применение для получения водородных соединений фтора, хлора и брома. Однако нужно учитывать легкую окисляемость бромидов и йодидов. Поэтому при выделении из галогенидов йодистого водорода и бромистого водорода лучше применять фосфорную, а не серную кислоту, так как последняя окисляет йодид- и бромид-ионы с выделением галогена в свободном виде, что существенно снижает выход продукта. Еще одним способом получения бромистого и йодистого водорода является взаимодействие брома и йода с сильными восстановителями, например с сероводородом, с сернистым газом и др. Бромистый водород часто получают также путем взаимодействия брома с различными углеводородами (парафином, антраценом и др.). Такой метод дает невысокие выходы продукта, так как часть брома затрачивается на бромирование применяемого соединения. Особое значение имеет реакция разложения КНF2, т.к. она дает возможность получить совершенно безводный HF. Следует учитывать, что бромоводород и йодоводород постепенно окисляются кислородом воздуха, поэтому получение и хранение их представляет значительные трудности. Растворы бромо- и йодоводорода хранят в склянках из темного стекла на холоду. Практическая часть Бромистоводородная кислота Представляет собой бесцветную жидкость, которая иногда окрашена следами брома в желтоватый цвет. Хранить бромистоводородную кислоту следует в прохладном месте в склянках из темного стекла, т.к. на свету, а также при нагревании она частично разлагается. Собрать установку, изображенную на рисунке 8. В перегонную колбу поместить 22 г йода и постепенно небольшими кусочками добавить 2 г белого фосфора. Прибавление первых кусочков сопровождается энергичной реакцией с появлением пламени. В дальнейшем реакция идет более спокойно. Необходимо следить, чтобы фосфор попадал в середину колбы. После внесения всего фосфора получается темная масса йодистого фосфора. Колбу закрыть пробкой с капельной воронкой и прилить постепенно 3 мл воды. Получающийся йодистый водород, как правило, загрязнен йодом. Для очистки выделяющийся газ нужно пропустить через U-образную трубку, наполненную смесью увлажненного красного фосфора со стеклянными бусами. Для осушки йодистого водорода (это необходимо, если ставится цель получить иодоводород, а не водный раствор кислоты) во вторую U-образную трубку поместить хлористый кальций.
Рисунок 8 – Схема установки для получения водного раствора HI В целях дополнительной очистки, учитывая сравнительно высокую температуру кипения HI, можно осуществить его сжижение в приборе, изображенном на рис. 8 между хлоркальциевой трубкой и колбой-приемником. В качестве хладагента используется твердая углекислота в смеси с эфиром. После прекращения охлаждения жидкий HI медленно испаряется и поглощается ледяной водой (количество воды – 50 мл). Газоотводная трубка не должна быть погружена в воду во избежание засасывания воды. В конце эксперимента реакционную колбу необходимо слабо подогреть до полного осветления. При помощи ареометра измерить плотность получившейся йодистоводородной кислоты, а по данным таблицы 2 определить концентрацию раствора (для точного определения концентрации кислоты при необходимости использовать метод интерполяции). Измерить объем полученного раствора. Йодистоводородная кислота, особенно концентрированная, легко окисляется кислородом воздуха с выделением йода, который окрашивает раствор в бурый цвет. Реакция ускоряется при нагревании и на свету. Поэтому хранить йодистоводородную кислоту следует в прохладном месте в темной склянке. Вопросы для самоконтроля к Модулю 3 1. Какие методы получения галогеноводородов известны? 2. Почему синтез фтороводорода и хлороводорода из простых веществ малоприменим в лабораторных условиях? 3. В чем проблемы синтеза бромо- и йодоводорода из простых веществ? 4. Почему получение бромоводорода взаимодействием бромидов с концентрированной серной кислотой затруднено? Чем можно заменить серную кислоту? Возможно ли получение фторо-, хлоро- и йодоводорода таким способом? 5. Какие восстановители можно применить для получения бромо- и йодоводороа из брома и йода? Составьте уравнения реакций. 6. Какие из галогеноводородов могут образовывать кислые соли и почему? Как их можно использовать для получения галогеноводородов? 7. Каковы условия хранения водных растворов бромо- и йодоводорода и почему? 8. Какие меры безопасности следует соблюдать при работе с бромом и почему? В чем заключаются трудности при работе с белым фосфором?
Проектное задание к модулю 3. Провести синтез какой-либо из галогенводородных кислот. Рассчитать практический выход. Написать уравнения реакций, отражающих химические свойства полученного вещества. Бланк ответов
Теоретическая часть Аммино- и ацидокомплексы Аммиакаты – это комплексные соединения, в которых функции лигандов выполняют молекулы аммиака NH3. Более точное название комплексов, содержащих аммиак во внутренней сфере – аммины; однако молекулы NH3 могут находиться не только во внутренней, но и во внешней сфере соединения – аммиаката. Аммиачные комплексы обычно получают при взаимодействии солей или гидроксидов металлов с аммиаком в водных или неводных растворах, либо обработкой тех же солей в кристаллическом состоянии газообразным аммиаком, например: AgCl(т) + 2NH3 × H2O = [Ag(NH3)2]Cl + 2H2O Cu(OH)2(т) + 4NH3 × H2O = [Cu(NH3)4](OH)2 + 4H2O NiSO4 + 6NH3 × H2O = [Ni(NH3)6]SO4 + 6H2O CoCl2 + 6NH3(г.) = [Co(NH3)6]Cl2 В тех случаях, когда аммиачный комплекс неустойчив в водном растворе, его можно получить в среде жидкого аммиака:
AlCl3 + 6NH3(ж) = [Al(NH3)6]Cl3 Практическая часть Поддерживая эту температуру во время прибавления раствора соли, через реакционную колбу пропускают достаточно быстрый ток аммиака, для того чтобы концентрация аммиака в растворе была по возможности постоянной. Сразу же при прибавлении соли никеля из раствора начинают выпадать бледно-фиолетовые кристаллы соответствующего комплекса.
Получение гидроксида никеля. Для получения 10 г Ni(OH)2 ∙1/4H2O берут рассчитанное по реакции обмена количество имеющейся в лаборатории растворимой соли никеля (лучше использовать Ni(NO3)2 ∙6H2O), растворяют ее в горячей воде (100-120 мл) и осаждают горячим раствором щелочи (10-12 г в 100-120 мл воды). Образовавшийся осадок фильтруют и тщательно промывают на воронке Бюхнера до полного удаления анионов соли.
Методика приготовления. 20 г углекислого кобальта нужно растворить в строго рассчитанном количестве концентрированной азотной кислоты (можно исходить и из готового препарата азотнокислого кобальта). Затем разбавить раствор водой до 200 мл и прилить его к смеси, состоящей из 250 мл концентрированного раствора аммиака и раствора, содержащего 100 г углекислого аммония в 500 мл воды. Через полученный интенсивно-фиолетовый раствор пропускают затем в течение 3-х часов сильный ток воздуха: цвет раствора изменяется при этом на кроваво-красный. После окончания окисления раствор концентрируют выпариванием в фарфоровой чашке до объёма в 300 мл, причем во время упаривания каждые 15 минут прибавляют приблизительно по 5 г углекислого аммония (всего 25-30 г). После этого отфильтровывают от незначительных примесей, сгущают до 200 мл, прибавляя небольшими порциями ещё 10 г углекислого аммония, и дают раствору кристаллизоваться, медленно его охлаждая. Выделяются красивые большие пурпурного цвета кристаллы в виде больших табличек. Их отфильтровывают и промывают сначала небольшим количеством воды, затем разбавленным спиртом и наконец чистым спиртом. Упаривая маточный раствор, можно получить вторую фракцию менее чистого продукта: его выщелачивают при обыкновенной температуре пятнадцатикратным весовым количеством воды и фильтрат медленно осаждают 2-3-мя объемами спирта. Выделившуюся соль промывают, как описано выше. Общий выход 22-25 г. Продукт кристаллизуется в виде очень красивых блестящих табличек пурпурного цвета. Растворяется в воде, образуя раствор кроваво-красного цвета. При подкислении соляной кислотой превращается в [Co(NH3)4(H2O)Cl]Cl2, а при дальнейшей обработке аммиаком в [Co(NH3)5H2O]Cl3, который при нагревании с концентрированной соляной кислотой переходит в [Co(NH3)5Cl]Cl2. Вопросы для самоконтроля к Модулю 4 1. Что называют аммиакатами? Ацидокомплексами? Какова устойчивость комплексов? 2. Все ли аммиачные комплексы можно получить из водных растворов? 3. Какие существуют способы разрушения аммиакатов? 4. Как на основе величин произведений растворимости осадков, констант устойчивости комплексов можно прогнозировать образование и разрушение комплексных ионов?
Проектное задание к модулю 4. Провести синтез одного из предложенных комплексных соединений. Рассчитать практический выход. Написать уравнения реакций, отражающих химические свойства полученного вещества. Бланк ответов
Модуль 5. ПОЛУЧЕНИЕ ОКСИДОВ
Комплексные цели: знать классификацию и номенклатуру оксидов, основные способы получения; строение высших оксидов хрома, молибдена и вольфрама, оксида хрома (+3); уметь объяснять закономерности изменения кислотно-основных и окислительно-восстановительных свойств, писать уравнения реакций, отражающих химические свойства оксидов.
Теоретическая часть Для приготовления некоторых оксидов (но только низших) применяются в качестве исходных веществ оксалаты, так как при их разложении выделяются окись и двуокись углерода, в атмосфере которых оксиды металлов могут существовать не окисляясь. Прокаливанием оксалатов можно получить оксиды элементов в двухвалентном состоянии: железа, марганца и олова, но получаются они при этом не очень чистыми. Солями большинства других кислот нельзя пользоваться для приготовления оксидов, так как многие из этих солей не разлагаются даже при сильном нагревании. Так, полное разложение сульфатов большинства тяжелых металлов происходит только при 700-800°, а в некоторых случаях при еще более высокой температуре. Соли, образованные нелетучими кислотами (фосфаты, бораты, вольфраматы и др.) при нагревании не разлагаются за исключением солей аммония и ртути и потому не могут служить исходными веществами для получения оксидов. Ртутные же и аммонийные соли вольфрамовой, молибденовой, ванадиевой и некоторых из других кислот могут быть использованы для получения ангидридов этих кислот. При прокаливании аммонийных солей нелетучих кислот необходимо учитывать то обстоятельство, что выделяющийся аммиак является сильным восстановителем. Это может привести к загрязнению получаемого продукта низшими оксидами элементов. Так, при прокаливании парамолибдата аммония в закрытом тигле получается главным образом двуокись молибдена, а не молибденовый ангидрид. В качестве исходных веществ для получения оксидов можно применять также гидроксиды. При прокаливании гидроокисей хрома, олова, алюминия, магния, цинка, меди, кадмия, стронция, бария и некоторых редких элементов можно получать оксиды соответствующих элементов. Для каждого отдельного случая имеется своя определенная температура разложения. Однако дегидратация не всегда идет до конца, и часто полученные таким образом оксиды содержат небольшое количество гидроокиси. Чтобы получить чистые оксиды железа, кобальта, никеля, марганца и свинца по составу строго отвечающие соответствующим формулам необходимо соблюдать температурный режим прокаливания, а в некоторых случаях и определенные условия получения исходных веществ, т.е. гидратов окисей. Для получения чистых оксидов способ прокаливания их гидратов имеет все же ограниченное применение, так как большинство гидроокисей трудно получить в чистом, свободном от примесей состоянии (многие гидраты при осаждении их из растворов очень прочно удерживают различные ионы). Наконец, для получения оксидов можно использовать и некоторые кислоты и их гидратированные формы. Прокаливанием такого рода веществ можно получить йодноватый, молибденовый, вольфрамовый, теллуровый, ванадиевый, ниобиевый, танталовый, кремневый и борный ангидриды, пятиокиси и трехокиси мышьяка и сурьмы, трехокись висмута, двуокиси селена и олова, а также трехокись и двуокись теллура. Получение оксидов прокаливанием различных соединений несложно по выполнению. Когда требуется получить чистый продукт, наибольшее внимание нужно уделять очистке исходных веществ, а в некоторых случаях и выбору материала, из которого сделан тигель. За очень редким исключением почти все примеси, имеющиеся в исходных веществах, остаются после прокаливания в полученном продукте. Довольно часто продукт несколько загрязняется материалом тигля (происходит как бы внедрение получаемого оксида в материал тигля и наоборот). Температура прокаливания влияет на физическое состояние получаемых оксидов. При низких температурах получаются мелкодисперсные порошки. Особенно часто это явление наблюдается при прокаливании гидратированных форм оксидов. Прокаливание при высоких температурах приводит к получению крупнозернистых порошков. Рост частиц оксида с повышением температуры прокаливания происходит не только в результате диффузионных процессов в твердой фазе, но также и за счет испарения мелких частиц с последующей конденсацией пара на более крупных. Это явление особенно характерно для оксидов, имеющих при температуре прокаливания заметное давление пара, например для трехокиси и двуокиси молибдена и вольфрама, трехокиси сурьмы и некоторых других. Практическая часть Крупнокристаллического Трехокись молибдена МоО3 – белый, нежный, напоминающий тальк порошок. В кристаллическом состоянии – бесцветные кристаллы с зеленоватым оттенком. Температура плавления – 795°С, температура кипения - 1155°С; выше 650°С МоО3 заметно сублимирует. Растворимость МоО3 в воде низка и составляет 0,4-2 г/л при комнатной температуре. МоО3 растворяется в водных растворах щелочей, аммиака, а также в растворах минеральных кислот (составьте уравнения; какие свойства проявляет МоО3 в каждой из них?). МоО3 восстанавливается водородом до металла при 700-1000°С. Для получения МоО3 молибдат аммония в количестве 15 г подвергается нагреванию в фарфоровой чашке в течение» 2 часов (уравнение реакции).
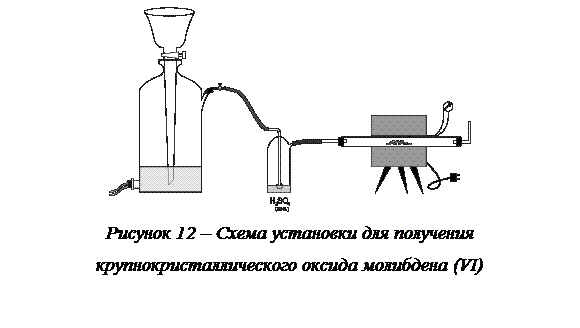
Молибденовый ангидрид, полученный таким образом, часто имеет синеватую окраску, вызванную образованием низших оксидов молибдена (в степени окисления +5 или +4). Это объясняется восстановительным действием аммиака, выделяющегося в ходе разложения (напишите уравнение реакции). Для получения МоО3 и его возгонки прокаленный остаток растирают, помещают в тугоплавкую трубку (см.рисунок 12) и нагревают в токе кислорода или воздуха в течение 1,5-2 часов при температуре около 700°С. Препарат для прокаливания помещают ближе к входному отверстию трубки, что обеспечивает оседание возогнанного препарата на холодном конце трубки. Вопросы для самоконтроля к модулю 5 1. Какие Вы знаете способы получения оксидов? 2. Все ли оксиды могут быть получены разложением нитратов и карбонатов? 3. Почему разложение оксалатов используется только для получения низших оксидов? 4. Охарактеризуйте применимость реакций разложения сульфатов, фосфатов, боратов, солей аммония, гидроксидов для получения оксидов. 5. Охарактеризуйте применимость реакций разложения основных и кислотных гидроксидов для получения оксидов 6. Каково поведение примесей при проведении реакций разложения? 7. Каково физическое состояние оксида, полученного в результате реакции разложения, и как его можно менять, регулируя температуру?
Проектное задание к модулю 5. Провести синтез какого-либо из оксидов. Рассчитать практический выход. Написать уравнения реакций, отражающих химические свойства полученного вещества. Бланк ответов
Теоретическая часть Практическая часть При проведении алюмотермических реакций необходимо соблюдать некоторые правила предосторожности. Алюминий берут в виде мелких крупинок. Порошкообразный алюминий, имеющийся в продаже под названием алюминиевой пудры, непригоден (он содержит окисленный металл). С неокисленным алюминием реакции протекают слишком бурно, происходит разбрасывание шихты, что снижает выход получаемого металла. Реакцию проводить в вытяжном шкафу, откуда убрать все легковоспламеняющиеся материалы. Тигель поместить в песок. Работать в кожаных перчатках и защитных очках. Общая методика. - подготовка исходных веществ и реактора; - приготовление зажигательной смеси и заполнение реактора; - проведение металлотермической реакции; - разделение продуктов реакции. Подготовка исходных веществ и реактора. Все вещества, необходимые для реакции (оксиды, алюминий, магний), а также реактор (тигель) необходимо предварительно просушить при 150–200оC (при наличии влаги реакционная масса сильно разбрасывается). Оксиды, которые прочно удерживают влагу, необходимо прокалить в муфеле. После этого оксиды растирают в порошок и отделяют на сите от неразмельченных частичек (если это необходимо). Высушенные и размельченные исходные вещества отвешивают на технических весах и тщательно перемешивают. При проведении реакции следует брать не менее 25 − 30 г исходных веществ (суммарно). С большим количеством веществ реакции идут лучше, и выход металлов увеличивается. Масса восстановителя (алюминия) должна быть равна теоретически рассчитанной массе. Чтобы получить металл или сплав без алюминия, следует брать его несколько меньше теоретически рассчитанного на 1 – 2 %. В качестве восстановителя можно использовать смеси порошкообразных металлов или смеси металлов с кремнием, например: 4Cr2O3 + 3Mg + 6Al = 8Cr + 3Mg(AlO2) 2 Несмотря на то, что алюминат магния плавится при 2135оC, т.е. выше, чем оксид алюминия, реакции со смесью восстановителей идут лучше. Это объясняется тем, что при использовании данной смеси металлов теплоты выделяется больше, чем при использовании в качестве восстановителя алюминия. Например, алюминий оксид хрома (III) непосредственно не восстанавливает ввиду недостаточного количества выделяющейся теплоты. А смесь алюминия с магнием или кальцием этот оксид восстанавливает. Приготовление зажигательной смеси и заполнение реактора. Зажигательную смесь готовят смешиванием 9 масс. ч. растертого пероксида бария с 1 масс. ч. порошкообразного алюминия. Можно использовать смесь, приготовленную из 4 масс. ч. растертого пероксида бария и 1 масс. ч. порошкообразного алюминия с добавлением 0,7 масс. ч. отдельно растертого хлората калия. Иногда берут 3 масс. ч. растертого нитрата калия и 1,3 масс. ч. алюминиевой пудры. Смешивать эти вещества нужно очень осторожно! Зажигательную смесь хранят в сухой, хорошо закупоренной стеклянной банке; приготовлять ее в больших количествах не рекомендуется. Заполнение реактора шихтой. В качестве реактора используют магнезиальные или корундовые тигли, так как они термически стойки и вещества при работе с ними меньше загрязняются. Фарфоровые тигли, как правило, разрушаются. Поэтому их нужно помещать в песок, чтобы расплавленная масса не выливалась. Более удобны шамотовые или глиняные тигли, но в этом случае продукт несколько загрязняется кремнием и другими веществами. Тигель 1 (рис.13) заполняют на ¾ его высоты смесью из оксида и восстановителя. Утрамбовывают массу, делают небольшое углубление и засыпают сверху тонким слоем (1 – 1,5мм) зажигательной смеси. Ленту магния вставляют в углубление, которое, которое затем заполняют зажигательной смесью в форме горки. Если лента магния покрыта слоем оксида, ее следует очистить ножом. Меры предосторожности. Реакцию проводят в вытяжном шкафу, откуда убирают все легковоспламеняющиеся материалы. Тигель помещают в песок. Работают в защитных очках! Проведение опыта. Зажигательную смесь поджигают при помощи магниевой ленты, которую можно поджечь длинной лучиной. Если имеются магниевые стружки, то можно поджечь магний, зажав стружки длинными тигельными щипцами, и бросить их на зажигательную смесь. Разделение продуктов реакции. После окончания реакции тигель охлаждают, разбивают и «королек» металла отделяют от шлака. Иногда кусочки металла остаются в шлаке в виде включений. В этом случае шлак нужно разбить и отделить от него металл; кусочки шлака, приставшие к металлу, удаляют с помощью молотка на стальной плите. Выход продуктов реакции. Выход продуктов реакции в лабораторных условиях в лучшем случае составляет 80 – 90 % от теоретического (чаще - 60 – 70%). Выход в значительной степени определяется чистотой отделения металла от шлака, в котором металл часто остается в виде мелких трудноотделимых включений. Получение ванадия. Приготовить смесь из 7,5г V2O5 (тщательно просушенный в сушильном шкафу при 120-130оС) и 4,82г Al - порошка. На дно шамотового (корундового или фарфорового) тигля поместить 2,5г CaF2, а затем реакционную смесь, как указано на рисунке. Утрамбовать ее при помощи пестика и пробиркой сделать углубление, в которое поместить ленту магния, согнутую слегка, и засыпать отверстие зажигательной смесью. Зажигательную смесь готовят встряхиванием в банке 6,75г BaO2 c 0,75г Mg порошка. Тигель поставить в баню с песком. Опыт проводить в вытяжном шкафу (надеть очки, перчатки). Осторожно поджечь ленту магния длинной горящей лучиной. После вспышки дать остыть расплавленной массе, разбить тигель и вынуть королек металла. 2. Получение хрома. Реакционная смесь из 8г покаленного Cr2O3, 8г сплавленного K2Cr2O7 и 8г Al порошка. Все вещества тщательно перемешать в ступке. На дно шамотового тигля насыпать 5г CaF2, а затем реакционную смесь. Зажигательная смесь: 1вес.ч. (4г) порошка Al и 3 вес.ч. (12г) перекиси бария.
3. Получение марганца. Приготовить смесь из порошкообразного Mn2O3/Mn3O4 (готовится прокаливанием порошка MnO2 в муфельной печи при 900оС), порошка Al и свежепрокаленной окиси кальция, который добавляют для уменьшения вязкости шлака и облегчения расслаивания реакционной массы, превращая Al2O3 в алюминат кальция, а не в алюминат марганца. Весовые соотношения: Mn3O4: Al: CaO = 15: 10: 2,5 (Mn3O4: Al: CaO = 7,5г: 5г: 1,25г) Зажигательная смесь: 1 вес.ч.(2г) Al порошка и 3 вес.ч.(6г) перекиси бария.
4. Получение железа. Реакционная смесь: 5г Fe2O3, 1,6г порошка Al. Зажигательная смесь: 6г BaO2, 2,5г порошка Al.
6.3 Вопросы и задания для самостоятельной работы к Модулю 6 1. Какое положение занимает алюминий в Периодической Системе? Написать электронную конфигурацию атома алюминия; какие степени окисления он может проявлять; каковы его валентные возможности? 2. В виде каких соединений алюминий встречается в природе; как его получают в промышленности? 3. Какое положение занимает алюминий в ряду напряжений металлов? 4. Как относится алюминий к кислороду воздуха, воде, кислотам, растворам щелочей? ем объяснить устойчивость алюминия к концентрированным растворам серной и азотной кислот? 5. Как получить из оксида алюминия: алюминат натрия, трихлорид алюминия? 6. Привести примеры комплексных соединений алюминия. 7. В каких условиях можно получить гидрид алюминия; какими свойствами он обладает? 8. В чем состоит сущность процесса алюмотермии?
Вопросы для самоконтроля к модулю 6 1. Как взаимодействует алюминий с: серой, углеродом, азотом, галогенами, фосфором? 2. Будет ли взаимодействовать металлический алюминий с растворами: поваренной соли, соды, соляной кислоты, сулемы, хлорной меди? 3. Как практически можно убедиться в том, что гидроксид алюминия обладает амфотерными свойствами? 4. Написать уравнение реакции гидролиза гидроксоалюмината калия. 5. Написать уравнения реакций получения: оксида алюминия из нитрата алюминия; сульфата алюминия из оксида алюминия. 6. Что обычно используют в качестве восстановителя при проведении алюмотермического восстановления оксидов? 7. Почему некоторые оксиды не восстанавливают алюмотермически, хотя термодинамически эти процессы возможны? 8. Какие меры предосторожности необходимо соблюдать в процессе алюмотермического восстановления оксидов? 9. Чем чаще всего может быть загрязнен металл, полученный алюмотермическим путем?
Проектное задание к модулю 6. Провести синтез металла из его оксида алюмотермическим способом. Рассчитать практический выход. Написать уравнения реакций, отражающих химические свойства полученного вещества.
Бланк ответов ПО НЕОРГАНИЧЕСКОМУ СИНТЕЗУ» (часть 2)
УЧЕБНОЕ ПОСОБИЕ на модульной основе для студентов химического факультета ЮФУ
Ростов-на-Дону
Учебное пособие разработано: кандидатом технических наук, старшим преподавателем кафедры общей и неорганической химии ЮФУ Лисневской И.В., кандидатом технических наук, старшим преподавателем кафедры общей и неорганической химии ЮФУ Рыбальченко И.В.
Рецензент: доктор технических наук, профессор Нестеров А.А.
Ответственный редактор доктор химических наук, профессор Лупейко Т.Г.
Печатается в соответствии с решением кафедры общей и неорганической химии химического факультета ЮФУ, протокол № 3 от 31 марта 2010г.
Учебное пособие предназначено для студентов химического факультета университета, изучающих дисциплину «Неорганический синтез»; выполнено на модульной основе с диагностико-квалиметрическим обеспечением. Выполнено в соответствии с программой и состоит из двух частей. В первой части – модули: «Восстановление водородом» и «Синтез безводных хлоридов». Во второй части: «Получение галогенводородных кислот», «Синтез комплексных соединений», «Получение оксидов», «Алюмотермия». Практикум «Неорганический синтез» дает возможность ознакомиться со способами получения и свойствами простых веществ и сложных соединений.
ПРЕДИСЛОВИЕ
Учебное пособие выполнено на модульной основе и предназначено для студентов химического факультета университета, изучающих дисциплину «Неорганический синтез» (цикл СД по специальности 020101 -«Химия»); также может использоваться при проведении практикума по «Основам неорганического синтеза» (цикл ОПД по направлению 020900 – «Химия, физика и механика материалов») Лабораторный практикум «Неорганический синтез» строится так, чтобы студенты могли синтезировать соединения различных классов, используя при этом различные методы синтеза. Практикум в целом состоит из 6 модулей. В каждом модуле содержится краткая теоретическая часть, описание различных методик выполнения синтеза, вопросы для самоподготовки, вопросы для самоконтроля, проектное задание и тест рубежного контроля. Учебное пособие состоит из двух частей; включает в себя рекомендации по технике безопасности и правилам поведения в химической лаборатории, по оказанию первой доврачебной помощи своими силами; рекомендации по оформлению отчетов; программу подготовки к коллоквиумам; список рекомендуемой литературы. В первую часть пособия включено 2 модуля: «Восстановление водородом» и «Синтез безводных хлоридов». Во вторую часть остальные 4 модуля: «Получение галогенводородных кислот», «Синтез комплексных соединений», «Получение оксидов», «Алюмотермия».
Модуль 3. ПОЛУЧЕНИЕ ГАЛОГЕНВОДОРОДНЫХ КИСЛОТ Комплексные цели: знать методы получении галогеноводородов, их физические и химические свойства, правила работы с бромом, иодом, фосфором и галогеноводородами; уметь собирать установку для получения бромистоводородной или иодистоводородной кислот, определять плотности растворов и рассчитывать концентрацию полученных растворов. Теоретическая часть
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 1006; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.189.143.150 (0.019 с.) |

 Кристаллизацию заканчивают, охлаждая реакционную смесь в водяной бане. Кристаллы отфильтровывают на воронке Бюхнера, несколько раз промывают холодным раствором концентрированного аммиака Сушат полученные кристаллы в чашке Петри на воздухе при комнатной температуре. Выход в этом синтезе достаточно высокий, около 90%.
Кристаллизацию заканчивают, охлаждая реакционную смесь в водяной бане. Кристаллы отфильтровывают на воронке Бюхнера, несколько раз промывают холодным раствором концентрированного аммиака Сушат полученные кристаллы в чашке Петри на воздухе при комнатной температуре. Выход в этом синтезе достаточно высокий, около 90%.