Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методика синтеза бромистоводородной кислоты гидролизом бромида фосфораСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
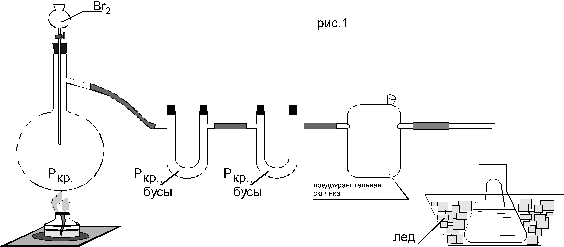
Собрать установку, изображенную на рис. 7. В колбу для перегонки поместить 5 г красного фосфора и 10 мл воды. Из капельной воронки очень медленно, по каплям прилить 18 мл брома. Бромистый водород получается в результате гидролиза образующихся в колбе бромидов фосфора. Реакция протекает бурно, с появлением пламени. Выделяющийся газ проходит через U-образную трубку, наполненную стеклянными бусами, перемешанными с увлажненным красным фосфором (для поглощения паров избыточного брома). Рис.7 Схема установки для получения водного раствора HBr Газ улавливается в поглотителе, который представляет собой небольшую колбу с водой (75-80 мл Н2О), охлаждаемую льдом. Охлаждение необходимо, т.к. при растворении HBr выделяется большое количество тепла. Необходимо следить, чтобы газоотводная трубка не была погружена в воду, так как из-за очень большой растворимости бромоводорода может произойти переброс жидкости в
Реакционный сосуд. Для предотвращения этого между U-образной трубкой и поглотителем ставится предохранительная склянка. По мере протекания реакции выделение газа ослабляется. После прибавления всего брома реакционную колбу следует осторожно прогреть спиртовкой. Измерить объем полученного раствора. Определить плотность получившейся бромистоводородной кислоты при помощи ареометра, а по данным таблицы 1 рассчитать концентрацию (для точного определения концентрации кислоты при необходимости использовать метод интерполяции). Рассчитать выход продукта. Бромистоводородная кислота Представляет собой бесцветную жидкость, которая иногда окрашена следами брома в желтоватый цвет. Хранить бромистоводородную кислоту следует в прохладном месте в склянках из темного стекла, т.к. на свету, а также при нагревании она частично разлагается. Методика синтеза йодистоводородной кислоты
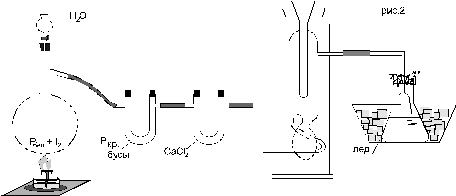
Собрать установку, изображенную на рисунке 8. В перегонную колбу поместить 22 г йода и постепенно небольшими кусочками добавить 2 г белого фосфора. Прибавление первых кусочков сопровождается энергичной реакцией с появлением пламени. В дальнейшем реакция идет более спокойно. Необходимо следить, чтобы фосфор попадал в середину колбы. После внесения всего фосфора получается темная масса йодистого фосфора. Колбу закрыть пробкой с капельной воронкой и прилить постепенно 3 мл воды. Получающийся йодистый водород, как правило, загрязнен йодом. Для очистки выделяющийся газ нужно пропустить через U-образную трубку, наполненную смесью увлажненного красного фосфора со стеклянными бусами. Для осушки йодистого водорода (это необходимо, если ставится цель получить иодоводород, а не водный раствор кислоты) во вторую U-образную трубку поместить хлористый кальций.
Рисунок 8 – Схема установки для получения водного раствора HI В целях дополнительной очистки, учитывая сравнительно высокую температуру кипения HI, можно осуществить его сжижение в приборе, изображенном на рис. 8 между хлоркальциевой трубкой и колбой-приемником. В качестве хладагента используется твердая углекислота в смеси с эфиром. После прекращения охлаждения жидкий HI медленно испаряется и поглощается ледяной водой (количество воды – 50 мл). Газоотводная трубка не должна быть погружена в воду во избежание засасывания воды. В конце эксперимента реакционную колбу необходимо слабо подогреть до полного осветления. При помощи ареометра измерить плотность получившейся йодистоводородной кислоты, а по данным таблицы 2 определить концентрацию раствора (для точного определения концентрации кислоты при необходимости использовать метод интерполяции). Измерить объем полученного раствора. Йодистоводородная кислота, особенно концентрированная, легко окисляется кислородом воздуха с выделением йода, который окрашивает раствор в бурый цвет. Реакция ускоряется при нагревании и на свету. Поэтому хранить йодистоводородную кислоту следует в прохладном месте в темной склянке.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 524; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.103.119 (0.007 с.) |