
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Анализ качества осахаривающих материалов. Часть IIСодержание книги
Поиск на нашем сайте
Цель работы: изучить требования, предъявляемые к осахаривающим материалам, используемым в спиртовой промышленности; освоить модифицированный фотоэлектроколориметрический метод определения амилолитической активности ферментных препаратов. Аппаратура и реактивы: - фотоэлектроколориметр; - водяная баня, лабораторная посуда, пипетки; - 2 %-ный раствор крахмала; - буферные растворы ацетатный, рН 4,7; - 0,1 н раствор соляной кислоты; - основной раствор йода; - рабочий раствор йода, дистиллированная вода; - амилолитические ферментные препараты.
Задание 1 Определить α-амилазную активность ферментных препаратов модифицированный фотоколориметрическим методом Метод разработан К. М. Бендецким и Е. С. Павловой под руководством В. Л. Яровенко во ВНИИ пищевой биотехнологии (ВНИИПБТ). Он основан на определении скорости ферментативной реакции гидролиза крахмала, которую устанавливают по глубине превращения крахмала под действием фермента с применением колориметрической реакции крахмала с йодом. Глубину превращения крахмала по полученным данным определяют отношением подвергшихся гидролизу α-амилазой гликозидных связей к первоначальному числу этих связей в субстрате до гидролиза. За единицу активности а-амилазы принимают такое количество фермента, которое катализирует расщепление за 1 мин при рН 4,7 и температуре 30° С 1 мкмоль гликозидных связей в растворимом крахмале при начальной его концентрации в инкубационной среде 1%. Реактивы: - 1 н ацетатный буфер с рН 4,7; - 0,1 н раствор соляной кислоты; - рабочий раствор йода. Подготовка к анализу: В качестве субстрата используют 2 %-ный раствор крахмала. 2 г растворимого крахмала с учетом влажности помещают в мерную колбу вместимостью 100 см3, добавляют 50 см3 дистиллированной воды, помещают колбу с содержимым в кипящую водяную баню и выдерживают при непрерывном перемешивании до полного растворения крахмала. После этого содержимое колбы охлаждают, добавляют 20 см3 1 н ацетатного буфера и доводят объем до метки дистиллированной водой при 20° С. Раствор крахмала готовят в день проведения анализа. Проведение анализа: Берут две пробирки, наливают в каждую по 5 см3 субстрата и ставят в ультратермостат с температурой 30±0,2 0С. Пробирки с содержимым выдерживают при этой температуре 10 мин. Одновременно прогревают при данной температуре ферментный раствор и дистиллированную воду. Затем в одну пробирку вносят 5 см3 дистиллированной воды (контрольная проба), в другую - 5 см3 ферментного раствора (опытная проба). Смеси быстро перемешивают и удерживают в ультратермостате при температуре 30+0,2° С в течение 10 и 20 мин. Через 10 и затем через 20 мин из реакционных смесей отбирают по 0,5 см3 раствора и переносят в колбы, куда предварительно наливают по 50 см3 рабочего раствора йода. Реакционные смеси выдерживают 20 мин при комнатной температуре, после чего измеряют оптическую плотность окрашенных растворов (опытного и контрольного) на электроколориметре в кювете с толщиной слоя 10 мм, используя красный светофильтр (длина волны = 650 нм). Получают ряд значений оптической плотности At опытных растворов определяемых через 10 и 20 мин (A10 и A20), а также контрольных растворов при этих температурах (Ak).
Обработка результатов α-Амилазную активность рассчитывают по формуле: АС =
где At и Ак - оптическая плотность ислледуемого и контрольного растворов; а - содержание ферментного препарата в реакционной среде, г/см3; t – время инкубации, мин; 4,11 - постоянный коэффициент. Пример. На анализ взят спиртоосажденный препарат культу A.awamori. Готовят его раствор - 0,1 г на 100 см3 дистиллированн воды. Затем разбавляют в 10 раз. Отбирают 5 см3 для проведения ферментативной реакции с 5 см3 субстрата. В 1 см3 реакционной среды держится препарата а = 5·10-5 г (0,1·1·5/100·10·10). После проведения реакции с йодом были получены следующие значения оптических плотностей: А10 = 0,700, А20 = 0,520, Ак = 0,9 Подставляя полученные значения в формулу, можно рассчитать амилолитическую активность исследуемого препарата: АС1 = АС2 = АС1 и АС2 - значения декстриногенной активности, вычисленые по данным, полученным за 10 и 20 мин инкубации, близки по величине (1200,9 и 1147,5). Среднее значение их составляет 1174 ед/г. Расхождение от средних значений ±2,69%, что говорит о том, что анализ проведен правильно. Для оценки исследуемого препарата используются средние данные. Задание 3 Сделать выводы по проделанной работе, ответить на контрольные вопросы
Вопросы для контроля: 1. Расскажите методику определения амилолитической активности модифицированным фотоэлектроколориметрическим методом.
Лабораторная работа №5
|
||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 117; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.94.221 (0.006 с.) |

 , (4.1)
, (4.1)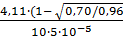 = 1200,9 ед/г;
= 1200,9 ед/г; = 1147,5 ед/г.
= 1147,5 ед/г.


