
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Анализ качества осахаривающих материалов. Часть I
Цель работы: изучить требования, предъявляемые к осахаривающим материалам, используемым в спиртовой промышленности; освоить фотоэлектроколориметрический метод определения амилолитической и глюкоамилазной активности ферментных препаратов, активности амилолитических и осахаривающих ферментов свежепроросшего солода. Аппаратура и реактивы: - фотоэлектроколориметр; - водяная баня, лабораторная посуда, пипетки; - 1 %-ный раствор крахмала; - буферные растворы ацетатный, рН 4,7; фосфатный, рН 6,0; - 0,1 н и 0.5 н растворы соляной кислоты; - основной раствор йода; - рабочий раствор йода, дистиллированная вода; - амилолитические ферментные препараты.
Задание 1 По лекциям, справочной и нормативной литературе изучить требования, предъявляемые к осахаривающим материалам, используемым в спиртовой промышленности [2, 3, 4]. При выполнении лабораторной работы подгруппа делится на бригады, каждая из которых анализирует образцы концентрированных ферментных препаратов, полученных с применением продуцентов – микроскопических грибов или бактерий, а также образцы свежепроросшего солода. Задание 2 Определение активности амилолитических ферментов 2.1 Фотоколориметрический метод Метод, разработанный во ВНИИПБ А. П. Рухлядевой и М. Г. Горячевой, основан на определении скорости ферментативной реакции гидролиза крахмала, которую устанавливают по количеству крахмала, прогидролизованного в процессе колориметрической реакции с йодом. Гидролизаты в основном состоят из декстринов с различной молекулярной массой, которые с йодом дают различную окраску: амилодек-стрины (9-17%) дают с йодом фиолетовую окраску, (α)20D = 196°, растворимы в 25 %-ном этиловом спирте; эритродекстрины (26-65%) дают с йодом красно-бурую окраску, растворимы в 55 %-ном этиловом спирте, (α)20D = 194°; ахродекстрины (5-15%) не окрашиваются йодом, растворимы в 70 %-ном этиловом спирте, (α)20D = 192°; мальтодекстрины йодом дают бесцветные растворы, растворимы в этиловом спирте, определяются вместе с сахарами, (α)20D в пределах 181-183°. Таким образом, под действием α-амилазы образуются из крахмала продукты, суммарная окраска которых с йодом отличается от таковой исходного субстрата (крахмал с йодом имеет ярко-синюю окраску).
В гидролизатах содержится от 7 до 36% спирторастворимых углеводов. В состав этих углеводов могут входить мальтодекстрины, олигосахариды (ди-, три- и тетрасахариды), т. е. полисахариды, состоящие и небольшого числа остатков моноз, и моносахариды. Редуцирующих углеводов в этой группе содержится 30% в пересчете на глюкозу. Из олигосахаридов главной составляющей частью гидролизатов может быть мальтоза. Она представляет собой α-глюкопиранозидоглюкозу. Растворы мальтозы сильно вращают плоскость поляризации вправо и обнаруживают свойства мутаротации. Мальтоза имеет одну альдегидную группу и восстанавливает Фелингову жидкость. Из олигосахаридов в состав гидролизатов входят изомальтоза, мальтотриоза и мальтотетроза. Из моносахаров в гидролизатах присутствует глюкоза, хотя и в небольших количествах. Она принадлежит к D-ряду, который характеризуется определенной конфигурацией пятого асимметрического атома углерода, наиболее удаленного от карбонильной группы. Эта конфигурация аналогична конфигурации асимметрического атома D-винной кислоты и D-глицеринового альдегида. У α-конфигурации альдоз гликозидный и соседний с ним гидроксилы (т.е. гидроксилы в положениях 1 и 2) расположены по одну сторону от цикла. У β-конфигурации альдоз, которые являются аномерами α-альдоз, гидроксилы расположены по разные стороны цикла. Как было сказано выше, полученный в результате ферментативной реакции гидролизат дает отличающуюся от исходного раствора крахмала окраску с йодом. Эта окраска приобретает фиолетовый или красно-бурый цвет в зависимости от количества фермента, введенного в реакцию. По изменению окраски реакционной среды, вызывающему снижение оптической плотности раствора, определяют количество превращенного крахмала. Сущность реакции углеводов с йодом заключается в том, что при взаимодействии полисахаридов с этим соединением протекают два процесса: комплексообразование, подчиняющееся стехиометрическим отношениям, и адсорбция. При взаимодействии крахмала с йодом в реакцию комплексообразования вступает в первую очередь амилоза. Цепь амилозы в виде спирали обвивает молекулы йода, располагающиеся по оси спиралей. На каждую молекулу йода приходится шесть глюкозных остатков. По окончании процесса комплексообразования еще небольшое количество йода может связаться с крахмалом за счет процесса адсорбции.
В амилопектине длинные периферические цепи глюкозных остатков реагируют с йодом подобно амилозе, но кроме этого процесса, с самого начала происходит адсорбция йода на крайне неровной поверхности молекул этого сильно разветвленного полисахарида. Оттенок окрашивания полисахаридов с йодом зависит от строения полисахарида, в частности от степени его ветвления, а также от длины периферических цепей. При укорачивании этих цепей уменьшается число определенным образом ориентированных молекул йода в спиралях и изменяется окраска с йодом, что наблюдается, в частности, у декстринов. По количеству превращенного крахмала по графикам определяют количество единиц декстриногенной активности, взятых на ферментативную реакцию. Вследствие специфичности ферментного комплекса и различного свойства α-амилазы у материалов различного происхождения - грибных, бактериальных, а также солодовых - зависимость степени гидролиза крахмала от количества введенных в реакцию единиц фермента будет несколько иная. При определении активности ферментного материала каждого вида для расчета применяют свое специфичное уравнение. За единицу амилолитической активности (АС) принимают такое количество фермента, которое катализирует гидролиз 1 г крахмала за 1 ч. Это количество составляет 30% крахмала, взятого для ферментативной реакции, которая проводится при температуре 30°С и рН среды: 4,7 – для грибных препаратов, 6,0 - для бактериальных и 4.8-4.9 - для солодовых. Амилолитическая активность характеризуется количеством единиц фермента, содержащихся в 1 г твердых, в 1 см3 (или 100 см3) жидких исследуемых продуктов. Метод определения амилолитической активности предназначен для анализа ферментных препаратов грибного и бактериального происхождения и полупродуктов, полученных с их применением. Этим методом возможно также определять активность культур микроорганизмов процессе их культивирования. Реактивы: - 1 %-ный раствор крахмала; - буферные растворы ацетатный, рН 4,7; фосфатный, рН 6,0; - 0,1 н и 0.5 н растворы соляной кислоты; - основной раствор йода; - рабочий раствор йода. Подготовка к анализу Для проведения анализа должна быть отобрана средняя проба продукта с соблюдением требований стандарта на отбор проб. Активность сухих материалов - концентрированных препаратов солода - дается в единицах на 1 г; жидких (ферментной вытяжки, глубинной культуры, сусла, бражки и т. д.) - в единицах на 1 см3 или 100 см3 продукта. Амилолитическая активность сыпучих продуктов определяется во влажном материале в пересчете на абсолютно сухое вещество Приготовление ферментных растворов Приготовление основного раствора из очищенных препаратов. Из средней пробы тонко измельченного препарата берут в стаканчике вместимостью 25-30 см3 навеску 0,100 г, тщательно растирают стеклянной палочкой с небольшим количеством воды и количественно переносят в мерную колбу вместимостью 100 см3. Дистиллированной водой доводят объем жидкости до метки при температуре 20°С, перемешивают и при необходимости полученный раствор фильтруют. Фильтрат используют для приготовления рабочего раствора. Последний готовят путем разбавления исходного основного раствора так, чтобы в 5 см3 рабочего раствора содержалось от 0,10 до 0,45 ед. фермента. Под действием этого количества фермента гидролизуется 20-75% крахмала. Количество вытяжки берут в зависимости от активности исследуемого препарата и разбавляют ее дистиллированной водой до 50 см3, если активность препарата от 20 до 700 ед/г, и до 200 см3 при активности 700 ед/г и выше.
Ориентировочное количество основного раствора препарата, содержащего 0,1 г препарата в 100 см3 воды, которое необходимо взять для приготовления рабочего раствора нужной концентрации, находят по таблице 3.1. Таблица 3.1 Получение рабочего и основного растворов в зависимости от активности препарата
Приготовление основного раствора из жидкой культуры микроорганизмов (культуральной жидкости, ультраконцентрата) грибного или бактериального происхождения. В мерную колбу вместимостью 100 см3 наливают 90 см3 дистиллированной воды и вносят от 1 до 5 см3 ферментного препарата в зависимости от его предполагаемой активности. Объем жидкости доводят при 20° С до метки дистиллированной водой. Рабочий раствор готовят из основного, разбавляя его дистиллированной водой при 20° С в колбах вместимостью 50 и 100 см3, Учитывая, что объем культуральной жидкости в 5 см3 рабочего раствора должен находиться в пределах 0,01-0,0002 для культуральной жидкости и 0,0002-0,00002 - для ультраконцентрата. Солод Солод измельчают на механической или ручной мельнице, отбирают среднюю пробу и определяют влажность. Одновременно из средней пробы берут навеску для определения декстриногенной активности: просяного солода - 10 г, овсяного, ржаного и ячменного - по 5 г.
Таблица 3.2 Получение рабочего ферментного раствора из солода в зависимости от его активности
Навеску заливают 10 см3 фосфатного буфера с рН 4,8-4,9 и 90 см3 дистиллированной воды. Полученную суспензию для полного извлечения фермента выдерживают в течение 60 мин в термостате с температурой 30° С, периодически перемешивая стеклянной палочкой. Затем суспензию фильтруют и фильтрат используют в качестве основного раствора для определения декстриногенной активности солода. Для проведения ферментативной реакции используют рабочий раствор, который готовят из основного путем разбавления последнего (таблица 3.2). Бражка и осахаренное сусло (полуфабрикат при производстве спирта) Для анализа бражки и осахаренного сусла их фильтраты разбавляют в 5-10 раз и получают рабочие растворы, которые используют для проведения ферментативной реакции гидролиза крахмала. Для разбавления берут 20 или 10 см3 фильтрата исследуемого материала, разбавляют в мерной колбе дистиллированной водой до объема 100 см3. Проведение анализа Ферментативная реакция гидролиза крахмала проводится в строго определенных стандартных условиях: темпера тура 30° С, рН среды 4,7 для грибных препаратов (с использованием ацетатного буфера), 6,0 для бактериальных препаратов и 4,8-4,9 для солода (с использованием фосфатного буфера); продолжительность реакции 10 мин, начальная концентрация субстрата в реакционной среде 0,65%; объем реакционной смеси 15 см3 (10 см3 субстрата и 5 см3 ферментного раствора). В две пробирки вместимостью 30 см3 наливают в каждую по10 см3 субстрата и ставят в ультратермостат с постоянной температурой 30±02°С Пробирки выдерживают там в течение 5-10 мин, для того чтобы растворы приняли необходимую температуру. Затем, не вынимая пробирок из термостата, наливают в первую 5 см3 дистиллированной воды (контрольная проба), во вторую 5 см3 рабочего раствора фермента (опытная проба), предварительно также нагретого до 30° С. Смеси быстро перемешивают и выдерживают в ультратермостате в течение 10 мин. По истечении этого времени пробирки с реакционной жидкостью вынимают из термостата, отбирают из них по 0,5 см3 и переносят в конические колбы с предварительно налитыми туда 50 см3 рабочего раствора йода в 0,1 н растворе соляной кислоты при анализе грибных культур и 0,5 н раствора - бактериальных культур. Жидкости перемешивают. При этом одновременно происходят инактивация ферментов и йодокрахмальная реакция. Растворы приобретают окрашивание: контрольный - синий цвет, опытный - фиолетово-бурый; интенсивность окраски зависит от степени гидролиза крахмала. Непосредственно после смешивания определяют оптическую плотность растворов на фотоэлектроколориметре, применяя кюветы с толщиной поглощающего слоя 10 мм и светофильтр с длиной волны 630-670 нм).
При колориметрировании в качестве раствора сравнения используют воду. Анализ проводят по инструкции, приложенной к прибору. Получают два значения оптических плотностей: A1 - оптическая плотность контрольного раствора, характеризующая количество взятого на ферментативную реакцию крахмала 0,1 г; А2 - оптическая плотность опытного раствора, характеризующая количество крахмала, находящегося в реакционной среде. Разница оптических плотностей растворов соответствует тому количеству крахмала субстрата, которое подвергалось гидролизу под действием фермента исследуемого материала. Количество прогидролизованного крахмала определяют по уравнению (3.1): С = (А1-А2)·0,1/А1 (3.1) Если окажется, что крахмала прогидролизовалось более 0,070 или менее 0,020 г, то анализ повторяют. Готовят рабочий раствор с меньшим или большим количеством основного раствора для разбавления. Если в результате ферментативной реакции количество превращенного крахмала находится в указанных пределах, полученные данные используют для определения амилолитической активности.
Обработка результатов. Амилолитическую активность (ед/г или ед/см3) различных материалов определяют по следующим уравнениям: - для материалов, полученных с грибными продуцентами: АС = - для материалов, полученных с бактериальными продуцентами: АС = - для препаратов бактериального происхождения, содержащих термастабильную α-амилазу: АС = - для солода АС = где С – количество превращенного крахмала, г: а – количество исследуемого материала в реакционной среде, мг. При вычислении амилолитической активности бражки и сусла пользуются уравнениями (3.2) или (3.5) в зависимости от материала, используемого для осахаривания крахмалистого сырья. Активность указанных полупродуктов выражают в единицах на 100 см3. Поэтому уравнения (3.2) и (3.5) приобретают несколько иной вид: АС = АС = где V – количество бражки и сусла в реакционной среде, см3.
Если осахаривание производится смесью солода и культурами микроорганизмов, то в этом случае активность сусла и бражки рассчитывают по уравнению, выведенному на основе уравнений (3.2) и (3.5). Это уравнение имеет вид: АС = Активность грибной глубинной культуры, а также ферментной вытяжки выражается в ед/100 см3 и ее определяют по уравнению (3.6). Коэффициенты расчетных уравнений получены при математической обработке экспериментальных данных изучения зависимости между количеством взятого на анализ фермента и степенью гидролиза крахмала (в коэффициенты введен пересчет на 1 ч действия фермента). Активность, полученную с применением разработанного метода, можно выразить в международных стандартных единицах, если условно принять за молярную массу крахмала молярную массу остатков глюкозы (180 -18=162), из которых состоит крахмал. В этом случае под единицей понимают такое количество фермента, которое катализирует превращение одного условного микромоля крахмала за 1 мин в принятых условиях (мкмоль/(мин·г)). Для расчета активности в международных единицах необходимо использовать следующие уравнения: - для препаратов из плесневых грибов: АС = - для бактериальных препаратов: АС = - для солодовых препаратов: АС = - для глубинной культуры грибов, сусла и бражки, осахаренной культурами плесневых грибов: АС =
- для анализа сусла и бражки, осахаренных солодом: АС = - для анализа сусла и бражки, осахаренных смесью солода и культуры грибов: АС =
Одна условная единица (г/ч·г) содержит 103 стандартные международные единицы с размерностью мкмоль/(мин·г), что видно из следующего расчета: 1 ед. =
где 106 - коэффициент перевода граммов в микрограммы; 162 - условное значение молярной массы, г/моль крахмала; 60 - коэффициент перевода часов в минуты. Фотоколориметрический метод определения амилолитической активности применим для анализа следующих материалов: - концентрированных ферментных препаратов, полученных применением продуцентов - микроскопических грибов, а также культур и полупродуктов, полученных с их применением; - концентрированных ферментных препаратов, полученных применением бактерий, а также полупродуктов, полученных с их применением; - солода различных культур, концентрированных солодовых препаратов, а также полупродуктов, например, сусла и бражки, полученных
Пример 1. Определить активность очищенного препарата. Для анализа взят препарат, полученный при глубинном культивировании А. awamori. Приготовленный основной раствор содержит 0,1 г фермента в 100 см3 дистиллированной воды. Предположим, что препарат имеет активность от 2500 до 5000 ед/г. По таблице 1 находим количество основного раствора (см3), необходимое для вторичного разбавления. Оно равно 2 см3 на 200 см3 воды. Тогда в 5 см3 рабочего раствора будет содержаться 0,05 мг препарата (а). В результате анализа получены следующие значения оптических плотностей: А1 = 0,780 и А2 - 0,500. Количество прогидролизованного крахмала по уравнению (3.1): С= Подставляя найденные значения С и а в уравнение (3.2), рассчитаем АС исследуемого препарата: АС = Для определения активности препарата в международных единицах используют уравнение (10): АС = Или полученные значения по уравнению 2 в условных единицах умножают на 103: 4462·103 = 459 628 ед/г.
Пример 2. Определить активность ячменного солода. Для анализа взят зеленый ячменный солод. Приготовлен его основной раствор 5 г на 100 см3 дистиллированной воды с фосфатным буфером. Солод хорошего качества, чистый, предположительно имеет активность от 20 до 30 ед/г. По таблице 2 находят количество основного раствора солода, необходимое для приготовления рабочего раствора. Оно равно 2 см3 на 50 см3. Тогда в 5 см3 рабочего раствора солода будет содержаться 10 мг его (а=10мг). В результате анализа получены следующие значения отических плотностей: А1 = 0,725, А2 = 0,388. Используя эти величины, находят количество прогидролизованного крахмала по уравнению (3.1): С = Подставляя найденные величины С и а в уравнение (3.5), рассчитывают АС исследуемого солода: АС = Влажность солода 38 %. Амилолитическая активность на абсолютно сухое вещество солода (29,08 ·100)/62 = 46,9 ед/г, или в международных единицах 46,9 · 103 = 4831 ед /г.
Задание 3 Сделать выводы по проделанной работе, ответить на контрольные вопросы. Вопросы для контроля: 1 Назовите требования, предъявляемые к ферментным препаратам, используемым в спиртовой промышленности. 2 Перечислите требования, предъявляемым к качеству свежепропросшего солода, используемого в спиртовой промышленности. 3 В чем выражается амилолитическая активность ферментного препарата? 4 Расскажите методику определения амилолитической активности фотоэлектроколориметрическим методом. На чем основано применение данного метода?
Лабораторная работа №4
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 187; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.79.60 (0.081 с.) |
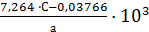 ; (3.2)
; (3.2) ; (3.3)
; (3.3) ; (3.4)
; (3.4) , (3.5)
, (3.5) ; (3.6)
; (3.6) , (3.7)
, (3.7) . (3.8)
. (3.8) ; (3.9)
; (3.9) ; (3.10)
; (3.10) ; (3.11)
; (3.11) ; (3.12)
; (3.12) ; (3.13)
; (3.13) . (3.14)
. (3.14) = 103. (3.15)
= 103. (3.15) ·0,1 = 0,0359 г.
·0,1 = 0,0359 г. ед/г.
ед/г. = 459 628 ед/г,
= 459 628 ед/г, = 0,04648 г.
= 0,04648 г.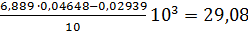 ед/г.
ед/г.


