
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сырье для производства серной кислотыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Производство серной кислоты из серы Сжигание серыпроисходит значительно проще и легче, чем обжиг колчедан. Технологический процесс производства серной кислоты из элементарной серы отличается от процесса производства из колчедана следующими особенностями: – особая конструкция печей для получения печного газа; – повышенное содержание оксида серы (4) в печном газе; – отсутствие стадии предварительной очистки печного газа. Принципиальная схема производства серной кислоты из серы представлена на рисунке:
пар 1 –осушка воздуха, 2- сжигание серы, 3- охлаждение газа, 4 –контактирование, 5 –абсорбция оксида серы (6). Фактически сера перед горением плавится и испаряется и сгорает в газовой фазе. Горение серы представляет гомогенную экзотермическую реакцию, которой предшествует процесс перехода твердой серы в жидкое состояние и ее последующее испарение: Sтв → Ѕжидк →Ѕпар. Таким образом, процесс горения протекает в газовой фазе в потоке предварительно высушенного воздуха и описывается уравнением: S + О2 = SО2 – ΔH Для сжигания чистой серы применяют форсуночные и циклонные печи. Перед подачей в печь серу плавят в плавильном котле глухим паром, отфильтровывают от примесей и распыляют сжатым воздухом через форсунку в печи; при этом сера испаряется и сгорает. В форсуночной печи пермешивание серы с воздухом недостаточное, тормозится процесс диффузией и происходит экстенсивно. В циклонной печи благодаря тангенциальному подводу воздуха происходит исключительно сильное пермешивание паров серы с воздухом и интенсивность сгорания увеличивается. Печной газ при сжигании серы отличается более высоким содержанием оксида серы (4) и не содержит значительного количества пыли. При сжигании самородной серы в нем также отсутствуют соединения мышьяка и селена, являющимися каталитическими ядами. Товарные сорта серной кислоты Современная промышленность выпускает несколько сортов серной кислоты и олеума, различающихся концентрацией и чистотой. Чтобы уменьшить возможность кристаллизации продуктов при перевозке и хранении, а также в самом производстве, установлены стандарты на товарные сорта, концентрации которых отвечают эвтектическим составам с наиболее низкими температурами кристаллизации.
Производство карбамида Карбамид (мочевина) среди азотных удобрений занимает второе место по объему производства после аммиачной селитры. Рост производства карбамида обусловлен широкой сферой его применения в сельском хозяйстве. Он обладает большей устойчивостью к выщелачиванию по сравнению с другими азотными удобрениями, т. е. менее подвержен вымыванию из почвы, менее гигроскопичен, может применяться не только как удобрение, но и в качестве добавки к корму крупного рогатого скота. Карбамид, кроме того, широко используется для получения сложных удобрений, удобрений с регулируемым сроком действия, а также для получения пластмасс, клеев, лаков и покрытий. Карбамид CO(NH2)2 — белое кристаллическое вещество, содержащее 46,6% азота. Его получение основано на реакции взаимодействия аммиака с диоксидом углерода: 2NH3 + CO2↔ CO(NH2)2 + H2 O; ΔН = —110.1 кДж (1) Таким образом, сырьем для производства карбамида служат аммиак и диоксид углерода, получаемый в качестве побочного продукта при производстве технологического газа для синтеза аммиака. Поэтому производство карбамида на химических заводах обычно комбинируют с производством аммиака. Реакция (I) — суммарная; она протекает в две стадии. На первой стадии происходит синтез карбамата: 2NH3(г) + CO2(г) ↔ NH2СОО NH4(ж); ΔН =–125,6кДж (2) На второй стадии протекает эндотермический процесс отщепления воды от молекул карбамата, в результате которого и происходит образование карбамида: NH2СООNH4(ж) ↔ CO(NH2)2(ж) + H2 O (ж); ΔН =15,5кДж (3) Реакция образования карбамата аммония — обратимая экзотермическая реакция, протекающая с уменьшением объема. Для смещения равновесия в сторону продукта ее необходимо проводить при повышенном давлении. Для того чтобы процесс протекал с достаточно высокой скоростью, необходимы повышенные температуры. Повышение давления компенсирует отрицательное влияние высоких температур на смещение равновесия реакции в обратную сторону. На практике синтез карбамида проводят при температурах 150—190°С и давлении 15-20 МПа. В этих условиях реакция протекает с высокой скоростью и практически до конца. Разложение карбамата аммония — обратимая эндотермическая реакция, интенсивно протекающая в жидкой фазе. Чтобы в реакторе не происходило кристаллизации твердых продуктов, процесс необходимо вести при температурах не ниже 98°С [эвтектическая точка для системы CO(NH2)2 — NH2COONH4]. Более высокие температуры смещают равновесие реакции вправо и повышают ее скорость. Максимальная степень превращения карбамата в карбамид достигается при 220°С. Для смещения равновесия этой реакции вводят также избыток аммиака, который, связывая реакционную воду, удаляет ее из сферы реакции. Однако добиться полного превращения карбамата в карбамид все же не удается. Реакционная смесь помимо продуктов реакции (карбамида и воды) содержит также карбамат аммония и продукты его разложения — аммиак и СО2. Для полного использования исходного сырья необходимо либо предусмотреть возвращение непрореагировавших аммиака и диоксида углерода, а также углеаммонийных солей (промежуточных продуктов реакции) в колонну синтеза, т. е. создание рецикла, либо отделение карбамида от реакционной смеси и направление оставшихся реагентов на другие производства, например на производство аммиачной селитры, т. е. проведение процесса по открытой схеме. В последнем случае плав, выходящий из колонны синтеза, дросселируют до атмосферного давления; равновесие реакции (2) при температурах 140—150°С практически полностью смещается влево и весь оставшийся карбамат разлагается. В жидкой фазе остается водный раствор карбамида, который упаривают и направляют на грануляцию. Рецикл образовавшихся газообразных аммиака и диоксида углерода в колонну синтеза потребовал бы их сжатия в компрессоре до давления синтеза карбамида. Это сопряжено с техническими трудностями, связанными с возможностью образования карбамата при низких температурах и высоком давлении уже в компрессоре и забивки машин и трубопроводов твердыми частицами. Поэтому в закрытых схемах (схемах с рециркуляцией) обычно применяют только жидкостной рецикл. Существует ряд технологических схем с жидкостным рециклом. К числу наиболее прогрессивных принадлежат так называемые схемы с полным жидкостным рециклом и с применением стриппинг-процесса. Стриппинг (отдувка) заключается в том, что разложение карбамата аммония в плаве после колонны синтеза ведут при давлении, близком к давлению на стадии синтеза, продувкой плава сжатым СО2 или сжатым аммиаком. В этих условиях диссоциация карбамата аммония происходит за счет того, что при продувке плава диоксидом углерода резко снижается парциальное давление аммиака и происходит смещение равновесия реакции (2) влево. Такой процесс отличается использованием теплоты реакции образования карбамата и более низким расходом энергии.
Из верхней части колонны синтеза непрерывно выходят непрореагировавшие газы, поступающие в скруббер высокого давления 2, в котором большая часть их конденсируется за счет водного охлаждения, образуя водный раствор карбамата и углеаммонийных солей. Водный раствор карбамида, выходящий из отдувочной колонны 5, содержит 4-5% карбамата. Для окончательного его разложения раствор дросселируют до давления 0,3-0,6 МПа и затем направляют в верхнюю часть ректификационной колонны 8. Жидкая фаза стекает в колонне вниз по насадке противотоком к парогазовой смеси, поднимающейся снизу вверх; из верхней части колонны выходят NH3, CO2 и водяные пары. Водяные пары конденсируются в конденсаторе низкого давления 7, при этом растворяется основная часть аммиака и диоксида углерода. Полученный раствор направляют в скруббер 2. Окончательная очистка газов, выбрасываемых в атмосферу, производится абсорбционными методами (на схеме не показана). 70%-ный водный раствор карбамида, выходящий из нижней части ректификационной колонны 8, отделяют от парогазовой смеси и направляют после снижения давления до атмосферного сначала на выпарку, а затем на грануляцию. Перед распылением плава в грануляционной башне 12 к нему добавляют кондиционирующие добавки, например мочевиноформальдегидную смолу, чтобы получить неслеживающееся удобрение, не портящееся при хранении.
Принципиальная схема с полным рециклом Аммиак ВОДА

УГЛЕРОДА
РАСХОДНЫЕ КОЭФФИЦИЕНТЫ В ПРОИЗВОДСТВЕ АЗОТНЫХ УДОБРЕНИЙ
Сырье Сырьем для производства калия служит почти исключительно природный минерал сильвинит – смесь сильвина КСl и галита NаСl с содержанием калия 22-25%, считая на К2О. Значительно реже хлорид калия получают из карналлита КСl *МgСl2* 6Н2О, содержащего около 17% К2О. Сульфат калия получают из лангбейнита К2SО4 *2МgSО4, шенита К2SО4 *2МgSО4 *6 Н2О, каинита КСl *МgSО4 *3 Н2О и других минералов. Крупнейшее в мире месторождение калийных солей в РФ находится на Урале (Верхнекамское месторождение). Оно представлено сильвинитовыми и карноллитовыми рудами; происхождение его связано с испарением бассейнов древнего пермского моря. Отличительной особенностью Верхнекамского месторождения является большое содержание газов в порах и пустотах породы (Н2, СО2, СН4, N2). Содержание КСl в добываемом сильвините колеблется от 23 до 30%, NаСl – от 65 до 75%, нерастворимых глинистых веществ от 0.5 до 3.0% Потенциальным источником сырья для производства калийных удобрений может стать Мировой океан, в водах которого концентрация калия достигает 0.07%, что в пересчете на К2О составляет 7*1014 тонн. Сгущенная путем испарения в бассейнах и бессточных водоемах морская вода может явиться источником для промышленного получения солей калия. Таким способом получают, например, хлористый калий из рапы Мертвого моря. Переработку сильвинитовых и карналлитовых руд на хлористый калий осуществляют: a. методами растворения и раздельной кристаллизации, основанной на различии температурных коэффициентов растворимости солевых составляющих руды (эти методы называют еще тепловыми или галлургическими; b. путем механического обогащения породы, главным образом флотацией; c. комбинацией флотационного обогащения с растворением и кристаллизацией мелких фракций руды. Аналогичными приемами перерабатываются и сульфатные породы. В н.в. флотационным методом вырабатывается около 80% всего хлорида калия. Получение хлористого калия Флотационный способ производства Флотационный способ выделения хлорида калия из сильвинита основан на флотогравитационном разделении водорастворимых минералов калийной руды в среде насыщенного ими солевого раствора. Это достигается селективной гидрофобизацией поверхности частиц калийных минералов с помощью флотореагентов-собирателей. Технологические схемы флотационного производства хлорида калия зависят от минералогического и гранулометрического состава флотируемого сильвинита: содержания в нем примесей (глинистых шламов), размеров зерен компонентов и различаются методами обработки глинистых шламов. В общем случае флотационный метод выделения хлорида калия из сильвинита включает следующие операции: d. Измельчение сильвинитовой руды до размеров частиц 1-3 мм с последующим мокрым размолом до размера 0.5 мм. e. Отделение глинистого шлама-тонкодисперсных глинисто-карбонаных примесей методами флотации, гидравлической классификации, или гравитации. f. Флотационное разделение водорастворимых минералов руды (сильвина и галита) в присутствии собирателей (основная флотация). g. Перечистная флотация полученного концентрата для удаления из него оставшихся примесей. h. Обезвоживание концентрата методами сгущения и фильтрования с возвратом в процесс оборотного раствора. i. Сушка влажного концентрата. Процессы мокрого размола и флотации проводят в среде солевых растворов, насыщенных водорастворымыми компонентами руды (сильвин и галит), что исключает их потери при производстве и позволяет организовать замкнутый циклический процесс. В качестве флотоагентов - собирателей на стадии отделения шлама используют реагент ФР-2 (продукт окисления уайт-спирита), на стадии основной флотации – вещества, способствующие гидрофобизации частиц сильвина: солянокислые соли высших (С10 –С22) первичных аминов, а также высокомолекулярные углеводороды. На рисунке представлена технологическая схема выделения хлорида калия из сильвинита с предварительной флотацией глинистого шлама, применяемая для переработки руд с невысоким содержанием нерастворимого остатка (менее 2.5). Для руд с более высоким содержанием его используются схемы с предварительным механическим обесшламиванием или с отделением шлама путем введения депрессора - карбоксиметиллцеллюлозы, способствующего отделению шлама на стадии основной флотации. В качестве реагентов пенной флотации применяют смесь карбоновых кислот. После перечистной флотации требуется сгущать глинистые шламы и подвергать их противоточной промывке, однако трудности, связанные с разрушением пены, образующейся при шламовой флотации, затрудняют проведение этих операций, что приводит к значительным потерям хлористого калия с жидкой фазой. Для повышения степени извлечения калия производят термическую обработку галитовых хвостов, содержащих некоторое количество сильвина. Для этого галитовую пульпу нагревают до 60-700С, при этом твердый КСl растворяется, так как при повышении температуры раствор становится ненасыщенным КСl. Затем хвосты обезвоживают и удаляют в отвал, а маточный раствор охлаждают в вакуум-кристаллизаторах для выделения из него хлористого калия. Флотационный метод эффективен при извлечении хлорида калия из высококачественных сильвинитовых руд, содержащих незначительное количество шлама. Степень извлечения хлорида калия достигает 0.90-0.92 дол. ед., а готовый продукт содержит 93-95% соли. Степень извлечения может быть повышена, если в технологической схеме предусмотрена перечистная флотация отделяемого глинистого шлама для извлечения из него хлорида калия.
Технологическая схема выделения хлорида калия из сильвинита флотационным методом.
шлам
КСl
1-бункер сильвинита, 2-мельница мокрого размола, 3- смеситель-растворитель, 4-сито, 5- флотационная машина шламовой флотации, 6-флотационная машина основной флотации, 7- флотационная машина перечистной флотации, 8-центрифуга для отделения оборотного раствора от концентрата, 9-сборник оборотного раствора, 10-сгуститель шлама, 11- сито для отделения хвостов. Галургический способ производства Галургический способ выделения хлорида калия из сильвинита или метод избирательного растворения и раздельной кристаллизации основан на различии температурных коэффициентов растворимости хлоридов калия и натрия при их совместном присутствии, т.е. в системе «КСl-NаСl –Н2О». В растворах, насыщенных обеими солями, при повышении температуры от 20-25 до 90-1000С содержание хлорида калия возрастает примерно в два раза, а хлорида натрия несколько уменьшается. При охлаждении такого горячего раствора он становится пересыщенным относительно хлорида калия, который будет кристаллизоваться, а хлорид натрия останется в растворе. При последующем нагревании этого раствора он останется насыщенным относительно хлорида натрия и становится ненасыщенным относительно хлорида калия. Растворимость хлоридов калия и натрия при их совместном присутствии (в масс. долях)
Поэтому после обработки подобным раствором нового количества сильвинита из него будет извлекаться только хлорид калия, переходя в раствор, а хлорид натрия растворяться не будет. Это свойство системы «КСl-NаСl–Н2О» и используется в галургическом методе извлечения хлорида калия из сильвинитовой руды дл яорганизации циклического цикла. Процесс галургического производства хлорида калия включает шесть основных стадий: 1) измельчение сильвинитовой руды; 2) выщелачивание хлорида калич из сильвинита горячим оборотным раствором (щелоком); 3) отделение горячего щелока от твердой фазы (хлорида натрия и пустой породы) и его осветление; 4) охлаждение раствора и кристаллизация из него хлорида калия; 5) сушка хлорида калия; 6) нагревание оборотного раствора и возвращение его на стадию выщелачивания сильвинита
Получение сульфата калия. Известны следующие пути получения сульфата калия: 1) переработка галургическими методами – растворением и кристаллизацией полиминеральных сульфатнокалийных руд; 2) конверсионный и ионитный способы на основе взаимодействия хлоритсого калия и различных сульфатных солей; 3) комбинирование флотационного обогащения сульфатнокалийных руд с переработкой концентрата галургическим способом; 4) при происзводстве соляной кислоты из хлористого калия и серной кислоты или сернистого газа; 5) гидротермический метод переработки полиминеральных руд или сульфатных солей и хлоритсого калия с получением вкачестве побочного продукта соляной кислоты; 6) переработка водонерастворимых калийных руд.
Сырье для производства серной кислоты Сырьем в производстве серной кислоты могут быть элементарная сера и различные серусодержащие соединения, из которых могут быть получена сера или непосредственно оксид серы. Природные залежи самородной серы невелики. Чаще всего сера находится в природе в форме сульфидов и сульфатов металлов, а также входит в состав нефти, каменного угля, природного газа. Значительные количества серы содержатся в виде оксида серы в топочных газах и газах цветной металлургии и в виде сероводорода, выделяющегося при очистке горючих газов. Таким образом, сырьевые источники производства серной кислоты достаточно многообразны, хотя до сих пор в качестве сырья используют преимущественно элементарную серу и железный колчедан. Ограниченное использование таких видов сырья, как топочные газы ТЭС и газы медеплавильного производства, объясняется низкой концентрацией в них оксида серы (4). При этом доля колчедана в балансе сырья уменьшается, а доля серы возрастает. В общей схеме сернокислотного производства существенное значение имеют две первые стадии – подготовка сырья и его сжигание или обжиг. Их содержание и аппаратурное оформление существенно зависят от природы сырья, которая в значительной степени, определяет сложность технологического производства серной кислоты. 1. Железный колчедан. Природный железный колчедан представляет сложную породу, состоящую из сульфида железа FеS2, сульфидов других металлов (меди, цинка, свинца и др.), карбонатов металлов и пустой породы. В РФ залежи колчедана имеются на Урале и Кавказе, где его добывают в рудниках в виде рядового колчедана. Процесс подготовки рядового колчедана к производству ставит целью извлечение из него ценных цветных металлов и повышение концентрации дисульфида железа. Чистый пирит содержит 53.5% серы и 46.5% железа. В серном колчедане содержание серы обычно колеблется от 35 до 50%, железа от 30 до 40%, остальное составляют сульфиды цветных металлов, углекислые соли, песок, глина и др. Схема подготовки рядового колчедана представлена на рисунке.
измельчение
классификация
флотация
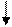  Флотация 2 Флотация 2
сс сушка
На основе материального баланса рассчитываются расходные коэффициенты, определяются размеры аппаратов и устанавливаются оптимальные значения параметров технологического режима процесса. 2. Сера. Элементарная сера может быть получена из серных руд или газов содержащих сероводород или оксид серы. В соответствии с этим различают серу самородную и серу газовую комовую:
На территории РФ залежей самородной серы практически нет. Источником газовой серы являются Астраханское газоконденсатное месторождение, Оренбургское и Самарское месторождения попутного газа. Из самородных руд серу выплавляют в печах, автоклавах или непосредственно в подземных залежах (метод Фраша). Для этого серу расплавляют непосредственно под землей, нагнетая в скважину перегретую воду, и выдавливают расплавленную серу на поверхность сжатым воздухом.
Схема подготовки самородной серы
Получение газовой серы из сероводорода, извлекаемого при очистке горючих и технологических газов, основано на процессе неполного его окисления над твердым катализатором. При этом протекают реакции: Н2S +1.5О2 = SО2 +Н2О 2Н2S +SО2 =2Н2О + 1.5S2
3.Сероводород. Источником сероводорода служат различные горючие газы: коксовый, генераторный, попутный, газы нефтепереработки. Извлекаемый при их очистке газ, содержит до 90% сероводорода и не нуждается в специальной подготовке. Доля сырья в себестоимости продукции сернокислотного производства достаточно велика. Поэтому технико-экономические показатели этого производства существенно зависят от вида используемого сырья. В таблице приведены основные ТЭП производства серной кислоты из различного сырья (за 100% взяты показатели производства на основе железного колчедана).
Замена колчедана серой приводит к снижению капитальных затрат на строительство и улучшению экологической обстановки в результате ликвидации отвалов огарка и уменьшению выбросов токсичных веществ в атмосферу. Вследствие сложностей с транспортом серной кислоты сернокислотные заводы располагаются преимущественно в районах ее потребления. Поэтому производства серной кислоты развито во всех экономических районах РФ. Важнейшими центрами его являются: Щелково, Новомосковск, Воскресенск, Держинск, Березняки, Пермь.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 621; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.142.42 (0.01 с.) |




 серная кислота
серная кислота




 КАРБАМИД
КАРБАМИД
 ДИОКСИД
ДИОКСИД РАСТВОр АММОНИЙНЫХ сОЛЕЙ
РАСТВОр АММОНИЙНЫХ сОЛЕЙ


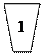
 Сильвинит
Сильвинит





















 вода
вода






 в отвал
в отвал шлам
шлам



 10
10
 хвосты NаСl
хвосты NаСl


 11
11










 флотация 1
флотация 1
 ОБЖИГ
ОБЖИГ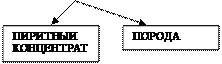





 Газовая сера Н2S газы
Газовая сера Н2S газы  SО2
SО2

 Флотация
Флотация Плавка
Плавка


