
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Производство аммиачной селитрыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Аммиачная селитра, или нитрат аммония, NH4NO3 — кристаллическое вещество белого цвета, содержащее 35% азота в аммонийной и нитратной формах, обе формы азота легко усваиваются растениями. Гранулированную аммиачную селитру применяют в больших масштабах перед посевом и для всех видов подкормок. В меньших масштабах ее используют для производства взрывчатых веществ. Аммиачная селитра хорошо растворяется в воде и обладает большой гигроскопичностью (способностью поглощать влагу из воздуха), что является причиной того, что гранулы удобрения расплываются, теряют свою кристаллическую форму, происходит слеживание удобрений — сыпучий материал превращается в твердую монолитную массу. Для получения практически неслеживающейся аммиачной селитры применяют ряд технологических приемов. Эффективным средством уменьшения скорости поглощения влаги гигроскопичными солями является их гранулирование. Суммарная поверхность однородных гранул меньше поверхности такого же количества мелкокристаллической соли, поэтому гранулированные удобрения медленнее поглощают влагу из воздуха. Иногда аммиачную селитру сплавляют с менее гигроскопичными солями, например с сульфатом аммония. Принципиальная схема производства нитрата аммония
АММИАК
 НИТРАТ АММОНИЯ НИТРАТ АММОНИЯ
В качестве аналогично действующих добавок применяют также фосфаты аммония, хлорид калия, нитрат магния. В основе процесса производства аммиачной селитры лежит гетерогенная реакция взаимодействия газообразного аммиака с раствором азотной кислоты:
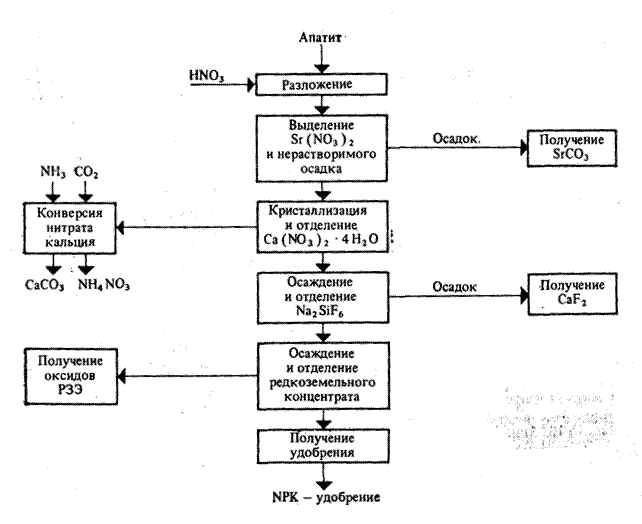
NH3+HNO3 = NH4NO3; ΔН = —144.9кДж Химическая реакция протекает с большой скоростью; в промышленном реакторе она лимитируется растворением газа в жидкости. Для уменьшения диффузионного торможения большое значение имеет перемешивание реагентов. Интенсивные условия проведения процесса в значительной мере могут быть обеспечены при разработке конструкции аппарата. Реакцию нейтрализации проводят в непрерывно действующем аппарате ИТН (использование теплоты нейтрализации) (рис. 15.16). Реактор представляет собой вертикальный цилиндрический аппарат, состоящий из реакционной и сепарационной зон. В реакционной зоне имеется стакан, в нижней части которого расположены отверстия для циркуляции раствора. Несколько выше отверстий внутри стакана размещен барботер 2 для подачи газообразного аммиака, над ним — барботер 3 для подачи азотной кислоты. Реакционная парожидкостная смесь выходит из верхней части реакционного стакана; часть раствора выводится из аппарата ИТН и поступает в донейтрализатор, а остальная часть (циркуляционная) вновь идет вниз. Выделившийся из парожидкостной смеси соковый пар отмывается на колпачковых тарелках 6 от брызг раствора.
Рис. 6. Функциональная схема получения нитроаммофоса на основе азотно-кислотного разложения фосфатов.
Технологический процесс производства аммиачной селитры включает кроме стадии нейтрализации азотной кислоты аммиаком также стадии упаривания раствора селитры, гранулирования плава, охлаждения гранул, обработки гранул поверхностно-активными веществами, упаковки, хранения и погрузки селитры, очистки газовых выбросов и сточных вод.
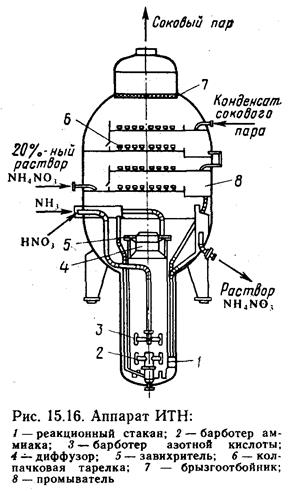
В агрегате установлены два аппарата ИТН, работающие параллельно. Кроме азотной кислоты в них подают газообразный аммиак, предварительно нагретый в подогревателе 2 паровым конденсатом до 120— 130°С. Количества подаваемых азотной кислоты и аммиака регулируют таким образом, чтобы на выходе из аппарата ИТН раствор имел небольшой избыток кислоты (2—5 г/л), обеспечивающий полноту поглощения аммиака.
В нижней части аппарата происходит реакция нейтрализации при температуре 155—170°С; при этом получается концентрированный раствор, содержащий 91—92% NH4NO3. В верхней части аппарата водяные пары (так называемый соковый пар) отмываются от брызг аммиачной селитры и паров азотной кислоты. Часть теплоты сокового пара используется на подогрев азотной кислоты. Затем соковый пар направляют на очистку и выбрасывают в атмосферу. Кислый раствор аммиачной селитры направляют в донейтрализатор 4; куда поступает аммиак, необходимый для взаимодействия с оставшейся азотной кислотой. Затем раствор подают в выпарной аппарат 5. Полученный плав, содержащий 99,7—99,8% селитры, при 175°С проходит фильтр 21 и центробежным погружным насосом 20 подается в напорный бак 6, а затем в прямоугольную металлическую грануляционную башню 16. В верхней части башни расположены грануляторы 7 и 8, в нижнюю часть которых подают воздух, охлаждающий падающие сверху капли селитры. Во время падения капель селитры с высоты 50—55 м при обтекании их потоком воздуха образуются гранулы удобрения. Температура гранул на выходе из башни равна 90—110°С; горячие гранулы охлаждают в аппарате кипящего слоя 15. Это прямоугольный аппарат, имеющий три секции и снабженный решеткой с отверстиями. Под решетку вентиляторами подают воздух; при этом создается псевдоожиженный слой гранул селитры, поступающих по транспортеру из грануляционной башни. Воздух после охлаждения попадает в грануляционную башню. Гранулы аммиачной селитры транспортером 14 подают на обработку поверхностно-активными веществами во вращающийся барабан. Затем готовое удобрение транспортером 12 направляют на упаковку. Воздух, выходящий из грануляционной башни, загрязнен частицами аммиачной селитры, а соковый пар из нейтрализатора и паровоздушная смесь из выпарного аппарата содержат непрореагировавший аммиак и азотную кислоту, а также частицы унесенной аммиачной селитры. Для очистки этих потоков в верхней части грануляционной башни расположены шесть параллельно работающих промывных скрубберов тарельчатого типа 10, орошаемых 20—30%-ным раствором аммиачной селитры, которая подается насосом 18 из сборника 17. Часть этого раствора отводится в нейтрализатор ИТН для промывки сокового пара, а затем подмешивается к раствору селитры, и, следовательно, используется для выработкой продукции. Очищенный воздух отсасывается из грануляционной башни вентилятором 9 и выбрасывается в атмосферу.
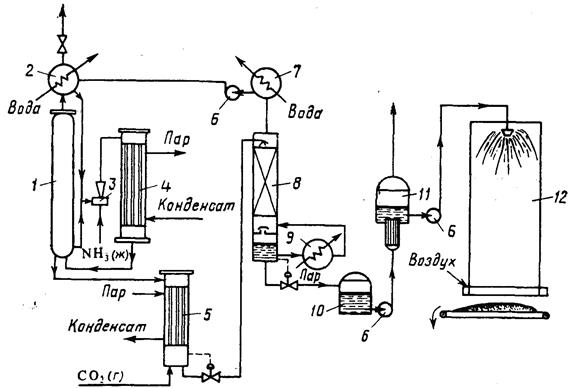
Производство карбамида Карбамид (мочевина) среди азотных удобрений занимает второе место по объему производства после аммиачной селитры. Рост производства карбамида обусловлен широкой сферой его применения в сельском хозяйстве. Он обладает большей устойчивостью к выщелачиванию по сравнению с другими азотными удобрениями, т. е. менее подвержен вымыванию из почвы, менее гигроскопичен, может применяться не только как удобрение, но и в качестве добавки к корму крупного рогатого скота. Карбамид, кроме того, широко используется для получения сложных удобрений, удобрений с регулируемым сроком действия, а также для получения пластмасс, клеев, лаков и покрытий. Карбамид CO(NH2)2 — белое кристаллическое вещество, содержащее 46,6% азота. Его получение основано на реакции взаимодействия аммиака с диоксидом углерода: 2NH3 + CO2↔ CO(NH2)2 + H2 O; ΔН = —110.1 кДж (1) Таким образом, сырьем для производства карбамида служат аммиак и диоксид углерода, получаемый в качестве побочного продукта при производстве технологического газа для синтеза аммиака. Поэтому производство карбамида на химических заводах обычно комбинируют с производством аммиака. Реакция (I) — суммарная; она протекает в две стадии. На первой стадии происходит синтез карбамата: 2NH3(г) + CO2(г) ↔ NH2СОО NH4(ж); ΔН =–125,6кДж (2) На второй стадии протекает эндотермический процесс отщепления воды от молекул карбамата, в результате которого и происходит образование карбамида: NH2СООNH4(ж) ↔ CO(NH2)2(ж) + H2 O (ж); ΔН =15,5кДж (3) Реакция образования карбамата аммония — обратимая экзотермическая реакция, протекающая с уменьшением объема. Для смещения равновесия в сторону продукта ее необходимо проводить при повышенном давлении. Для того чтобы процесс протекал с достаточно высокой скоростью, необходимы повышенные температуры. Повышение давления компенсирует отрицательное влияние высоких температур на смещение равновесия реакции в обратную сторону. На практике синтез карбамида проводят при температурах 150—190°С и давлении 15-20 МПа. В этих условиях реакция протекает с высокой скоростью и практически до конца. Разложение карбамата аммония — обратимая эндотермическая реакция, интенсивно протекающая в жидкой фазе. Чтобы в реакторе не происходило кристаллизации твердых продуктов, процесс необходимо вести при температурах не ниже 98°С [эвтектическая точка для системы CO(NH2)2 — NH2COONH4]. Более высокие температуры смещают равновесие реакции вправо и повышают ее скорость. Максимальная степень превращения карбамата в карбамид достигается при 220°С. Для смещения равновесия этой реакции вводят также избыток аммиака, который, связывая реакционную воду, удаляет ее из сферы реакции. Однако добиться полного превращения карбамата в карбамид все же не удается. Реакционная смесь помимо продуктов реакции (карбамида и воды) содержит также карбамат аммония и продукты его разложения — аммиак и СО2. Для полного использования исходного сырья необходимо либо предусмотреть возвращение непрореагировавших аммиака и диоксида углерода, а также углеаммонийных солей (промежуточных продуктов реакции) в колонну синтеза, т. е. создание рецикла, либо отделение карбамида от реакционной смеси и направление оставшихся реагентов на другие производства, например на производство аммиачной селитры, т. е. проведение процесса по открытой схеме. В последнем случае плав, выходящий из колонны синтеза, дросселируют до атмосферного давления; равновесие реакции (2) при температурах 140—150°С практически полностью смещается влево и весь оставшийся карбамат разлагается. В жидкой фазе остается водный раствор карбамида, который упаривают и направляют на грануляцию. Рецикл образовавшихся газообразных аммиака и диоксида углерода в колонну синтеза потребовал бы их сжатия в компрессоре до давления синтеза карбамида. Это сопряжено с техническими трудностями, связанными с возможностью образования карбамата при низких температурах и высоком давлении уже в компрессоре и забивки машин и трубопроводов твердыми частицами. Поэтому в закрытых схемах (схемах с рециркуляцией) обычно применяют только жидкостной рецикл. Существует ряд технологических схем с жидкостным рециклом. К числу наиболее прогрессивных принадлежат так называемые схемы с полным жидкостным рециклом и с применением стриппинг-процесса. Стриппинг (отдувка) заключается в том, что разложение карбамата аммония в плаве после колонны синтеза ведут при давлении, близком к давлению на стадии синтеза, продувкой плава сжатым СО2 или сжатым аммиаком. В этих условиях диссоциация карбамата аммония происходит за счет того, что при продувке плава диоксидом углерода резко снижается парциальное давление аммиака и происходит смещение равновесия реакции (2) влево. Такой процесс отличается использованием теплоты реакции образования карбамата и более низким расходом энергии.
Из верхней части колонны синтеза непрерывно выходят непрореагировавшие газы, поступающие в скруббер высокого давления 2, в котором большая часть их конденсируется за счет водного охлаждения, образуя водный раствор карбамата и углеаммонийных солей. Водный раствор карбамида, выходящий из отдувочной колонны 5, содержит 4-5% карбамата. Для окончательного его разложения раствор дросселируют до давления 0,3-0,6 МПа и затем направляют в верхнюю часть ректификационной колонны 8. Жидкая фаза стекает в колонне вниз по насадке противотоком к парогазовой смеси, поднимающейся снизу вверх; из верхней части колонны выходят NH3, CO2 и водяные пары. Водяные пары конденсируются в конденсаторе низкого давления 7, при этом растворяется основная часть аммиака и диоксида углерода. Полученный раствор направляют в скруббер 2. Окончательная очистка газов, выбрасываемых в атмосферу, производится абсорбционными методами (на схеме не показана). 70%-ный водный раствор карбамида, выходящий из нижней части ректификационной колонны 8, отделяют от парогазовой смеси и направляют после снижения давления до атмосферного сначала на выпарку, а затем на грануляцию. Перед распылением плава в грануляционной башне 12 к нему добавляют кондиционирующие добавки, например мочевиноформальдегидную смолу, чтобы получить неслеживающееся удобрение, не портящееся при хранении.
Принципиальная схема с полным рециклом Аммиак ВОДА

УГЛЕРОДА
РАСХОДНЫЕ КОЭФФИЦИЕНТЫ В ПРОИЗВОДСТВЕ АЗОТНЫХ УДОБРЕНИЙ
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 1503; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.12.133 (0.008 с.) |

 АЗОТНАЯ КИСЛОТА
АЗОТНАЯ КИСЛОТА

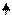 Q ПАР Q
Q ПАР Q




 На рис. 15.17 приведена схема современного крупнотоннажного агрегата по производству аммиачной селитры АС-72 мощностью 1360 т/сут. Исходная 58—60 %-ная азотная кислота подогревается в подогревателе до 70—80°С соковым паром из аппарата ИТН 3 и подается на нейтрализацию. Перед аппаратами 3 к азотной кислоте добавляют фосфорную и серную кислоты в таких количествах, чтобы в готовом продукте содержалась 0,3—0,5% Р2О5 и 0,05—0,2% сульфата аммония.
На рис. 15.17 приведена схема современного крупнотоннажного агрегата по производству аммиачной селитры АС-72 мощностью 1360 т/сут. Исходная 58—60 %-ная азотная кислота подогревается в подогревателе до 70—80°С соковым паром из аппарата ИТН 3 и подается на нейтрализацию. Перед аппаратами 3 к азотной кислоте добавляют фосфорную и серную кислоты в таких количествах, чтобы в готовом продукте содержалась 0,3—0,5% Р2О5 и 0,05—0,2% сульфата аммония.




 КАРБАМИД
КАРБАМИД
 ДИОКСИД
ДИОКСИД РАСТВОр АММОНИЙНЫХ сОЛЕЙ
РАСТВОр АММОНИЙНЫХ сОЛЕЙ


