
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика топливаСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
НОВОТРОИЦКИЙ ФИЛИАЛ
Кафедра металлургических технологий и оборудования
Расчет горения топлива
Методические указания для выполнения домашних заданий и контрольных работ по дисциплинам «Теплотехника», «Металлургическая теплотехника» для студентов направлений подготовки 18.03.01 «Химическая технология», 15.03.02 «Технологические машины и оборудование», 22.03.02 «Металлургия» всех форм обучения
Новотроицк, 2015
Куницина Н.Г.Расчет горения топлива: Методические указания для выполнения домашних заданий и контрольных работ по дисциплинам «Теплотехника», «Металлургическая теплотехника» для студентов направлений подготовки 18.03.01 «Химическкая технология», 15.03.02 «Технологические машины и оборудование», 22.03.02 «Металлургия» всех форм обучения. - Новотроицк: НФ НИТУ «МИСиС», 2015 – 31 с.
Методические указания предназначены для закрепления знаний по основам процессов горения различных видов топлива в металлургических агрегатах. Рассмотрены краткая характеристика различных видов топлива, методика расчета процессов горения топлива, приведены примеры рассчетов процессов горения различных видов топлива.
© Новотроицкий филиал ФГАОУ ВПО «Национальный исследовательский технологический университет «МИСиС», 2015.
Содержание
Введение……………………………………………………………………………...4 1 Общая характеристика топлива…………………………………………………..5 1.1 Классификация топлива…………………………………………………………5 1.2 Химический состав топлива…………………………………………………….5 2 Основы теории горения…………………………………………………………...7 2.1 Общая характеристика процессов горения топлива…………………………..7 2. 2 Возникновение пламени………………………………………………………..8 2.3 Горение газообразного топлива……………………………………………….10 2.4 Горение жидкого топлива……………………………………………………...11 2.5 Горение твердого топлива……………………………………………………..11 3 Методика расчета горения топлива……………………………………………..13 3.1 Определение расхода воздуха…………………………………………………13 3.2 Определение количества и состава продуктов сгорания…………………….13 3.3 Определение температуры горения…………………………………………...15
3.4 основные формулы для расчета горения топлива……………………………16 4 Примеры расчетов горения топлива…………………………………………….18 Приложение А………………………………………………………………………25 Приложение Б………………………………………………………………………30 Приложение В………………………………………………………………………31
Введение
Расчеты горения топлива обычно выполняются с целью определения: 1. расхода воздуха, необходимого для горения; 2. количества и состава продуктов сгорания; 3. температуры горения топлива. Исходными данными для расчета являются вид топлива, конструкция сожигательного устройства, определяющая величину коэффициента расхода воздуха n и температуры подогрева топлива и воздуха. Правильность расчета может быть проверена составлением материального баланса, составляемого в единицах массы. Расчеты горения топлива всегда выполняются в начале полного расчета печи, так как позволяют определить одну из наиболее важных величин – температуру горения топлива, которая в значительной мере определяет температурный режим работы печи. Однако значение расчетов горения топлива этим не ограничивается. Расчет горнеия топлива совместно с расчетом теплового баланса печи позволяет определить полное количество отходящих из печи продуктов сгорания, без чего невозможно выполнить расчет таких важных элементов печи как рекуператоры, борова, дымовые трубы.
Общая характеристика топлива
Топливо – это вещества органического происхождения, которые при нагревании в присутствии кислорода интенсивно окисляются с выделением значительного количества тепла.
Классификация топлива
В основном топливо классифицируют по его происхождению и агрегатному состоянию. Топливо всех видов подразделяют на естественное и искусственное, каждое из которых в свою очередь может быть твердым, жидким или газообразным (таблица 1).
Таблица 1 - Общая классификация топлива
Химический состав топлива
Количество выделяемого при горении тепла в значительной степени зависят от химического состава топлива.Так как топливо органического происхождения, то основными его составляющими являются углерод и водород. Углерод и водород находятся в топливе в виде различных соединений. В состав топлива обычно входят кислород, азот и сера также в виде различных соединений. Кроме того, в топливе всегда присутствуют вода и зола. Чтобы установить состав топлива, проводят его химический анализ. При химическом анализе твердого или жидкого топлива производится определение элементарного состава (содержания С, Н, О, N, S) а также негорючей части топлива – золы А и влаги W. В соответствии с элементарным анализом в топливе различают: органическую массу, в состав которой входят элементы С, Н, О, N; горючую массу - С, Н, О, N, S; сухую массу - С, Н, О, N, S, А; рабочую массу - С, Н, О, N, S, А, W. Пересчет состава из одной массы на другую выполняется по следующим выражениям, %:
ХО=ХГ ХО=ХС ХО=ХР ХГ=ХС ХГ=ХР ХС=ХР
где ХР, ХС, ХГ, ХО – содержание какого-либо элемента соответственно в рабочей, сухой, горючей и органической массе.
Основы теории горения
Возникновение пламени
Возникновение пламени (воспламенение топлива) может произойти только после того, как будет достигнут необходимый контакт молекул топлива и окислителя. Любая реакция окисления протекает с выделением тепла. Вначале реакция окисления идет медленно с выделением малого количества тепла. Однако выделяющееся тепло способствует повышению температуры и ускорению реакции, что в свою очередь приводит к более энергичному выделению тепла, которое опять–таки оказывает благоприятное влияние на развитие реакции. Таким образом, происходит постепенное нарастание скорости реакции до момента воспламенения, после чего реакция идет с очень большой скоростью и носит лавинный характер. В реакциях окисления неразрывно связаны друг с другом механизм химической реакции и тепловые характеристики процесса окисления. Первичным фактором является химическая реакция и вторичным – выделение тепла. Оба эти явления тесно связаны между собой и влияют друг на друга. В практических условиях обычно прибегают к искусственному поджиганию топлива, вводя в зону горения определенное количество тепла, что приводит к резкому ускорению момента достижения воспламенения. В большинстве случаев выделение тепла при горении сопровождается потерями тепла в окружающую среду. Соотношения между выделяемым количеством тепла и теплом, передаваемым в окружающую среду, имеет большое значение для развития процесса воспламенения топлива. При стационарном состоянии процесса количество выделяющегося в единицу времени тепла должно быть равно количеству теряемого тепла. По мере окисления топлива значение температуры будет возрастать. И температура достигнет своего наибольшего значения, когда тепловыделение еще равно теплоотдаче. При дальнейшем увеличении тепловыделения начинается переход к резкому нестационарному выгоранию смеси, проходящему с бурным нарастанием температуры и скорости реакции, т. е. происходит тепловой взрыв.
Температура, при которой начинается нестационарный процесс выгорания смеси, называется температурой воспламенения. Таким образом, температура воспламенения не является физико-химической константой, определяемой только свойствами смеси, она определяется условиями протекания процесса, т. е. характером теплообмена с окружающей средой (температурой, формой сосуда и др.). Температуры воспламенения различных топлив приведены в таблице 2.
Таблица 2 – Температуры воспламенения в воздухе при атмосферном давлении
Кроме температуры, большое влияние на процесс зажигания топлива оказывает концентрация горючей составляющей в смеси. Существуют такие минимальная и максимальная концентрации горючей составляющей, ниже и выше которых вынужденное воспламенение произойти не может. Такие предельные концентрации называются концентрационными пределами воспламенения, значения их для некоторых газов приведены в таблице 3. Чтобы установить пределы воспламенения промышленных газов, которые являются смесью различных горючих компонентов, пользуются правилом Ле-Шателье, по которому
где Z - искомый нижний или верхний предел воспламенения, Z1, Z2, Z3 - соответствующие пределы воспламенения для горючих компонентов топлива, P1, P2, P3 – процентное содержание отдельных горючих компонентов в топливе.
Таблица 3 – Концентрационные пределы воспламенения, %
Негорючие составляющие газообразного топлива влияют на границы воспламенения, они повышают нижний и понижают верхний пределы воспламенения. Горение жидкого топлива
В условиях промышленных печей жидкое топливо сжигают в распыленном состоянии. Процесс горения жидкого топлива складывается из следующих стадий: · распыливание, · воспламенение, которому предшествует и способствует процесс смешения, подогрева и испарения,
· горение капли жидкого топлива. Процесс распыливания топлива основан на дроблении жидкости распылителем. Дробление будет происходит в том случае, если давление движущегося распылителя будет превышать действие поверхностного натяжения. Воспламенение жидкого топлива происходит так: жидкое топливо, попав в среду с высокой температурой, начинает испаряться. Около поверхности капли образуется паро – воздушная смесь, которая воспламеняется первой. Температура, при которой происходит воспламенение паро – воздушной смеси, называется температурой вспышки топлива. Обычно температура кипения жидкого топлива ниже температуры воспламенения. Горение капли. Все процессы, из которых складывается горение топлива, совершаются или на поверхности, или около поверхности капли. Температура кипения жидких топлив всегда ниже температуры воспламенения, поэтому горение жидкого в основном происходит в паровой фазе. Процессы горения паро – воздушной смеси и испарения тесно связаны между собой. При горении жидкого топлива осуществляется теплообмен между газовой средой и поверхностью жидкости, т. е. между средами, находящимися в разных агрегатных состояниях, что придает всему процессу гетерогенный характер Общее время горения капли находят из анализа изменения размеров капли в связи с процессами тепло – и массопереноса. Оно прямо пропорционально плотности, размеру капли и скрытой теплоте капли и обратно пропорционально теплопроводности капли, а также перепаду температур между газовой средой и поверхностью капли.
Горение твердого топлива
Горение твердого топлива относится к гетерогенному. Процесс горения твердого топлива складывается из следующих стадий: · подогрев и подсушка топлива, · процесс пирогенного разложения топлива с выделением летучих и образованием коксового остатка, · горение летучих, · горение коксового остатка. Процесс выделения летучих, т. е. горючей смеси различных газообразных составляющих – Н2, СО, СН4, СmHn и др., протекает при подогреве топлива до 200 ˚С и выше. Температура начала выделения летучих зависит от возраста угля. Чем "старше" уголь, чем выше в нем содержание углерода, тем при более высокой температуре начинается процесс выделения летучих. Летучие в процессе горения твердого топлива играют важную роль, которая различна при горении кускового топлива и угольной пыли. При горении кускового топлива летучие выделяются при сравнительно умеренных температурах, смешиваются с воздухом и воспламеняются первыми. Таким образом, горением летучих начинается процесс горения всего топлива. Тепло, выделяемое при горении летучих, способствует повышению температуры и дальнейшему развитию процесса горения. Горение углерода начинается уже после завершения выхода летучих. Процесс горения самого углерода продолжителен и он определяет время протекания всего процесса. При сжигании угольной пыли в связи с огромной суммарной поверхностью угольных частиц основная масса летучих не успевает выделиться до момента воспламенения частиц, поэтому летучие сгорают вместе с углеродом.
Определение расхода воздуха Расход воздуха можно определять в объемных единицах и в единицах массы. В объемных единицах рассчитывают газообразное топливо, в единицах массы – жидкое и твердое топливо. В качестве примера рассмотрим горение топлива, состоящего из 98 % СН4 и 2 % N2. СН4 + 2 О2 = СО2 + 2 Н2О, из которой следует, что для сжигания 1 кмоль СН4 требуется 2 кмоль О2. но объем 1 кмоль любого газа одинаков для всех газов и при нормальных условиях равен 22,4 м3, следовательно для сжигания 1 м3 СН4 требуется 2 м3 О2. В рассматриваемом примере в 1 м3 газа содержится 0,98 м3 СН4, для сжигания которого потребуется 0,98 ∙ 2 = 1,96 м3 О2. В сухом воздухе доля кислорода по объему составляет 21 %, а остальные 79 % приходится практически полностью на азот. Значит, количество азота в воздухе в 79/21=3,76 раза больше количества кислорода. Поэтому расход воздуха для сжигания 1 м3 газа указанного состава будет равен 1,96 + 1,96 ∙ 3,76=1,96 + 7,38 = 9,34 м3. При горении топлива полученные на основе химических реакций количества кислорода и воздуха представляют те наименьшие количества, которые необходимы для полного окисления единицы горючего вещества. Такое наименьшее необходимое количество воздуха называют теоретическим. на прктике для более полного сжигания требуется подавать количество воздуха, несколько превышающее теоретическое. Величина показывающая отношение действительного расхода воздуха к теоретическому расходу называют коэффициентом расхода воздуха: Изменение величины коэффициента расхода воздуха влечет за собой изменение количества воздуха, подаваемого для горения. Так, для рассмотренного выше примера горения газа при n=1,2 потребуется 1,96 ∙ 1,2 = 2,35 м3 О2 и 2,35 + 2,35 ∙ 3,76 = 11,19 м3 воздуха.
Примеры расчетов горения топлива
Для расчета горения топлива можно использовать два метода: -табличный; -расчетный. В рассмотренных ниже примерах будем использовать оба метода.
Пример 1. Определить расход воздуха, состав и количество продуктов сгорания и калориметрическую температуру горения мазута. Его состав следующий, %: CР=85,6, НР=10,5, NР=0,7, ОР=0,5, SР=0,7, АР=0, WР=2. Провести расчет при величине коэффициента избытка воздуха n=1,15. Температура подогрева воздуха tВ=300 ˚ С. Решение: Расход воздуха, состав и количество продуктов сгорания определим, пользуясь табличным методом. Для удобства расчет горения жидкого топлива следует вести на 100 кг горючего. В основу расчета положены реакции полного сгорания отдельных элементов:
С + О2 = СО2
Н2 + ½ О2 = Н2О
S + О2 = SО2
Таблица 5 – Форма таблицы для записи результатов определения расхода воздуха, количества и состава продуктов сгорания
Для определения калориметрической температуры необходимо знать теплоту сгорания топлива. Для жидкого топлива ее можно определить по формуле Д. И. Менделеева (см. табл. 3).
Определим энтальпию продуктов сгорания при условии, что воздух подогрет до 300 ˚ С: I0= Задаемся возможной температурой горения tК = 1800˚ С. Для этой температуры энтальпия продуктов сгорания (см. приложение 3) будет равна: СО2 + SО2......... (0,1268+0,00039) ∙ 4360,67=553,81 Н2О....................... 0,0954 ∙ 3429,9=327,21 О2.........................0,2609 ∙ 2800,48=730,65 N2.........................0,7514 ∙ 2646,74=1988,76 –––––––––––––––––––––––––––––––––––––––––––––––– Итого.................................... 3600,43 кДж/м3
Поскольку I0<I1800 ˚ С, то действительная калориметрическая температура будет ниже 1800 ˚ С. Примем tК = 1700 ˚ С, тогда энтальпия составит СО2 + SО2......... (0,1268+0,00039) ∙ 4087,1=519,06 Н2О....................... 0,0954 ∙ 3203,05=305,57 О2.........................0,2609 ∙ 2632,09=686,71 N2.........................0,7514 ∙ 2486,28=1868,19 –––––––––––––––––––––––––––––––––––––––––––––––– Итого.................................... 3380,05 кДж/м3
Поскольку I1800 ˚ С<I0, действительная калориметрическая температура лежит в пределах 1700 – 1800 ˚ С. Калориметрическую температуру горения определяют интерполяцией: tК=1700 +
Пример 2. Для случая сжигания смешанного газа (смеси коксовального и природного газов) с теплотой сгорания 12 МДж/м3 определить расход воздуха, состав и количество продуктов сгорания, калориметрическую температуру горения при коэффициенте расхода (избытка) воздуха n=1,2. Температура подогрева, воздуха 400 ˚ С. Составить материальный баланс процесса горения. Состав генераторного газа из тощих топлив (топливо А), %: СО2=6, СО=27, Н2=13, СН4=0,6, N2=53,4. Влажность топлива А WА=24 г/м3. Состав природного Бугурусланского газа (топливо Б), %: СН4=77,8, С2Н6=4,4, С3Н8=1,7, С4Н10=0,8, СО2=0,2, Н2S=1, N2=14. Влажность топлива Б WБ=4,5 г/м3. Решение: 1) Производим пересчет с сухой массы на влажную:
Расчёт для газа А:
5,83 + 26,22 + 12,62 + 51,85 + 0,58 + 2,89 = 99,99
Расчёт для газа Б:
0,20 + 77,38 + 1,69 + 0,80 + 13,92 + 0,99 + 4,38 + 0,56 = 99,92
2) Определим теплоту сгорания каждого газа: Qрн = 127 СО + 108 Н2 + 358 СН4 + 590 С2Н4 + 555 С2Н2 + 635 С2Н6 + 913 С3Н8 +1185 С4Н10 + 1465 С5Н12 + 234 Н2S Qрн (А) = 127 · 26, 22 + 108 · 12, 62 + 358 · 0, 58 = 4900, 54 кДж/м3 Qрн (Б) = 358 · 77,38 + 635 · 4,38 + 913 ·1,69 + 1185 · 0,8 + 234 · 0,99 = =33205,97 кДж/м3 3) Определим состав смеси 2-х топлив: Для этого прежде всего определим долю топлива А в смеси, которую обозначим через а:
ХСМ=ХАа+ХБ(1-а) СО2см = СО2А а + СО2Б (1-а) = 5,83 · 0,75 + 0,20 · 0,25 = 4,42 % СОсм = 26,22 · 0,75 = 19,67 % Н2см = 12,62 · 0,75 = 9,47 % СН4см =0,58 · 0,75 + 77,38 · 0,25 = 19,78 % N2cм = 51, 85 · 0, 75 + 13, 92 · 0, 25 = 42, 38 % С3Н8см =1,69 · 0,25 = 0,42 % С4Н10см =0,8 · 0,25 = 0,20 % С2Н6см = 4,43 · 0,25 = 1,1 % Н2Sсм = 0.99 · 0,25 = 0,25 % Н2Осм = 2,89 · 0,75 + 0,56 · 0,25 = 2,31 % 4,42 + 19,67 + 9,47 + 19,78 + 42,38 + 0,42 + 0,20 + 0,25 + 1,1 + 2,31 = 99,99 4) Определим расход воздуха, состав и количество продуктов сгорания в табличной форме. Расчет ведём на 100 м3 газа.
5) Для проверки правильности расчета составим материальный баланс. Расчет является верным, если погрешность не превышает 0,5%.
Поступило, кг: Получено, кг: В том числе: Топливо СО2 =4,42 · 1,96 = 8,66 СО2 = 48.13 1.96 = 94.33 СО = 19,67 · 1,25 = 24,59 Н2О = 57.56 0.8 = 46.05 Н2 = 9,47 · 0,09 = 0,85 О2 = 21.18 1.43 = 30.29 СН4 = 19,78 ·0,71 = 14,04 N2 = 328.3 1.25 = 410.38 N2 = 42, 38 · 1, 25 = 52, 98 SO2 = 0.25 2.86 = 0.72 C3Н8 = 0, 42 · 1, 96 = 0, 82 –––––––––––––––––––––– C4Н10 = 0, 2 · 2, 59 = 0, 52 Итого 581,76 Н2S = 0,25 ·1,52 = 0,38 C2Н6 = 1, 1 · 1, 34 = 1, 47 Н2О = 2,31 · 0,8 = 1,85
Воздух О2 = 74,1 · 1,43 = 105,96 N2 = 277, 44 · 1, 25 = 346, 80 ––––––––––––––––––––––––– Итого 580,90
Погрешность Из таблицы следует, что для сжигания 100 м3 необходимо затратить 351,54 м3 воздуха, при данной величине коэффициента избытка воздуха, равной 1,2. При этом образуется продуктов сгорания 455,42 м3. 6) Определим калориметрическую температуру горения: Для этого необходимо найти начальную энтальпию (теплосодержание) 1м3 продуктов сгорания:
I = Io + Iв + Iг
где Io, Iв, Iг – соответственно количества тепла, получаемые от сжигания топлива и вносимые подогретым воздухом и газом.
Таким образом, количества тепла, получаемое от сжигания топлива в расчёте на единицу объёма продуктов сгорания, будет равно
Количества тепла, вносимое подогретым воздухом, может быть определено следующим образом:
где св – теплоемкость воздуха при 400оС
Таким образом, энтальпия продуктов сгорания составит
Задаемся возможной температурой горения tК = 1800˚ С. Для этой температуры энтальпия продуктов сгорания (см. приложение 3) будет равна: СО2 + SО2......... (0,106+0,0006) ∙ 4360,67=464,847 Н2О....................... 0,1264 ∙ 3429,9=433,539 О2.........................0,0465 ∙ 2800,48=130,222 N2.........................0,721 ∙ 2646,74=1908,3 –––––––––––––––––––––––––––––––––––––––––––––––– Итого.................................... 2936,908 кДж/м3 Поскольку I0>I1800 ˚ С, то действительная калориметрическая температура будет выше 1800 ˚ С. Примем tК = 1900 ˚ С, тогда энтальпия составит СО2 + SО2......... (0,106+0,0006) ∙ 4634,76 = 489,89 Н2О....................... 0,1264∙ 3657,85 = 462,35 О2.........................0,0465 ∙ 2971,30 = 138,17 N2.........................0,721 ∙ 2808,22 = 2024,33 –––––––––––––––––––––––––––––––––––––––––––––––– Итого.................................... 3114,74 кДж/м3
Поскольку I1900 ˚ С>I0, действительная калориметрическая температура лежит в пределах 1800 – 1900 ˚ С. Калориметрическую температуру горения определяют интерполяцией: tК=1800 +
Приложение А Варианты заданий
|

 ;
; ;
; ;
; ;
; ;
; ,
,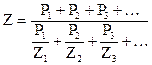 ,
, .
.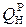 =339 ∙ 85,6 + 1030 ∙ 10,5 – 109 (0,5 – 0,7) – 25 ∙ 2 = 39805,2 кДж/кг
=339 ∙ 85,6 + 1030 ∙ 10,5 – 109 (0,5 – 0,7) – 25 ∙ 2 = 39805,2 кДж/кг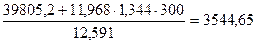 кДж/м3
кДж/м3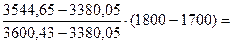 1775 ˚ С.
1775 ˚ С. ;
;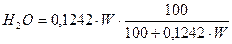 .
.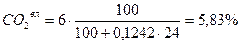

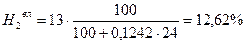
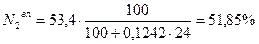
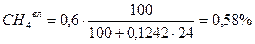
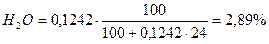
 100.
100.


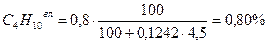
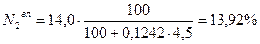
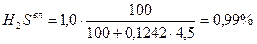
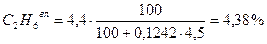
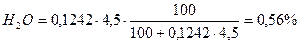




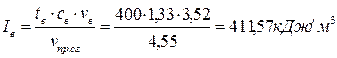
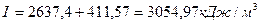
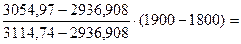 1867 ˚ С.
1867 ˚ С.


