Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация проводниковых материаловСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Содержание Введение.............................................................................................................4 КЛАССИФИКИЦИЯ ПРОВОДНИКОВЫХ МАТЕРИАЛОВ......................5 СВОЙСТВА ПРОВОДНИКОВ........................................................................7 Электропроводность металлов.........................................................................7 Теплопроводность...........................................................................................10 Проводники в различных агрегатных состояниях.......................................11 БАЗОВЫЕ ПРОВОДНИКОВЫЕ МАТЕРИАЛЫ.........................................13 Материалы с высокой электропроводностью...............................................13 Благородные металлы……………………………………………………….19 Тугоплавкие металлы......................................................................................21 Металлы с выраженными магнитными свойствами....................................22 СПЛАВЫ МЕТАЛЛОВ..................................................................................26 ПРИМЕНЕНИЕ ПРОВОДНИКОВЫХ МАТЕРИАЛОВ В КАБЕЛЬНОЙ ПРОДУКЦИИ............................................................................................................28 Классификация кабельной продукции..........................................................28 Материалы для токопроводящих жил...........................................................32 Ряды сечений токопроводящих жил..............................................................32 Круглые медные и алюминиевые жилы кабелей и проводов с резиновой и пластмассовой изоляцией.........................................................................................33 Электрические и магнитные экраны в кабелях и проводах........................34 Скрутка изолированных жил..........................................................................37 Оболочки кабелей............................................................................................42 Заключение.......................................................................................................45 Библиографический список............................................................................46 Приложение 1..................................................................................................47 Приложение 2..................................................................................................48
Введение Проводниковые материалы применяются во многих областях электротехники. Проводимые исследования в области электротехнических материалов позволяют получить материалы с необходимыми для каждого конкретного случая свойствами и характеристиками. При разработке учитываются перепады температуры, воздействие агрессивной среды, ионизирующее излучение, действие магнитных полей и другие воздействия, которым могут подвергаться электротехнические материалы при их эксплуатации. Для правильного использования проводниковых материалов необходимо знать сущность процессов, происходящих в каждом конкретном проводнике при воздействии на него электрического и магнитного полей, а также основных физико-технологических факторов. Широкое применение проводники нашли в электронной технике, при производстве электроаппаратов и электроустановок. Проводниковые материалы применяют чаще в виде проводов, возможно использование в виде полос, колец и других изделий разнообразных форм в разных отраслях промышленности, строительстве и на транспорте.
Свойства проводников Электропроводность металлов Металл – это пластичное вещество с характерным блеском, хорошо проводящее электрический ток и тепло. Все свойства металлов объясняются их строением: атомы металла ионизированы, а отделившиеся от них валентные электроны свободны, т.е. принадлежат всему кристаллу. Ионы, расположенные строго упорядочено, образуют правильную кристаллическую решетку. Электропроводность – это способность вещества проводить под действием не изменяющегося во времени электрического поля не изменяющийся электрический ток. Электрический ток в металлах – это упорядоченное движение электронов под действием электрического поля. Опыты показывают, что при протекании тока по металлическому проводнику не происходит переноса вещества, следовательно, ионы металла не принимают участия в переносе электрического заряда. В этих опытах электрический ток пропускали в течении года через три прижатых друг к другу, хорошо отшлифованных цилиндра - медный, алюминиевый и снова медный (рис. 1). Общий заряд, прошедший за это время через цилиндры, был очень велик (около 3,5∙106 Кл). После окончания было установлено, что имеются лишь незначительные следы взаимного проникновения металлов, которые не превышают результатов обычной диффузии атомов в твёрдых телах. Измерения, проведённые с высокой степенью точности, показали, что масса каждого из цилиндров осталась неизменной. Поскольку массы атомов меди и алюминия существенно отличаются друг от друга, то масса цилиндров должна была бы заметно измениться, если бы носителями заряда были ионы. Следовательно, свободными носителями заряда в металлах являются не ионы. Огромный заряд, который прошёл через цилиндры, был перенесён, очевидно, такими частицами, которые одинаковы и в меди, и в алюминии. Как известно, такие частицы входят в состав атомов всех веществ - это электроны. Естественно предположить, что ток в металлах осуществляют именно свободные электроны.
Рис. 1. Опыт Т. Стюарта и Р. Толмена Катушка с большим числом витков тонкой проволоки приводилась в быстрое вращение вокруг своей оси. Концы катушки с помощью гибких проводов были присоединены к чувствительному баллистическому гальванометру. Раскрученная катушка резко тормозилась, и в цепи возникал кратковременных ток, обусловленный инерцией носителей заряда. Полный заряд, протекающий по цепи, измерялся по отбросу стрелки гальванометра. Т.Стюарт и Р.Толмен определили экспериментально удельный заряд частиц. Он оказался равным
В начале XX века немецкий физик П. Друде и голландский физик Х. Лоренц создали классическую теорию электропроводности металлов. Её основные положения: 1. Хорошая проводимость металлов объясняется наличием в них большого числа электронов. 2. Под действием внешнего электрического поля на беспорядочное движение электронов накладывается упорядоченное движение, т.е. возникает ток. 3. Сила электрического тока I, идущего по металлическому проводнику (рис. 2), равна
где e – заряд электрона, n – количество электронов, S - площадь поперечного сечения проводника,
Рис. 2. Протекание тока в металлическом проводнике 4. Так как внутреннее строение у разных веществ различное, то и сопротивление тоже будет различным. 5. При увеличении хаотического движения частиц вещества происходит нагревание тела, т.е. выделение тепла. Закон Джоуля-Ленца:
6. У всех металлов с увеличением температуры растет и сопротивление:
где α ‒ температурный коэффициент; R 0 – базовое сопротивление металлического проводника; R – сопротивление проводника при температуре t. Величины α и R 0 являются справочными для проводникового материала. Количественно электропроводность описывается законом Ома j=σE, где σ - удельная электропроводность [См/м]; j ‒ плотность тока [А/м2]; E – напряженность электрического поля [B/м]. Единицей измерения электропроводности является Сименс (См) – величина, обратная Ому. Удельное электрическое сопротивление проводника – величина, обратная удельной электропроводности
Сопротивление проводника длиной l площадью сечения S рассчитывается по формуле
Для проводников ρ составляет от 0,016 (у серебра) до 10-6 Ом∙м для Fe-Cr-Ni сплавов. Теплопроводность Теплопроводность – это способность вещества проводить тепловой поток постоянной величины под действием не изменяющейся разности температур. Количественно она описывается законом Фурье W= æD T, где W – плотность теплового потока; D T - разность температур на единичном участке длины проводника; æ - удельная теплопроводность. Для металлов типичны: - низкая величина удельного сопротивления при комнатной температуре (от сотых долей до единиц мкОм∙м); - значительный рост сопротивления при повышении температуры, приблизительно прямо пропорционально росту температуры; - при снижении до T»0о K наступает сверхпроводимость; - отношение æ/σ приблизительно одинаково для различных металлов при одинаковой температуре. Концентрация свободных электронов в металлическом проводнике при повышении температуры остается практически неизменной. Но поскольку колебания узлов кристаллической решетки усиливаются, появляется больше препятствий на пути движения электронов, поэтому проводимость уменьшается (удельное сопротивление увеличивается). Следовательно, температурный коэффициент удельного сопротивления α равен:
За передачу теплоты через металл в основном ответственны свободные электроны, так как их число в единице объема металла весьма велико, то и теплопроводность проводников намного больше, чем теплопроводность диэлектриков. Очевидно, что при прочих равных условиях, чем больше удельная электрическая проводимость у металла, тем больше его коэффициент теплопроводности. Медь Общие сведения Медь (лат. Cuprum) ‒ один из семи металлов, известных с глубокой древности. По некоторым археологическим данным ‒ медь была хорошо известна египтянам еще за 4000 лет до Рождества Христова. Знакомство человечества с медью относится к более ранней эпохе, чем с железом; это объясняется с одной стороны более частым нахождением меди в свободном состоянии на поверхности земли, а с другой ‒ сравнительной легкостью получения ее из соединений. Древняя Греция и Рим получали медь с острова Кипра (Cyprum), откуда и название ее Cuprum. Особенно важна медь для электротехники. По электропроводности медь занимает второе место среди всех металлов, после серебра. Однако в наши дни во всем мире электрические провода, на которые раньше уходила почти половина выплавляемой меди, все чаще делают из алюминия. Сравнительная характеристика основных свойств меди и алюминия приведена в таблице 2. Алюминий хуже проводит ток, но легче и доступнее. Медь же, как и многие другие цветные металлы, становится все дефицитнее. Если в XIX в. медь добывалась из руд, где содержалось 6-9% этого элемента, то сейчас пятипроцентные медные руды считаются очень богатыми, а промышленность многих стран перерабатывает руды, в которых всего 0,5% меди. Таблица 2 Свойства меди и алюминия
Свойства меди Медь - химический элемент I группы периодической системы Менделеева (приложение 1) с основными характеристиками: - атомный номер 29; - природная медь состоит из двух нечетных изотопов 63Cu (69,09%) и 65Cu (30,91%); - в соединениях медь проявляет валентность: +1 (глубинные соединения, первичные сульфиды и минерал куприт - Cu2O); +2 (все остальные минералы, около сотни); известны также немногочисленные соединения трехвалентной меди (искусственный окисел Cu2O3). В сухом воздухе и кислороде при нормальных условиях медь не окисляется. Она достаточно легко вступает в реакции с галогенами, серой, селеном. А вот с водородом, углеродом и азотом медь не взаимодействует даже при высоких температурах. Кислоты, не обладающие окислительными свойствами, на медь не действуют. Медь в природе Медь входит более чем в 200 минералов, из которых для промышленности важны только 17, преимущественно сульфидов, фосфатов, силикатов, карбонатов, сульфатов. Главными рудными минералами являются: - сульфиды - халькопирит CuFeS2, ковеллин CuS, борнит Cu5FeS4, халькозин Cu2S; - окислы: тенорит (CuO), куприт (Cu2O); - карбонаты: малахит (Сu3(OH)2CO3), лазурит (Сu2(OH)2CO3); - сульфаты: халькантит, брошантит. Чистая медь - тягучий, вязкий металл красного, в изломе розового цвета, в очень тонких слоях на просвет медь выглядит зеленовато-голубой. Эти же цвета характерны и для многих соединений меди, как в твердом состоянии, так и в растворах. Понижение окраски при повышении валентности видно из следующих двух примеров: CuCl (валентность +1) ‒ белый, Cu2O (валентность +1) ‒ красный, CuCl2+H2O (валентность +2) ‒ голубой, CuO (валентность +2) ‒ черный. Карбонаты характеризуются синим и зеленым цветом при условии содержания воды, чем намечается интересный практический признак для поисков. Содержание меди в земной коре сравнительно невелико – 0,007%. Это в 1000 раз меньше, чем алюминия, в 600 раз меньше, чем железа. Однако медь входит в состав 200 минералов. Многие из них отличаются яркой и красивой окраской. Борнит Cu5FeS4 и лазурит Сu3(OH)2CO3 синего цвета, халькопирит CuFeS2 золотистого, темно-зеленый малахит Сu2(OH)2CO3. Главные источники меди – сульфидные руды и медистые песчаники. В Африке сосредоточены огромные залежи медистых песчаников – песчаников со значительными вкраплениями соединений меди. Разведанные запасы меди в этих странах значительно больше, чем в Чили – традиционном экспортере медной руды. Русская медь Первые в России медеплавильные производства были созданы, по-видимому, в XIII в. Из документов известно, что еще в 1213 г. недалеко от Архангельска было найдено Цильменское месторождение медной руды. В 1479 г. в Москве уже существовала «пушечная изба» и делались бронзовые пушки разных калибров. В XVI...XVII вв. Россия испытывала острую нужду в металлах и особенно в меди. «Для сыску медныя руды» русские умельцы отправлялись на север, за Волгу, на Урал. В 1652 г. казанский воевода доносил царю: «Медныя руды... сыскано много и заводы.. к медному делу заводим». И действительно заводили. Известно, что за 12 лет, начиная с 1652 г., «в присылке было из Казани к Москве чистыя меди 4641 пуд 6 гривенок». Но металла все равно не хватало. Не случайно Ломоносов писал, что металлы «...до трудов Петровых почти все получаемы были от окрестных народов, так что и военное оружие иногда у самих неприятелей нужда заставляла перекупать через другие руки дорогою ценой». Петр I многое сделал для развития русской металлургии. К концу его царствования (в 1724 г.) только на Урале было 11 плавильных и 4 «переплавных» печей, выпускавших медь. Началась добыча цветных металлов и на Алтае. А в 1760 г. в России было уже больше 50 медеплавильных заводов. Ежегодная выплавка меди достигла 180 тыс. пудов, или около 3 тыс. т. К середине XIX в. она еще удвоилась. В это время производство меди было сосредоточено в основном на Урале, Кавказе и в Казахстане. Сырье для получения меди Для получения меди применяют медные руды, а также отходы меди и ее сплавов. В рудах содержится 1-6% меди. Пустая порода состоит из пирита FeS, кварца SiO2, карбонатов магния и кальция (MgCO3 и CaCO3), а также из различных силикатов, содержащих Al2O3, CaO, MgO и оксиды железа. В рудах иногда содержится значительное количество других металлов: цинк, олово, никель, золото, серебро, кремний и другие. Медные руды делятся на следующие виды: - сульфидные ‒ бывают обычно первичного происхождения; - окисленные ‒ образовались в результате окисления металлов сульфидных руд; - смешанные; - самородные, в которых медь находится в свободном виде. Производство меди В древности для обработки скальной породы её нагревали на костре и быстро охлаждали, причём порода растрескивалась. Уже в этих условиях были возможны процессы восстановления. В дальнейшем восстановление вели в кострах с большим количеством угля и с вдуванием воздуха посредством труб и мехов. Костры окружали стенками, которые постепенно повышались, что привело к созданию шахтной печи. Позднее методы восстановления уступили место окислительной плавке сульфидных медных руд с получением промежуточных продуктов: - штейна (сплава сульфидов), в котором концентрируется медь; - шлака (сплава окислов). Известны два способа извлечения меди из руд и концентратов: - гидрометаллургический; - пирометаллургический. Пирометаллургический способ В мировой практике 80% меди извлекают из концентратов пирометаллургическими методами, основанными на расплавлении всей массы материала. В процессе плавки, вследствие большего сродства меди к сере, а компонентов пустой породы и железа к кислороду, медь концентрируется в сульфидном расплаве (штейне), а окислы образуют шлак. Данный метод пригоден для переработки всех руд и особенно эффективен в том случае, когда руды подвергаются обогащению. Он заключается в следующих производственных процессах: - обогащение руды; - обжиг руды; - выплавка медного штейна; - получение черновой меди; - рафинирование меди. Медь, предназначенную для электротехники, обязательно подвергают очистке путем электролиза. Из полученных катодных медных пластин выплавляют болванки массой 80…90 кг. Их прокатывают и протягивают в изделия требуемого поперечного сечения. Твердотянутая медь (маркировка МТ) получается методом холодной протяжки. Она прочная, твердая и упругая. Используется для изготовления неизолированных проводов (см. ниже). Мягкая медь (маркировка ММ) получается в результате отжига (нагрев до нескольких сотен градусов с последующим охлаждением). Она сравнительно пластична, менее прочна и тверда, но обладает большим относительным удлинением при разрыве и большей удельной проводимостью. Используется для монтажных проводов и шнуров (см. ниже). К стандартным маркам меди относятся: М1 – 99,90% Cu, остальное ‒ примеси, в том числе О2 не более 0,08%; М0 – 99,95% Cu, остальное ‒ примеси, в том числе О2 не более 0,02%. Алюминий Алюми́ний [5] относится к группе лёгких металлов. К данной группе относятся: алюминий, галлий, индий, олово, таллий, свинец и висмут. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния). Простое вещество алюминий ‒ лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия. Недостатком алюминия является сравнительно низкая его механическая прочность, резко снижающаяся при температуре 150°C. Алюминиевая проволока при одинаковых длине и проводимости с медной проволокой имеет сечение больше на 60%, а масса ее составляет 48% массы меди. По механическим свойствам алюминиевая проволока может быть твердой (не отожженной) марки АТ, полутвердой (частично отожженной) марки АПТ и мягкой (отожженной) марки АМ. Отожженный алюминий в 3 раза менее прочен на разрыв, чем отожженная медь. Алюминий (таблица 3) получают электролизом глинозема Al2O3 в расплаве криолита Na3AlF6 при температуре 950oC. Таблица 3 Марки алюминия
Благородные металлы К ним относятся золото, серебро и металлы платиновой группы: платина, осмий, иридий, рутений, палладий и родий. Серебро - металл, обладающий наименьшим сопротивлением и высокой пластичностью. Применяется для изготовления контактов, радиочастотных кабелей, в припоях, в качестве защиты медных проводов. Серебро является наилучшим проводником электричества. Его удельное сопротивление при 20 градусах равно 0,016 Ом∙мм/м (0,017 для меди; 0,024 для золота и 0,028 для алюминия). Помимо хорошей электрической проводимости обладает стойкостью против действия кислорода при высоких температурах. Большая часть серебра (около 80%) извлекается попутно из полиметаллических руд, а также из руд золота и меди. При извлечении серебра из серебряных и золотых руд применяют метод цианирования. Он заключается в растворении серебра в щелочном растворе цианида натрия при доступе воздуха: 2Ag + 4NaCN + ½O2 + H2O = 2Na[Ag(CN)2] + 2NaOH. Из полученных растворов комплексных цианидов серебро выделяют восстановлением цинком или алюминием: 2[Ag(CN)2]-+ Zn = [2Zn(CN)4]2- + 2Ag. Золото отличается тем, что имеет исключительную теплопроводность и очень низкое сопротивление (удельное сопротивление при 20 градусах равно 0,024 Ом∙мм/м). Исключительной особенностью является его ковкость и тягучесть, кроме того это очень тяжёлый металл. При всем этом золото уступает большинству из благородных металлов по прочности и химической стойкости. Из сплавов золота с серебром или медью изготавливают: - волоски гальванометров и других точных приборов; - миниатюрные электрические контакты. Золотые покрытия отличаются высокой стойкостью и хорошей отражательной способностью. В настоящее время золочению подвергают детали проводников в высоковольтной радиоаппаратуре, отдельные части рентгеновских аппаратов, изготовляют отражатели с золотым покрытием для сушки инфракрасными лучами. Золото с медью может образовывать прочное соединение при диффузионной сварке. Такие соединения называют золотыми печатями и применяют в радиотехнике. Платина. Стабильность электрических, термоэлектрических и механических свойств платины плюс высочайшая коррозионная и термическая стойкость сделали этот металл незаменимым для современной электротехники, автоматики и телемеханики, радиотехники, точного приборостроения. Из платины делают электроды топливных элементов. Палладий. Самый лёгкий драгоценный металл. К особенностям можно отнести его гибкость, пластичность и стойкость к коррозии. Основная же уникальная способность палладия это возможность растворения водорода и исключительная легкоплавкость. Палладий широко используют в электротехнической промышленности в виде сплавов главным образом с серебром, а также родием, золотом, платиной и другими металлами для изготовления контактов (рис. 3), особенно таких, которые применяют в технике слабых токов.
Рис. 3. Контакт из палладия Тугоплавкие металлы Вольфрам Получение: - выделение триоксида из рудных концентратов; - восстановление до металлического порошка водородом при 700°С; - полученный порошок прессуют, спекают в атмосфере водорода при 1200…1300°C и пропускают через него электрический ток; - применение зонной плавки [8]. Химические свойства: - при комнатной температуре не изменяется на воздухе; - при температуре красного каления медленно окисляется в оксид вольфрама (VI). Физические свойства: - температура плавления 3422°C, кипит при 5555°C; - обладает парамагнитными свойствами; - при температуре около 1600°C хорошо поддается ковке. Применение: - электроды для аргоно-дуговой сварки; - нити накаливания в осветительных приборах. Молибден Получение: - обогащение руд флотационным методом; - концентрат обжигают до образования оксида МоО3; - подвергают дополнительной очистке; - МоО3 восстанавливают водородом; - полученные заготовки обрабатывают давлением (ковка, прокатка, протяжка). Применение: - ртутные герконовые реле; - трубопроводы из нержавеющей стали. Физические свойства железа
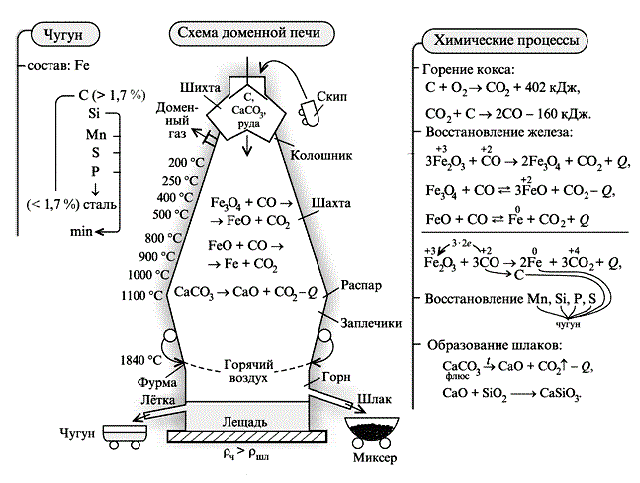
Химические свойства железа Железо ‒ активный металл. На воздухе образуется защитная оксидная пленка, препятствующая коррозии металла. При сильном нагревании на воздухе железо раскаляется и медленно окисляется, а в чистом кислороде горит. Очень эффектным является опыт по сжиганию стальной пружинки. На пружинке закрепляют спичку (напротив ее головки) и зажимают ее в лабораторных щипцах. Спичку, опущенную головкой вниз, поджигают. Когда пламя достигнет пружинки, ее сразу переносят в стакан с кислородом. Дно сосуда заранее засыпают слоем песка, чтобы на стекло не попали капли расплавленного металла.Пружинка сгорает в кислороде, разбрасывая искры во все стороны (это напоминает сварку металла). Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа. Железный гвоздь, погруженный в голубоватый раствор медного купороса, постепенно покрывается налетом красной металлической меди: Fe + CuSO4 = FeSO4 + Cu. Железо взаимодействует с хлором, углеродом и другими неметаллами при нагревании: 2Fe + 3Cl2 = 2FeCl3. Во влажном воздухе железо окисляется и покрывается ржавчиной, которая частично состоит из гидратированного оксида железа (III): 4Fe + 3О2+ 6Н2О = 4Fe(ОН)3. Железо растворяется в разбавленных серной и соляной кислотах c выделением водорода: Fe + 2HCl = FeCl2 + H2. С водой железо реагирует и в обычных условиях, но очень медленно и с участием кислорода. В результате на поверхности металла образуется коричневый или желто-бурый налет ‒ ржавчина. Разрушение железа под действием воды и кислорода называют коррозией. Ежегодно из-за коррозии теряется примерно 1/5 всего произведенного металла. Для предотвращения разрушения железа его смазывают специальными смазочными маслами, покрывают красками, лаками, керамическими эмалями, слоем другого металла, устойчивого к коррозии, ‒ никеля, хрома, цинка. Железо в природе Железо - один из самых распространённых в земной коре металлов (таблица 5). Он занимает второе место после алюминия. В чистом виде железо в природе не встречается. Таблица 5 Получение железа В лаборатории Чистое железо получают электролитическим разложением солей железа: FeCl2 = Fe2+ + 2Cl-. Получение железа из оксида с помощью алюминия называется алюмотермией: 8Al + 3Fe3O4 = 9Fe + 4Al2O3. В промышленности На долю железа приходится около 95% металлургического производства в мире. Это один из наиболее востребованных и используемых металлов. Основная масса железа используется не в чистом виде, а виде чугуна и стали - сплавов с углеродом и другими элементами. Основная масса железа вырабатывается в доменных печах (рис. 4). Процесс, протекающий в доменной печи при получении сплавов железа, основан на восстановлении оксидов железа при нагревании.
Рис. 4. Получение стали в доменной печи Домна – сложнейшее инженерное сооружение высотой более 60 м и диаметром 10 м, снабженное системой контроля и управления, предназначенное для выплавки чугуна – продукта химико-восстановительных процессов. Снизу через фурму (устройство для подвода дутья) поступают горячий воздух, кислород, метан, а навстречу движется шихта – смесь, состоящая из кокса (источник энергии и восстановитель), подготовленного рудного концентрата и флюса (последний для связывания пустой породы в шлаки). Домну через колошник (верхняя часть шахтных доменных плавильных печей) покидает доменный газ, содержащий до 30% СО. Основными химическими реакциями доменного процесса являются: - горение кокса в зоне над горном (нижняя часть домны, где происходит горение топлива). Шлак выполняет также функцию защиты чугуна от окисления; - восстановление железа; - восстановление примесных элементов; - насыщение железа углеродом; - образование шлаков. Сплавы металлов Сплавы меди Бронзы (таблица 6) – сплавы на основе меди, отличающиеся малой объёмной усадкой при литье изделий (0,6…0,8% против усадки у стали и чугуна 1,5…2,5%). Бронзы хорошо обрабатываются резанием, давлением, пайкой. Из них изготавливаются ленты и проволока, применяемые для изготовления пружинящих контактов, токоведущих пружин и другие токоведущие и конструкционные детали электрических машин и аппаратов. Таблица 6 Примеры марок и состава бронз
Никелевые сплавы Для изготовления термопар применяются: - алюмель ‒ 95% Ni, остальные – Al, Si и Mn; - хромель ‒90% Ni и 10% Cr; - нихромы – жаростойкие сплавы на основе никеля и хрома: Х15Н60 - 15% Cr, 65% Ni; Х20Н80 - 20% Cr, 80% Ni. Жаростойкость этих сплавов, т.е. их неокисляемость при высоких температурах, обусловлена образованием на их поверхности окисной плёнки большой плотности, исключающей доступ кислорода к сплаву. Основой жаростойких окисных плёнок является окись хрома Cr2O3 и закись никеля NiO, которые не испаряются с поверхности сплава при высоких температурах. Проволока и ленты их нихромов применяются при изготовлении электронагревательных приборов, реостатов и резисторов. Тонкие пленки из нихрома Х20Н80, получаемые методом термического испарения и конденсации в вакууме, применяются для изготовления тонкопленочных резисторов, являющихся компонентами интегральных схем [8]. В кабельной продукции Медные По степени гибкости их изготовляют четырех типов: I – жилы нормальные для кабелей и проводов, предназначенных для неподвижной прокладки; II – жилы гибкие кабелей и проводов, предназначенных для неподвижной прокладки, где требуется повышенная гибкость при монтаже, и переносных кабелей, работающих при больших радиусах изгиба; III – жилы повышенной гибкости переносных кабелей и проводов, работающих при малых радиусах изгиба; IV – жилы особо гибкие кабелей и проводов, работающих в условиях, требующих особо повышенной гибкости жил. Алюминиевые По гибкости выполняются I, II и III типов. Полупроводящие экраны Бумажные Полупроводящую кабельную бумагу с содержанием ацетиленовой сажи изготовляют как однослойной, так и двухслойной (один слой – полупроводящий, второй – изоляционный [9]). Величина удельного сопротивления такой бумаги не должна превышать 106 Ом·см при измерении между плоскостями и 104 Ом·см при измерении по длине бумажной полосы. Эту бумагу накладывают на токопроводящие жилы и поверх изоляции высоковольтных кабелей с пропитанной бумажной изоляцией для выравнивания электрического поля. Пластмассовые В кабелях с пластмассовой изоляцией для экранов применяют полупроводящую пластмассу того же состава, что и для изоляции. Применяют такие экраны с напряжения 6 кВ. Применение одинакового с изоляцией полупроводящего экрана вызывается стремлением получить одинаковый температурный коэффициент объемного расширения изоляции и экрана. В противном случае может произойти образование газовых включений, которые явятся очагом ионизации в кабеле. Резиновые Экраны из полупроводящей резины применяют в кабелях с резиновой изоляцией на напряжения 6 кВ и выше для выравнивания электрического поля в изоляции. Экраны включены в схему автоматического отключения питания механизмов при повреждении оболочки кабеля до экрана. Скрутка изолированных жил Общая скрутка кабелей связи Скручивание изолированных групп в кабель облегчает взаимное перемещение жил при изгибах кабеля и обеспечивает ему более устойчивую и круглую форму. Скручивание обеспечивает снижение электромагнитных связей между цепями и повышение защищенности их от взаимных и внешних помех. Все кабели связи скручивают по системе сложной скрутки, при которой отдельные изолированные жилы предварительно скручивают в группы, а затем группы скручивают в кабель. Сложная скрутка может быть: а) однородной – с одинаковыми группами жил одинакового диаметра. Её разновидности: - повивная – состоит из концентрических повивов групп вокруг центрального повива из 1…5 групп. Скрутка производится по правильной системе, смежные повивы скручивают в противоположных направлениях; - пучковая – группы скручивают в пучки, состоящие из 10, 50 или 100 пар, а затем однотипные пучки скручивают в кабель. Шаг скрутки пучка принимается равным 50…60D. Группы при скручивании располагаются концентрическими повивами, скручиваемыми в одном направлении, причем распределение групп по повивам подчиняется закону правильной скрутки. б) неоднородной – с наличием групп различного диаметра с жилами различного диаметра, различных типов изоляции, разных систем скрутки. С целью обеспечения разделки кабеля при его монтаже каждый повив, за исключением внешнего, обматывают хлопчатобумажной пряжей или лентой из пластмасс. Поверх внешнего повива накладывают поясную изоляцию, состоящую из двух или более слоев телефонной или кабельной бумаги. Для удобства нахождения групп в каждом повиве вводят контрольные группы (не менее одной) с резко отличной расцветкой. Требуемую группу находят путем отсчета от контрольной группы по часовой стрелке. Либо предусматривают в каждом повиве две группы: контрольную и счетную, расположенную рядом с контрольной и указывающую направление отсчета. Для свободного затягивания кабелей в трубопровод (канал блока) наружный диаметр кабеля должен быть меньше диаметра канала на 20%. Оболочки кабелей Для защиты изоляции жил от воздействия света, влаги, различных химических веществ, а также для предохранения ее от механических повреждений кабели снабжают оболочками. Лучшим материалом для оболочки кабелей в отношении герметичности и влаго-непроницаемости являются металлы. Наиболее распространены металлические оболочки из свинца, алюминия и стали. Свинцовые оболочки Широкое применение свинцовых оболочек объясняется технологичностью наложения оболочек, поскольку они легко спаиваются, влагостойкостью, пластичностью, гибкостью, устойчивостью против действия различных агрессивных сред, содержащихся в почве. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| Поделиться: |


 .
. ,
, - скорость движения электронов в электрическом поле.
- скорость движения электронов в электрическом поле.
 .
. , Ом,
, Ом, , Ом∙м.
, Ом∙м. .
. .
.