Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Металлы с выраженными магнитными свойствамиСодержание книги Поиск на нашем сайте
Эти металлы имеют температуру плавления около 1500°С, могут притягиваться магнитом и намагничиваться, поэтому из них изготовляют постоянные магниты, сердечники трансформаторов, детали телефонных и телеграфных аппаратов и т. п. Основным таким материалом в электротехнике является железо ‒ элемент восьмой группы четвёртого периода периодической системы химических элементов Д.И. Менделеева (приложение 1) с атомным номером 26. Атом железа может потерять 2 электрона и превратиться в ион Fe2+. Возможна потеря атомом еще и третьего электрона. В этом случае образуется ион Fe3+. Чистое железо ‒ серебристо-белый металл, быстро тускнеющий (ржавеющий) на влажном воздухе или в воде, содержащей кислород. Железо пластично, легко подвергается ковке и прокатке, температура плавления 1539°С (таблица 4). Обладает сильными магнитными свойствами (ферромагнетик), хорошей тепло- и электропроводностью. Образует много сплавов с различными металлами. Таблица 4 Физические свойства железа
Химические свойства железа Железо ‒ активный металл. На воздухе образуется защитная оксидная пленка, препятствующая коррозии металла. При сильном нагревании на воздухе железо раскаляется и медленно окисляется, а в чистом кислороде горит. Очень эффектным является опыт по сжиганию стальной пружинки. На пружинке закрепляют спичку (напротив ее головки) и зажимают ее в лабораторных щипцах. Спичку, опущенную головкой вниз, поджигают. Когда пламя достигнет пружинки, ее сразу переносят в стакан с кислородом. Дно сосуда заранее засыпают слоем песка, чтобы на стекло не попали капли расплавленного металла.Пружинка сгорает в кислороде, разбрасывая искры во все стороны (это напоминает сварку металла). Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа. Железный гвоздь, погруженный в голубоватый раствор медного купороса, постепенно покрывается налетом красной металлической меди: Fe + CuSO4 = FeSO4 + Cu. Железо взаимодействует с хлором, углеродом и другими неметаллами при нагревании:
2Fe + 3Cl2 = 2FeCl3. Во влажном воздухе железо окисляется и покрывается ржавчиной, которая частично состоит из гидратированного оксида железа (III): 4Fe + 3О2+ 6Н2О = 4Fe(ОН)3. Железо растворяется в разбавленных серной и соляной кислотах c выделением водорода: Fe + 2HCl = FeCl2 + H2. С водой железо реагирует и в обычных условиях, но очень медленно и с участием кислорода. В результате на поверхности металла образуется коричневый или желто-бурый налет ‒ ржавчина. Разрушение железа под действием воды и кислорода называют коррозией. Ежегодно из-за коррозии теряется примерно 1/5 всего произведенного металла. Для предотвращения разрушения железа его смазывают специальными смазочными маслами, покрывают красками, лаками, керамическими эмалями, слоем другого металла, устойчивого к коррозии, ‒ никеля, хрома, цинка. Железо в природе Железо - один из самых распространённых в земной коре металлов (таблица 5). Он занимает второе место после алюминия. В чистом виде железо в природе не встречается. Таблица 5 Основные данные по железным рудам
Получение железа В лаборатории Чистое железо получают электролитическим разложением солей железа: FeCl2 = Fe2+ + 2Cl-. Получение железа из оксида с помощью алюминия называется алюмотермией: 8Al + 3Fe3O4 = 9Fe + 4Al2O3. В промышленности На долю железа приходится около 95% металлургического производства в мире. Это один из наиболее востребованных и используемых металлов. Основная масса железа используется не в чистом виде, а виде чугуна и стали - сплавов с углеродом и другими элементами. Основная масса железа вырабатывается в доменных печах (рис. 4). Процесс, протекающий в доменной печи при получении сплавов железа, основан на восстановлении оксидов железа при нагревании.
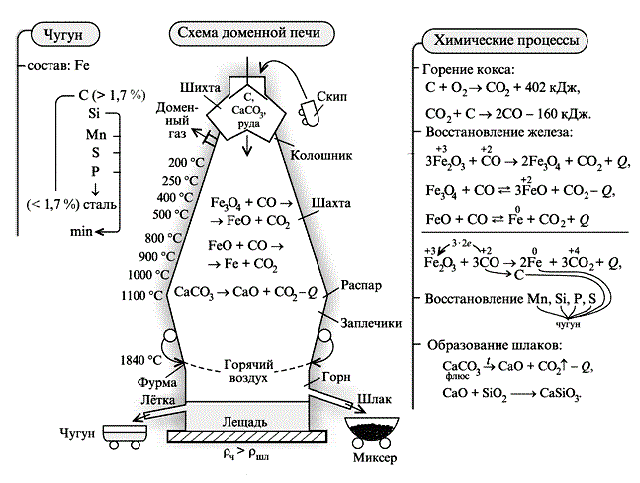
Рис. 4. Получение стали в доменной печи Домна – сложнейшее инженерное сооружение высотой более 60 м и диаметром 10 м, снабженное системой контроля и управления, предназначенное для выплавки чугуна – продукта химико-восстановительных процессов.
Снизу через фурму (устройство для подвода дутья) поступают горячий воздух, кислород, метан, а навстречу движется шихта – смесь, состоящая из кокса (источник энергии и восстановитель), подготовленного рудного концентрата и флюса (последний для связывания пустой породы в шлаки). Домну через колошник (верхняя часть шахтных доменных плавильных печей) покидает доменный газ, содержащий до 30% СО. Основными химическими реакциями доменного процесса являются: - горение кокса в зоне над горном (нижняя часть домны, где происходит горение топлива). Шлак выполняет также функцию защиты чугуна от окисления; - восстановление железа; - восстановление примесных элементов; - насыщение железа углеродом; - образование шлаков.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 536; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.220.169 (0.008 с.) |