
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пассивный транспорт веществ и его разновидности. Математическое описание пассивного транспортаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Пассивный транспорт веществ через клеточные мембраны включает в себя следующие разновидности: фильтрацию, простую диффузию и облегченную диффузию (см. рис. 19.6). Простая диффузия – процесс переноса вещества из области с большей концентрацией в область меньшей концентрации. Диффузия описывается уравнением Фика:
где D – коэффициент диффузии, зависит от температуры и свойств диффундирующего вещества. Таким образом, вектор плотности потока вещества при диффузии направлен в сторону, противоположную вектору градиента концентрации диффундирующего вещества В медицинской литературе традиционно принято считать, что вектор градиента концентрации направлен в сторону уменьшения концентрации вещества. В дальнейшем изложении материала мы будем придерживаться этого нетрадиционного определения направления вектора градиента (еретичного для математической теории поля, в рамках которой было сформулировано понятие вектора градиента поля). Если имеет место одномерная диффузия, т.е. перенос вещества осуществляется вдоль одной оси, например, оси ОХ, в выбранной системе координат, то уравнение Фика может быть представлено в скалярной форме:
Уравнение Фика, адаптированное к условиям переноса вещества через биологическую мембрану посредством простой диффузии, имеет вид (см. рис. 19.8):
где Сi и C0 – концентрации диффундирующего вещества внутри и вне клетки. Сmi и Cm0 – концентрации диффундирующего вещества внутри мембраны на границе мембрана - внутреннее содержимое клетки и мембрана - внешняя среда. L - толщина мембраны, D – коэффициент диффузии, k – коэффициент распределения молекул диффундирующего вещества, равный отношению концентрации молекул на границе мембраны и вне ее, P=Dk/L – проницаемость мембраны. Проницаемость мембраны определяется как свойствами диффундирующего вещества (коэффициентом диффузии), так и состоянием мембраны. Электродиффузия. Диффузия заряженных частиц, ионов, через мембраны зависит не только от концентрационного градиента, но и от электрического градиента мембраны, то есть от напряженности в ней электрического поля ( В связи с этим перенос ионов может происходить в направлении, противоположном градиенту концентрации. Совокупность концентрационного и электрического градиентов называют электрохимическим градиентом. Поток вещества при электродиффузии определяется уравнением Нернста-Планка: (векторная форма),
где g - константа электрического переноса. Облегченная диффузия. Путем простой диффузии в клетку поступают немногие вещества (например, кислород, СО2) Этот процесс протекает очень медленно и обусловлен лишь разностью концентраций этих веществ. Особенностью биомембран является их избирательность (селективность) по отношению ко многим переносимым веществам. Селективность мембран обусловлена двумя причинами: наличием в них переносчиков, называемых ионофорами (подвижных и фиксированных) и каналов. Облегченная диффузия – процесс транспорта веществ с помощью специальных молекул-переносчиков. Например, на внешней стороне мембраны переносчик соединяется с некоторым веществом и проникает через мембрану. На внутренней стороне мембраны происходит отделение от вещества переносчика, который возвращается к внешней поверхности мембраны (см. рис. 19.9). Рассмотренный пример облегченной диффузии относится к типу облегченной диффузии с подвижным переносчиком. Второй тип облегченной диффузии – диффузия с помощью фиксированных переносчиков. При диффузии с фиксированным переносчиком транспорт молекул переносимого вещества происходит с помощью неподвижных молекул-переносчиков (молекула переносимого вещества передается от одной молекулы переносчика к другой, как по эстафете). Фильтрация. Фильтрация представляет собой перенос молекул растворителя под действием градиента давления. Таким образом, причиной и движущей силой в процессе фильтрации является разность давлений. Объем растворителя, перенесенного в результате фильтрации, определяется формулой Пуазейля:
где Осмос. Осмос представляет собой диффузию молекул растворителя через полупроницаемую пленку из области с меньшей концентрацией раствора в область большей концентрации. Явление осмоса наблюдается, когда два соляных раствора с разными концентрациями разделены полупроницаемой мембраной. Полупроницаемая мембрана пропускает молекулы и ионы определенного размера, но служит барьером для веществ с молекулами большего размера. Например, молекулы воды способны проникать через мембрану, а молекулы растворенных в воде солей - нет. Если по разные стороны полупроницаемой мембраны находятся растворы солей с разной концентрацией (см. рис. 19.10), то молекулы воды (растворителя) будут перемещаться через мембрану из слабо концентрированного раствора в более концентрированный, вызывая в последнем повышение уровня жидкости. Из-за явления осмоса процесс проникновения воды через мембрану наблюдается даже в том случае, когда оба раствора находятся под одинаковым внешним давлением. Разница в высоте уровней двух растворов разной концентрации пропорциональна силе, под действием которой вода проходит через мембрану. Эта сила называется "осмотическим давлением". Таким образом, осмотическое давление возникает в растворах с разной концентрацией, разделенных полупроницаемой мембраной, градиент осмотического давления направлен из раствора меньшей концентрации в сторону раствора с большей концентрацией[1]. Проделаем следующий опыт. В воронку, раструб которой затянут бычьим пузырем (бычий пузырь обладает полупроницаемыми свойствами – пропускает молекулы воды и не пропускает молекулы сахара), нальем слабый водный раствор сахара и опустим в сосуд с чистой водой так, чтобы уровни жидкостей в воронке и сосуде совпали. Через некоторое время уровень раствора в воронке начнет медленно повышаться (см. рис. 19.11). Процесс продолжится до тех пор, пока гидростатическое давление столба жидкости высотой h не будет препятствовать дальнейшему поступлению воды из сосуда. Величина гидростатического давления, создаваемого столбом жидкости высотой h, равна rgh, где g – ускорение свободного падения, r - плотность жидкости. Давление, уравновешивающее гидростатическое, называется осмотическим давлением. Повышение уровня раствора в воронке происходит по следующей причине: так как концентрация молекул воды в сосуде больше концентрации молекул воды в воронке, то через полупроницаемую перегородку диффундируют молекулы воды из сосуда в воронку. Молекулы же сахара не могут перейти из воронки в сосуд. Пусть молярная концентрация молекул сахара в сосуде равна нулю, а в воронке С. Избыточная концентрация молекул сахара и создаст парциальное давление растворенного вещества, уравновешиваемое гидростатическим давлением ρgh. Так как осмотическое давление есть результат бомбардировки полупроницаемой мембраны молекулами растворенного вещества (см. рис. 19.12), то величина осмотического давления может быть рассчитана по формуле идеального газа:
где n - число молей растворенного вещества, V – объем раствора, С – молярная концентрация раствора. Применение теории идеального газа к растворам позволило химику Вант-Гоффу получить прекрасные результаты для растворов многих веществ. Однако для растворов некоторых веществ полученные результаты между измеренными и расчетными значениями осмотических давлений давали расхождение в 2 и более раз. Осмысление возможных причин такого расхождения между теорией и практикой привело ученого С. Аррениуса к открытию явления диссоциации. Единомышленник Вант-Гоффа шведский исследователь С. Аррениус догадался, что если измеренное осмотическое давление раствора поваренной соли в два разе больше расчетного, то и число частиц в растворе в два раза больше, чем молекул NaCl. Следовательно, величина осмотического давления прямо пропорциональна молярной концентрации растворенного в растворителе вещества, которое лишено возможности участвовать в диффузии вследствие наличия полупроницаемой мембраны и температуре раствора:
где множитель i учитывает процессы возможного распада (диссоциации) молекул в растворе. Для растворов неэлектролитов i=1, при диссоциации молекул электролитов на ионы i > 1, при ассоциации i < 1. Растворы с одинаковыми осмотическими давлениями называют изотоническими. Физиологические растворы должны быть изотоническими относительно внутренних жидкостей организма - в противном случае происходит либо обезвоживание, либо пересыщение организма водой. Если один раствор по сравнению с другим имеет более высокое осмотическое давление, его называют гипертоническим, а имеющий меньшее давление - гипотоническим. Осмотическое давление крови человека составляет7,6 105 - 7,8 105 Па. Такое же осмотическое давление имеет физиологический раствор, т.е. 0,86% растворNaCl. Для сравнения нормальное атмосферное давление равно 105 Па. Осмотическое давление в клетках с/х животных составляет (6,8 -7,3)105 Па, и оно создает так называемый тургор клетки, придает ей определенную форму. Основная часть осмотического давления обусловлена растворенными в плазме крови или в цитоплазме солями, но часть его определяется содержащимися в них белками (альбумин, глобулин и др.) и называется онкотическим давлением. Несмотря на его малую величину, оно играет важную роль в распределении воды между тканями и кровью. Если клетка организма граничит с концентрированным водным раствором вещества, для которого мембрана клетки непроницаема, то вода переходит из клетки в этот раствор. Происходит осмотическое высасывание воды из клетки. Им, в частности, обусловлено чувство жажды, возникающее при приеме сладкой пищи. В крови позвоночных животных находится специальный белок - сывороточный альбумин, который поддерживает постоянное осмотическое давление в кровеносной системе. Шок при сильных кровотечениях обусловлен не столько потерей крови, сколько резким падением осмотического давления, ведущим к клеточному коллапсу. Поэтому при больших потерях крови необходимо ввести заменители крови, благодаря которым восстанавливается осмотическое давление. 17. Активный транспорт ионов. Механизм активного транспорта вещ-в на примере Na-K насоса. Если бы в клетках сущ. только пассивный транспорт, то конц-ции, давления и др. величины вне и внутри клетки сравнялись бы. Поэтому сущ-т др. механизм, работающий в направлении против электрохимического градиента и происходящий с затратой энергии клеткой. Перенос молекул и ионов против электрохимического градиента,осуществляемый клеткой за счет энергии метаболических процессов, наз. активным транспортом. Он присущ только биологическим мембранам. Активный перенос вещ-ва через мембрану происходит за счет свободной энергии,высвобождающейся в ходе хим. Реакций внутри клетки.Активный транспорт в организме создает градиенты концентраций, электр. потенциалов, давлений,т.е. поддерживает жизнь в организме. Изучены 3 основные системы акт.трансп., кот-ые обеспечивают перенос ионов Na,K,Ca,H через мембрану. Механизм. Ионы К+ и Na+ неравномерно распределены по разные стороны мембраны:концентр. Na+ снаружи > ионов K+,а внутри клетки K+ > Na+.Эти ионы диффундируют через мембрану по направлению электрохимического градиента,что приводит к его выравниванию. Na-K насосы вх. в состав цитоплазмат. мембран и работают за счет энергии гидролиза молекул АТФ с обр-ем мол-л АДФ и неорганич. фосфата Фн: АТФ=АДФ+Фн. Насос работает обра-тимо: градиенты конц-ций ионов способ-ют синтезу мол-л АТФ из мол-л АДФ и Фн: АДФ+Фн=АТФ.Насос переносит из клетки во внеш. среду 3 иона К+внутрь клетки. 18. Способы проникновения вещ-в через биологические мембраны.. Одной из важнейших хар-к клеточных мембран(КМ) явл-ся избират. проницаемость. КМ избирательно снижает скорость передвижения мол-л в клетку и из нее. Чем меньше мол-ла и чем меньше она обр. водород. связей,тем быстрее она диффун-дирует ч/з мембрану. =>, чем меньше мол-ла и чем более она жирорастворима, тем быстрее она будет проникать через мембрану.Малые неполярные мол-лы легко растворимы в липидах КМ и быстро диффундируют.Клетка была вынуждена создать спец.мех-мы для транспорта растворимых в воде вещ-в через мембрану-через поры в мембране и посредством транспортных белков-переносчиков мол-л. Для жиронерастворимых вещ-в и ионов мембрана выступает как молекулярное сито: чем больше размер частицы,тем меньше проницаемость мембраны для этого вещ-ва. Избирательность переноса обеспечивается набором в мембране пор определенного радиуса,соответствующих размеру проникающей частицы.Это распределение зависит от мембранного потенциала. Перенос малых водорастворимых мол-л осуществляется при помощи специальных транспортных белков.Это особые белки,каждый из которых отвечает за транспорт определенных мол-л или групп мол-л. За перенос сахара,аминокислот и др. полярных мол-л ответственны специальные мембранные транспортные белки.Каждый из них предназначен для определенного класса мол-л.Все они обеспечивают перенос мол-л через мембрану, формируя в ней сквозные проходы. Транспортные белки делятся набелки-переносчики, и каналообразующие белки. Переносчики взаим-ют с молекулой переносимого вещ-ва и каким-либо способом перемещают ее сквозь мембрану. Каналообразующие -формируют в мембране водные поры,через кот-ые могут проходить вещ-ва. Отличия облегченной диффузии от простой: 1)перенос ионов с участием переносчиков происх. значительно быстрее; 2)обладает св-вом насыщения- при ув. концентр. С одной стороны мемраны плотность потока вещ-ва возрастает лишь до некоторого предела. Разновидностью облегч.дифф.-транспорт с помощью неподвижных мол-л переносчиков,фиксированных поперек мембраны. Осмос- движение мол-л воды через полупроницаемые мембраны из мест с меньшей концентрацией растворенного вещ-ва в места с большей концентр. Осмос обусл-ет гемолиз эритроцитов в гипотонических растворах и тургор в растениях. 19. История открытия биопотенциалов. Гипотеза Бернштейна.. Фр.священник аббат Нолле в 1746г открыл явление осмоса.1826г. Дютроше доказал,что осмос есть результат проявления не особых,мифических сил,а законов физики и химии. Немецк.ботаник Пфеффер -изобрел осмометр и измерил величину осмотического давления.Он обнаружил,что для каждого раствора величина давления пряма-пропорциональна концентр. раств.вещ-ва,не проходящего через полупроницаемую мембрану (Росм=m/V m-масса растворенного вещ-ва, V-объем раствора). Вант-Гофф пришел к заключению,что мол-лы растворенного вещ-ва в растворителе ведут себя подобно мол-ам идеального газа(Росм=СмRT См-молярная плотность растворенного вещ-ва).Теория Вант-Гоффа давала точные значения величины осм.давления для многих вещ-в,но для некоторых оказ. больше расчетной в 2раза. С.Аррениус предположил что в р-ре мол-ла соли распадается на 2 частицы-электролитич. диссоциация. Вальтер Нернст обосновал идею диффузного потенциала, возн-го при соприк-нии двух жидкостей. Вел-на дифф.потенц. рассчит-ся: Фн=(u-v/u+v)×(RT/F)×Ln(C1/C2), где u и v -скорости быстрого и медл. ионов, R- газ.постоянная , C1 и С2- конц-ции электролита. Для возн-ния дифф.потенц. нужна разность конц-ций электролита, различная подвиж-ть анионов и катионов. Бернштейн начал объяснять электрич св-ва мышц не устройством этих органов в целом,а свойствами клето,из которых эти органы состояли. 1902г-год рождения мембранной теории биопотенциалов. Согласно гипотезе Бернштейна, каждая клетка им. оболочку,кот-ая представляет собой полупроницаемую мембрану. Внутри и вне клетки имеется много свободных ионов,среди кот-ых нах-ся ионы K+. Разность пот-лов между внутр. стороной БМ и ее наружной стороной наз-ся потенциалом покоя (ПП).Величина ПП опис-ся формулой Нернста: ФН=-(RT/F)×Ln[(K+)I/(K+)0] где [K+]i- конц-ция ионов К внутри клетки, [K+]0- конц-ция ионов К снаружи клетки. 20. Мембранно-ионная теория генерации биопот-лов клеткой и основ. опыты, ее подтвер-щие. Ю.Бернштейн (опыты на мышце лягушки). Нагрев 1 конца целой мышцы, от нагретого участка к холодному потечет ток. Электрич. ток течет по направлению от точек пространства с более высоким потенциалом к месту с более низким значением электрического потенциала.В 1905г. Гебер обнаружил,что все соли,сод-е К, оказ. на мышцу схожее д-вие: участок на кот-ый действовал раствор соли К, приобретал отрицательный потенциал по отношению к другим участкам мышцы.Все соли К при диссоциации в воде повышали наружную конц-цию ионов К, при этом отношение (K+)i\(K+)0 умен-ся, ум-ся и пот-ал той области мышцы, на кот. д-ют соли К. Однако эксперименты Бернштейна и Гебера были косвенными. Чтобы подтвердить правильность гипотезы,требовалось доказать следующее: 1)клетки им. мембрану,кот-ая проницаема лишь для одного иона;2)конц-ция этого иона по обе стороны БМ различная;3)потенциал на мембране возникает только за счет проницаемости мембраны для этого иона и он равен нернстовскому потенциалу. В 1936г. Дж.Юнг обнаружил кольмара,у кот-ого диаметр нервного волокна доходил до миллиметра.Аксон кальмара был гигантской клеткой,хотя сам моллюск не был гигантом.Нервное волокно выняли из моллюска и поместили в морскую воду,и оно не погибло.=>(эксперимент на клет.уровне). В 1939г. А.Ходжкин и Хаксли измерили разность потенциалов на аксоне кальмара.Они доказали,что внутри аксона им. много ионов К,и они обр. ионный газ,т.е.нах-ся в свобод. сост-нии.
|
||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 671; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.101.51 (0.011 с.) |

 где
где  вектор плотности потока массы диффундирующего вещества, направлен в сторону переноса.
вектор плотности потока массы диффундирующего вещества, направлен в сторону переноса. 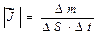 - масса вещества, переносимая в единицу времени вследствие диффузии через выделенную единичную площадку, ориентированную перпендикулярно вектору плотности потока.
- масса вещества, переносимая в единицу времени вследствие диффузии через выделенную единичную площадку, ориентированную перпендикулярно вектору плотности потока. .
. - вектор градиента концентрации диффундирующего вещества, вектор градиента направлен в сторону возрастания концентрации, в декартовой системе координат выражение
- вектор градиента концентрации диффундирующего вещества, вектор градиента направлен в сторону возрастания концентрации, в декартовой системе координат выражение  имеет вид:
имеет вид: .
.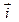 ,
, 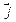 ,
, 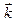 - единичные векторы, направленные вдоль осей OX, OY, OZ.
- единичные векторы, направленные вдоль осей OX, OY, OZ.  .
. .
.
 ,
, ,
, 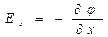 ).
). (проекция векторных величин на ось ОХ),
(проекция векторных величин на ось ОХ), ,
, - перепад давления на расстоянии
- перепад давления на расстоянии  ,
,  - вязкость жидкости,
- вязкость жидкости,  - радиус поверхности фильтрации,
- радиус поверхности фильтрации,  - время переноса.
- время переноса.
 ,
,


