
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Радіус стаціонарних орбіт електрона в атоміСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
В атомі від’ємно заряджений електрон притягається позитивно зарядженим ядром з силою Кулона
де Під дією цієї сили електрон має доцентрове прискорення
Звідси отримується
Підставивши сюди величину
де Радіуси орбіт зростають пропорційно квадратам цілих чисел. Для атома водню (
що близька до реальних розмірів атома водню. Енергія електрона в атомі Енергія електрона у воднеподібній системі рівна сумі його кінетичної і потенціальної енергій в електричному полі ядра.
Враховуючи, що
Отримуємо
Тоді Підставивши значення
Знак «‑» означає, що електрон знаходиться у зв’язаному стані. Енергетичні стани атома утворюють послідовність енергетичних рівнів, що змінюються від значення При
Тобто енергія іонізації атома водню (енергія необхідна для відриву електрона з першої орбіти) Спектри випромінювання атомів водню Згідно третього постулату, енергія випромінювання фотона
Звідки частота випромінювання
Враховуючи, що
Отримані значення співпадають з експериментальним (1). Обмеженість теорії Бора Розрахунки розмірів атомів водню (5), їх енергії іонізації, спектрів випромінювання (7), (9), значень сталих Рідберга Наряду з цим теорія Бора має ряд недоліків та обмежень: ‑ має внутрішні протиріччя (з одного боку, застосовує закои клаичної фізики, з іншого – ґрунтується на квантових постулатах); ‑ не може розрахувати інтенсивність спектральних ліній атома водню; ‑ не може пояснити спектри складних атомів.
Квантова теорія атомів В квантовій механіці опис стану мікрооб’єкта здійснюється має статистично, має ймовірнісний характер. Ймовірність
Ймовірність знаходження частинки в об’ємі
Значення
де
Розв’язок рівняння Шредінгера (11), відносно енергії атома
Квантування енергії Порівняння формули (12), (13) з відповідними формулами (6), (8) теорії Бора показує, що вони повністю співпадають. Але квантова теорія більш глибока. Дійсно, розв’язок рівняння Шредінгера, приводить до квантування не тільки енергії, а і трьох координат Головне квантове число Орбітальне квантове число
де Магнітне квантове число
Спінове квантове число Узагальнюючи експериментальні і теоретичні дані Паулі сформулював принцип (принцип Паулі) який завжди реалізується в мікроскопічних системах. В системі однакових ферміонів довільні два з них не можуть одночасно знаходитися в одному і тому ж стані, тобто не можуть мати однаковими всі чотири квантові числа. Ферміони – частинки з пів цілим спіном (електрон, протон, нейтрон). Сукупність електронів, що мають однакові значення квантового числа Кількість електронів в підоболонці визначається магнітним Таким чином максимальна кількість електронів в оболонці може бути:
Розподіл електронів в оболонках і підоболонках приведемо на мал.
Мал.1 – Розподіл електронів в оболонках атомів
Для запису, оболонки позначають великими літерами
а під оболонки малими літерами
Згідно квантової теорії атома, квантові числа і принцип Паулі визначають положення електронів в атомах, їх енергетичні рівні, а значить їх спектри випромінювання і поглинання, хімічні властивості та структуру періодичної таблиці атомів Експеримент повністю підтверджує теоретичні передбачення квантової теорії атомів.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 778; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.131.37.82 (0.01 с.) |

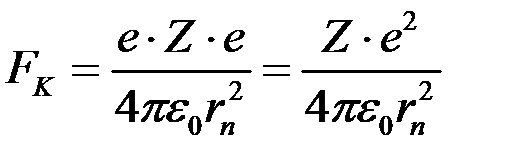 ,
,
 ‑ заряд ядра,
‑ заряд ядра,  ‑ заряд електрона,
‑ заряд електрона,  ‑ відстань електрона від ядра.
‑ відстань електрона від ядра. ,
,
 ‑ маса електрона,
‑ маса електрона,  ‑ орбітальна швидкість електрона.
‑ орбітальна швидкість електрона. ,
,
 , знайдену з другого постулату Бора
, знайдену з другого постулату Бора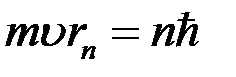 , отримуємо
, отримуємо
 , або
, або 

 ) радіус першої орбіти електрона при
) радіус першої орбіти електрона при 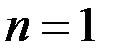 називається першим борівським радіусом (
називається першим борівським радіусом (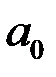 ) і дорівнює
) і дорівнює ,
,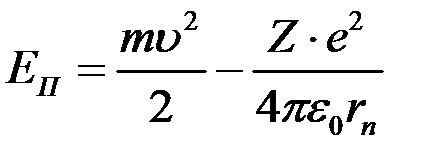 ,
,
 ,
,
 ,
,
 .
. маємо:
маємо: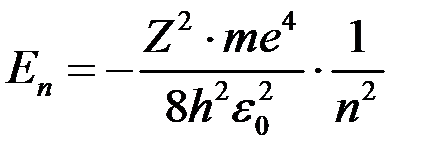 ,
,
 , яке виражає номер енергетичного рівня атома.
, яке виражає номер енергетичного рівня атома. , атом водню має мінімальне енергію
, атом водню має мінімальне енергію , а при
, а при  ,
,  .
. , що співпадає з експериментальним значенням.
, що співпадає з експериментальним значенням.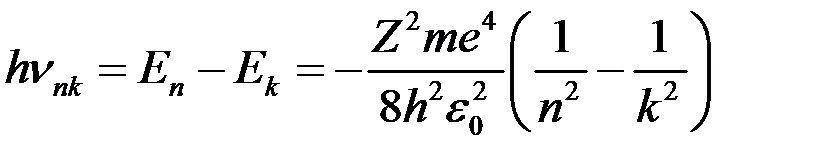 ,
,
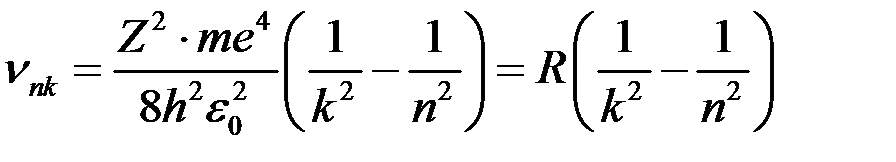 ,
,
 ‑ стала Рідберга
‑ стала Рідберга
 , де
, де  ‑ швидкість світла,
‑ швидкість світла,  ‑ довжина хвилі, маємо:
‑ довжина хвилі, маємо: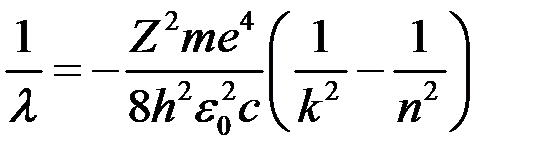 ,
,

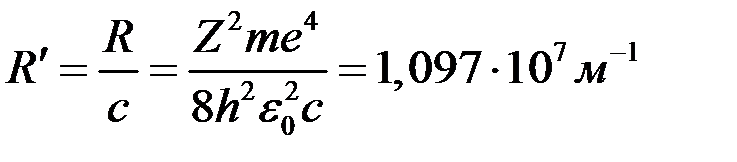 ‑ стала Рідберга
‑ стала Рідберга
 (8) і
(8) і  (10) дають результати дуже близькі до їх експериментальних значень, що вказує на повну дієздатність теорії Бора.
(10) дають результати дуже близькі до їх експериментальних значень, що вказує на повну дієздатність теорії Бора. знаходження частинки в момент часу
знаходження частинки в момент часу  в об’ємі з координатами
в об’ємі з координатами 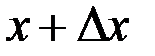 ,
,  ,
,  визначається квадратом модуля хвильової функції
визначається квадратом модуля хвильової функції  (квадрат модуля амплітуди хвилі де Бройля).
(квадрат модуля амплітуди хвилі де Бройля). ,
(або в сферичних координатах
,
(або в сферичних координатах  )
)

 ,
,
 ‑ функції знаходиться з стаціонарного рівняння Шредінгера
‑ функції знаходиться з стаціонарного рівняння Шредінгера
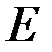 ‑ повна енергія електрона в атомі.
‑ повна енергія електрона в атомі. ‑ оператор Лапласа в сферичних координатах
‑ оператор Лапласа в сферичних координатах  .
. , має вигляд:
, має вигляд: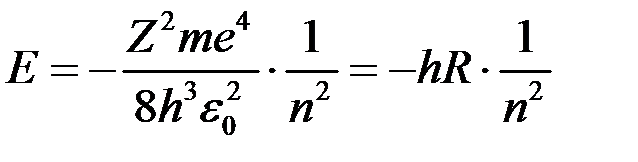 ,
, 
 ‑ стала Рідберга
‑ стала Рідберга
 випливає з самого розвязку.
випливає з самого розвязку. ,
,  ,
,  , що визначається трьома квантовими числами: головним квантовим числом
, що визначається трьома квантовими числами: головним квантовим числом  , орбітальним
, орбітальним  і магнітним
і магнітним  . Так як електрон має власний механічний момент імпульсу (спін), який також кантується, то вводять і спінове квантове число
. Так як електрон має власний механічний момент імпульсу (спін), який також кантується, то вводять і спінове квантове число  .
. ‑ виражає енергетичні рівні електрона в атомі і може набувати значень
‑ виражає енергетичні рівні електрона в атомі і може набувати значень 
 визначає величину модуля вектора моменту імпульсу електрона в атомі при заданому
визначає величину модуля вектора моменту імпульсу електрона в атомі при заданому  .
.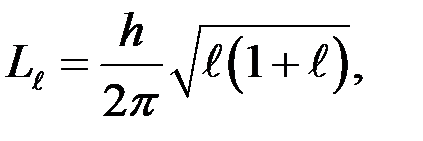
 .
. визначає проекцію моменту імпульсу електрона на заданий напрямок (визначає положення вектора моменту імпульсу
визначає проекцію моменту імпульсу електрона на заданий напрямок (визначає положення вектора моменту імпульсу  електрона.
електрона. ,
,

 визначає положення спіну електрона в атомі і може приймати тільки два значення
визначає положення спіну електрона в атомі і може приймати тільки два значення  .
. , утворює оболонку. Оболонка поділяється на
, утворює оболонку. Оболонка поділяється на  під оболонок, які відрізняються значеннями орбітального квантового числа
під оболонок, які відрізняються значеннями орбітального квантового числа  . Число під оболонок дорівнює
. Число під оболонок дорівнює  , оскільки орбітальне квантове число набуває значень від 0 до
, оскільки орбітальне квантове число набуває значень від 0 до  .
. і спіновим
і спіновим  квантовими числами: максимальне число електронів в підоболонці з даним
квантовими числами: максимальне число електронів в підоболонці з даним  дорівнює
дорівнює  .
. ,
,




