
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основні відомості про будову електронних оболонок атомівСодержание книги
Поиск на нашем сайте
Основні відомості про будову електронних оболонок атомів
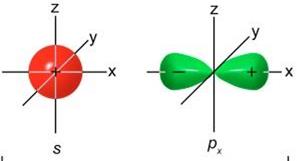
Атом складається з ядра та електронної оболонки. Ядро знаходиться в центрі атома і має позитивний заряд, що дорівнює порядковому номеру елемента в Періодичний системі. Діаметр атома становить 10-9 – 10-10 м, тоді, як діаметр ядра всього 10-14 – 10-15 м. Отже, діаметр ядра приблизно в сто тисяч разів менший за діаметр атома. Однак, майже вся маса атома (99,99 %) зосереджена саме в його ядрі. Електронна оболонка складається з електронів, що рухаються навколо ядра. Електрон є елементарною частинкою, що несе цілий елементарний негативний заряд (1,6·10-19 Кл). Кількість електронів відповідає величині позитивного заряду ядра, а значить і порядковому номеру елемента в Періодичний системі. Електрони характеризуються дуже низькою масою, тому втрата або приєднання атомом одного або навіть декількох електронів практично не змінює його маси. Характер хімічної взаємодії між атомами, а також природа хімічного зв’язку між ними у значній мірі залежать від будови електронних оболонок атомів. Згідно з квантово-механічною теорією, електрон має подвійну природу (дуалістичність): йому притаманні властивості як електромагнітної хвилі, так і матеріальної частинки. Електрон рухається навколо ядра зі швидкістю, що наближається до швидкості світла, створюючи, т.з. електронну хмару. Тому визначити точне положення електрона відносно ядра неможливо. Можна лише визначити ймовірність його знаходження в тій чи іншій точці простору (“принцип невизначеності В.Гейзенберга”). Та частина простору, де ймовірність знаходження електрона становить 90 % називається електронною орбіталлю або атомною орбіталлю (АО). Кожна орбіталь характеризується певними розмірами та формою, а кожен електрон – певним запасом енергії, причому, чим далі від ядра знаходиться електрон, тим більша його енергія. Математично кожна АО описується хвильовою функцією Ψ (псi), яка у фiзичному розумiннi є коренем квадратним вiд ймовiрностi знаходження електрона у певній точці простору з координатами X,Y,Z, (початок координат співпадає з ядром атома). Електрони в багатоелектронних атомах розташовуються на т.з. “ стаціонарних енергетичних рівнях ”, де вони можуть рухатися навколо ядра, як завгодно довго, не витрачаючи своєї енергії. В межах одного рівня електрони розподіляються по підрівнях. Підрівні також характеризуються різною енергією, але ця різниця є значно меншою, ніж різниця енергії між стаціонарними енергетичними рівнями.
Кожен електрон в атомі характеризується чотирма квантовими числами: n, ℓ, m, s (ен, ель, ем, ес). n - Головне квантове число. Воно визначає енергетичний рiвень, на якому знаходиться даний електрон і характеризує середню вiддаль електрона вiд ядра, а значить розмiри електронної хмари. Крім того, n визначаєенергiю електрона в атомі. Чим бiльше n, тим бiльша енергія. Головне квантове число може приймати позитивні цiлочисельнi значення. Максимальне значення n відповідає номеру періода, в якому елемент стоїть в періодичній системі. ℓ - Орбітальне квантове число, яке показує підрівень, де знаходиться електрон і визначає форму електронної орбiталi.Орбітальне квантове число може набувати цiлочисельних значень у межах вiд 0 до (n-1). Хiмiки рiдко використовують числовi значення ℓ, а застосовують його умовні позначення (s, p, d, f).
m -Магнітне квантове число, яке показує орієнтацію електронних орбiталей у просторi i може приймати цiлочисельнi значення вiд – ℓ до + ℓ, включаючи 0.
Кількість можливих значень магнітного квантового числа для даного підрівня визначає кількість атомних орбіталей на ньому. Так, на s-підрівні будь-якого енергетичного рівня є тільки одна орбіталь зі значенням магнітного квантового числа нуль. На p-підрівні – три орбіталі зі значеннями магнітного квантового числа (–1); 0; (+1), а на d-підрівні – п’ять орбіталей. s - спінове квантове число, характеризує спосiб обертання електрона навколо своєї осі та може приймати два значення: (+1/2) i (–1/2). Часто спін електрона зображають стрілкою або ¯. Спіни електронів, напрямлені в один бік, називаються паралельними (), (¯¯), а в протилежні – антипаралельними (¯).
Числа n, ℓ, m разом взятi описують певну атомну орбiталь. Не слiд орбiталям приписувати реальний фiзичний змiст, як геометричних контурiв, на поверхнi яких знаходяться електрони. В дiйсностi рух електронiв в атомі достатньо складний і описується за допомогою методів теорії ймовірностей рiвнянням Е.Шредiнгера. Точний розв`язок цього рiвняння можливий для простих систем, таких як атом та анiон водню, або атом гелію. Для складніших атомів або молекул розв`язати рiвняння Шредiнгера поки що неможливо. Згідно з “Принципом заборони” Паулі - кожен електрон в атомі характеризується своїм певним значенням чотирьох квантових чисел i в атомi не може бути хоча б двох електрон iв, якi б мали однаковi їх значення. Звiдси витiкає, що на однiй орбiталi може знаходитися не бiльше ніж два електрони, спiни яких протилежнi, а число орбiталей на рiвнi залежить вiд можливих значень ℓ та m і визначається кількістю значень m для кожного підрівня. Допустимі значення квантових чисел та максимально можлива кількість електронів на енергетичних рівнях та підрівнях в атомі представлені в табл.1.1. Таблиця 1.1. Природа хімічних зв’язків Чому атоми утворюють один з одним хімічні зв’язки і яка природа цих зв’язків? Справа в тому, що стабільними є тільки ті енергетичні рівні, які повністю забудовані електронами. Зовнішній енергетичний рівень буде стабільним, якщо у нього забудовані s - та p- підрівні, оскільки d -підрівень забудовується електронами після забудови s -підрівня наступного енергетичного рівня і таким чином зовнішній рівень буде знову недобудованим. Отже кожний атом намагається набути стабільної електронної конфігурації свого зовнішнього енергетичного рівня - s2, p6 (крім атома водню, для якого стабільною буде конфігурація 1s2). Цього можна досягти трьома шляхами: 1) прийняти недостаючу кількість електронів на зовнішній рівень; 2) віддати всі електрони з зовнішнього рівня, тоді зовнішнім стає другий ззовні рівень, що вже забудований електронами; 3) об’єднати електрони свого зовнішнього рівня з електронами іншого атома. При реалізації перших двох шляхів, між атомами утворюються іонні зв’язки, а при реалізації третього шляху - ковалентні. Іонний зв’язок утворюється за рахунок сил електростатичного притягання між різнойменно зарядженими іонами. Ці іони утворюються, як правило, внаслідок переходу електронів від одного атома до іншого. Розглянемо утворення іонного зв’язку на прикладі взаємодії натрію з фтором. Атом натрію віддає фтору єдиний електрон 3s-підрівня, перетворюючись на катіон Na+ з електронною оболонкою попереднього інертного газу (Ne) .
1s2 1s2 2s2 2p6 2s2 2p6 3s1
F + 1 e — F — 1s2 1s2 2s2 2p5 2s2 2p6
причому, як Na+, так і F¯ набувають стабільної електронної конфігурації своїх енергетичних рівнів. Але тепер за законом електростатичного притягання катіони натрію притягуються до аніонів фтору, утворюючи іонний зв`язок Na+ F —. Цей зв`язок, не напрямлений, що означає неможливість виділити конкретну пару іонів, які взаємодіють між собою, оскільки кожен катіон притягається до всіх аніонів, які його оточують і навпаки. Крім того, цей зв`язок буде ненасиченим (не слід плутати з ненасичними кратними ковалентними зв’язками) тому, що скільки б іонів протилежного знаку не оточили даний іон він буде взаємодіяти з усіма ними. Отже, у сполуках з іонним зв`язком, як правило, неможливо виділити конкретні два іони, між якими він утворився, тому іонний зв`язок є не векторною, а скалярною величиною.
Такий тип зв’язку утворюється, переважно, між активним металом і активним неметалом. Ковалентний (неелектровалентний, гомеополярний) зв`язок виникає між двома конкретними атомами в результаті утворення спільної електронної пари, яка належить їм обом. Наприклад, зв`язок у молекулі водню утворюється внаслідок усуспільнення двох електронів, кожен з яких до утворення зв`язку належав окремому атому водню
Ковалентний зв`язок у фтороводні (Н‒F) також утворюється за рахунок одного електрона атома водню та ще одного електрона атома фтору. В результаті утворення ковалентного зв`язку атоми водню в обох випадках добудували свій єдиний (перший) енергетичний рівень. Атом фтору також довершив свій зовнішній (другий) енергетичний рівень, одержавши на нього один електрон від атома водню і набув електронної конфігурації 1s22s2 2p6. Такий зв’язок є двоелектронним та двоцентровим, тому що утворюється між двома конкретними атомами. Якщо зв’язок утворився між атомами одного елемента, то спільна електронна пара буде в рівній мірі належати обом атомам; заряди на атомах не виникають і такий зв’язок буде неполярним. Якщо зв’язок утворився між атомами різних елементів, то спільна електронна пара буде належати одному атому в більшій мірі, ніж другому. Той атом, що буде сильніше притягати до себе спільну електронну пару набуде часткового негативного заряду (d-), а інший часткового позитивного (d+). Такий зв’язок називається полярним ковалентним зв’язком. Здатність атома притягати до себе валентні електрони називається електронегативністю. Отже, полярність ковалентного зв’язку визначається різницею електронегативностей атомів, що його утворили і буде тим більшою, чим більшою буде ця різниця. Слід пам’ятати, що спільна електронна пара завжди стягнута до більш електронегативного атома. В таблиці 1.2 наведені значення електронегативності елементів, які доволі часто зустрічаються в органічних сполуках. Таблиця 1.2. Електронегативність деяких елементів (шкала Л.Полінга).
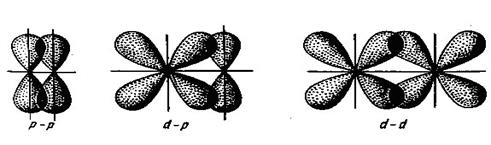
* Найвища електронегативність за шкалою Л. Полінга. У залежностi вiд типу орбiталей, якi перекриваються та способу їх перекриття, розрізняють s- та p- ковалентні зв`язки. Якщо обіталі перекриваються так, що місце їх перетинання знаходиться на відрізку прямої, що з’єднує ядра атомів, то такий зв’язок називається s -зв’язком, наприклад:
Такий спосіб перекриття орбіталей є найбільш вигідним, тому першим зв`язком, який утворюється між атомами, завжди буває саме s -зв’язок. При боковому (латеральному) перекриванні атомних p - або d -орбіталей поза лінією, що зв’язує ядра, утворюється p -зв’язок:
Такий тип зв’язку є менш енергетично вигідний, ніж s -зв’язок, тому p -зв’язок утворюється лише після того, як між атомами вже утворився s -зв’язок. Отже, другий і третій ковалентні зв’язки між двома атомами бувають зв’язками p -типу. Ковалентний тип зв’язку характерний здебільшого для неметалів, оскільки в результаті утворення цього зв’язку обидва атоми добудовують свій зовнішній енергетичний рівень. Донорно-акцепторним (координаційним або дативним) називається ковалентний зв’язок, на утворення якого один атом (донор) надає пару електронів, а другий (акцептор) ‒ вільну атомну орбіталь. Схема утворення донорно-акцепторного зв’язку між двома атомами водню виглядає так:
За своїми властивостями донорно-акцепторний зв’язок є звичайним ковалентним зв’язком. Його відмінність від розглянутих вище ковалентних зв’язків полягає лише у способі утворення спільної електронної пари. Інші приклади сполук з донорно-акцепторним зв’язком: 1. Утворення іону амонію з аміаку:
2. Утворення оксонієвих іонів:
Крім розглянутих типів зв’язків, в органічних сполуках зустрічаються водневі зв'язки. Водневий зв'язок. При утворенні полярного ковалентного зв'язку між атомом водню та атомом з високою електронегативністю, електронна хмара атома водню сильно зміщується до цього атома. В результаті атом електронегативнішого елемента набуває значного ефективного негативного заряду, а ядро атома водню (протон) майже втрачає свій єдиний електрон. Кажуть, що атом водню протонізується. Такий протонізований атом водню буде притягатися до будь-якого іншого атома, що має надлишок електронної густини. В результаті між ними виникає електростатична взаємодія, яка зумовлює утворення водневого зв'язку. Ще однією складовою водневого зв'язку є донорно-акцепторна взаємодія, оскільки протонізований атом водню має вакантну орбіталь, а атом з надлишком електронної густини ‒ неподілену електронну пару. У графічних формулах водневий зв'язок позначається трьома крапками: Енергія водневого зв'язку становить 8‒40 кДж/мольі за міцністю дещо перевищує енергію вандерваальсівської взаємодії, проте вона набагато менша за енергію ковалентного зв'язку. Водневий зв'язок характерний для речовин у рідкому і твердому станах. У газоподібному стані водневий зв'язок проявляється незначною мірою, оскільки відстані між молекулами дуже великі. Водневий зв'язок виявляється як у неорганічних, так і в органічних сполуках (спирти, кислоти, вуглеводи тощо).
Розрізняють міжмолекулярний і внутрішньомолекулярний водневі зв'язки. У твердому, рідкому і навіть газоподібному станах молекули фтороводню асоційовані у ланцюги за рахунок утворення міжмолекулярного водневогозв'язку:
Асоціація молекул спричиняє аномально високі температури плавлення і кипіння фтороводню порівняно з водневими сполуками інших елементів головної підгрупи VII групи. Між молекулами води також утворюються водневі зв’язки. Кожна молекула води може брати участь в утворенні чотирьох водневих зв'язків, в результаті кожен атом кисню зв'язується з чотирма атомами водню (з двома ковалентними зв’язками, а з двома іншими водневими):
Результатом міжмолекулярного водневого зв'язку є асоціація молекул води з утворенням прозірної просторової структури, в якій кожний атом кисню розміщений у центрі тетраедра, вершини якого займають атоми водню. Це зумовлює аномально високі температури танення льоду і кипіння води, а також високі значення теплоємності і теплоти випаровування, не зважаючи на те, що полярний ковалентний зв'язок О‒Н у воді має енергію 489 кДж/моль, а водневий зв'язок між молекулами води лише 42 кДж/моль. Взаємодія молекул, що зумовлена утворенням водневих зв'язків, не завжди приводить до утворення полімерних молекулярних агрегатів, як це має місце для НF, Н2О тощо. Іноді при асоціації утворюються димерні молекули. Наприклад, мурашина кислота існує лише у вигляді димера, який зберігається навіть у газоподібному стані:
Ще раз підкреслимо, що в органічних сполуках водневі зв`язки можуть утворювати тільки ті атоми водню, що зв`язані з киснем або азотом, тобто з атомами, що характеризуються високою електронегативністю. Основні характеристики хімічного зв’язку: довжина ‒ віддаль між ядрами атомів, що утворили зв’язок; як правило, вимірюється в нанометрах (1нм = 10-9м) і дорівнює сумі ковалентних радіусів атомів, що його утворили; енергія ‒ робота, яку треба виконати, щоб розірвати зв’язок; або енергія, що виділяється при утворенні зв’язку з атомів, вимірюється в кДж/моль; полярність ‒ визначається величиною часткових зарядів на атомах, що утворили зв’язок. Вона буде тим більшою, чим більшою буде різниця електронегативностей атомів, що його утворили. Більш електронегативний атом набуде часткового негативного заряду (d-), а інший часткового позитивного (d+). Якщо різниця електронегативностей менша від 1,7, то зв’язок слід розглядати як ковалентний, а якщо більша, то такий зв’язок в більшій мірі нагадує іонний, ніж ковалентний. Отже, іонний зв’язок можна розглядати, як крайній випадок поляризації полярного ковалентного зв’язку; поляризовність – здатність зв’язку поляризуватися під дією зовнішнього електростатичного поля. Вона залежить від рухливості електронних хмар, що приймають участь в утворенні зв’язку та від способу їх перекриття. Так, p- зв`язки поляризуються значно легше, ніж s- зв`язки, оскільки електронна хмара p- зв`язку значно рухливіша, ніж s.
Валентні кути (кути між умовними лініями, вздовж яких утворені хімічні зв’язки) дорівнюють 180о . У структурних формулах ковалентний зв’язок позначається однією рискою (С-С). Подвійний зв’язок, тобто комбінація s - та p -зв'язків ‒ подвійною рискою (С=С). Потрійний зв’язок, (комбінація s - та двох p -зв'язків) ‒ трьома рисками (С º С).
Sр-Гібридизація. З однієї 2s і однієї 2р орбіталей утворюються дві sр -гібридні.
Утворенi sр -гібридні орбiталi розташовані вздовж однієї прямої і напрямлені різні боки (пiд кутом 180о), а двi негiбридизованi 2р -орбiталi перпендикулярні одна до одної і до цієї прямої.
а б Рис.1.6. Схема s -зв’язків (а) та p -зв’язків (б) в молекулі етину
Оскільки обидві гібридні орбіталі розташовані вздовж однієї прямої, але напрямлені в різні боки, валентний кут складає 180о. Крім гібридних sр -орбiталей кожен атом вуглецю має дві негібридизованих 2р -орбіталі. Ці орбіталі попарно перетинаються, утворюючи два p -зв’язки, що лежать у двох взаємно перпендикулярних площинах (рис.1.6 б). Таким чином у цій сполуці між атомами вуглецю утворюється потрійний зв’язок, що складається з одного s - та двох p- зв’язків. У таблиці 1.3 наведені основні характеристики ординарного, подвійного та потрійного зв’язків між атомами вуглецю. Характеристики основних типів ковалентних зв’язків між атомами вуглецю
З табл. 1.3 видно, що зі збільшенням кратності зв’язків зростає їх енергія і зменшується довжина. Різниця між енергією зв’язків в етені та етані дозволяє оцінити енергію p- зв’язку. Ця оцінка дає результат в 260 кДж/моль і свідчить про те, що p- зв’язок значно слабший від s -зв’язку.
Індукційний ефект Індукційний ефект – цеперерозподіл електронної густини σ-зв`язків за рахунок їх поляризації. Розглянемо його прояв на такому прикладі: нехай в органічній речовині з атомом вуглецю з`єднаний більш електронегативний замісник Х. Спільна електронна пара зв`язку С–X зсунута до замісник Х, в результаті чого він набуває часткового негативного заряду (δ–), а зв`язаний з ним атом вуглецю – позитивного (δ+). Атом вуглецю, від якого замісник Х відтягнув електрони, стає більш електронегативним і починає відтягувати електронну густину від інших сусідніх атомів, наводячи на них так само часткові позитивні заряди. Але величини цих зарядів будуть вже значно меншими. За таким самим механізмом індукуються (наводяться) позитивні заряди і на інших атомах, але їх величини будуть ще меншими (δδδ+). Отже, замісник Х індукує виникнення позитивних зарядів на атомах, що безпосередньо з ним не зв`язані. В цьому випадку говорять, що Х проявляє негативний індукційний ефект (─І-ефект). Прояв ─І-ефекту буде тим сильнішим, чим більша електронегативність замісника Х.
Замісники, які проявляють ─ І–ефект
─ NO2 > ─ C≡N > ─ SO3H > ─ F > ─ Cl > ─ Br > ─ C≡CH > > > ─ CH2═CH2 > ─ H
Якщо з атомом вуглецю з`єднаний замісник Y, що має меншу електронегативність, ніж вуглець, то його дія на молекулу буде протилежною. В цьому випадку говорять про позитивний індукційний ефект замісника Y (+І-ефект). Таким чином, знак індукційного ефекту визначається знаком заряду, який набуває замісник, що створює цей ефект. Індукційний ефект атома водню прийнятий за нуль і відносно нього визначають індукційні ефекти іншіх замісників, хоча в дійсності зв`язок С−Н має дипольний момент 0,3 D, тобто є слабо полярним. Замісники, які проявляють +І-ефект До замісників з +І-ефектом відносять менш електронегативні елементи, ніж вуглець (це в першу чергу лужні метали), групи атомів з повним негативним зарядом на атомі, сполученому безпосередньо з вуглецем. Причому +І-ефект тим більший, чим лівіше і нижче стоять елементи в періодичній таблиці (тобто навпаки щодо (-І)-ефекту). Для алкільних угрупувань електронодонорні властивості залежать від їхньої структури. Прояв +І-ефекту алкільних замісників зменшується в ряді: первинний – вторинний – третинний:
Індукційний ефект позначається стрілкою, напрямленою вздовж ординарного зв`язку в бік зміщення електронної густини. Слід, однак, зауважити, що І–ефект досить скоро згасає з відстанню і біля четвертого атома вуглецю вже майже не помітний. Основні відомості про будову електронних оболонок атомів
Атом складається з ядра та електронної оболонки. Ядро знаходиться в центрі атома і має позитивний заряд, що дорівнює порядковому номеру елемента в Періодичний системі. Діаметр атома становить 10-9 – 10-10 м, тоді, як діаметр ядра всього 10-14 – 10-15 м. Отже, діаметр ядра приблизно в сто тисяч разів менший за діаметр атома. Однак, майже вся маса атома (99,99 %) зосереджена саме в його ядрі. Електронна оболонка складається з електронів, що рухаються навколо ядра. Електрон є елементарною частинкою, що несе цілий елементарний негативний заряд (1,6·10-19 Кл). Кількість електронів відповідає величині позитивного заряду ядра, а значить і порядковому номеру елемента в Періодичний системі. Електрони характеризуються дуже низькою масою, тому втрата або приєднання атомом одного або навіть декількох електронів практично не змінює його маси. Характер хімічної взаємодії між атомами, а також природа хімічного зв’язку між ними у значній мірі залежать від будови електронних оболонок атомів. Згідно з квантово-механічною теорією, електрон має подвійну природу (дуалістичність): йому притаманні властивості як електромагнітної хвилі, так і матеріальної частинки. Електрон рухається навколо ядра зі швидкістю, що наближається до швидкості світла, створюючи, т.з. електронну хмару. Тому визначити точне положення електрона відносно ядра неможливо. Можна лише визначити ймовірність його знаходження в тій чи іншій точці простору (“принцип невизначеності В.Гейзенберга”). Та частина простору, де ймовірність знаходження електрона становить 90 % називається електронною орбіталлю або атомною орбіталлю (АО). Кожна орбіталь характеризується певними розмірами та формою, а кожен електрон – певним запасом енергії, причому, чим далі від ядра знаходиться електрон, тим більша його енергія. Математично кожна АО описується хвильовою функцією Ψ (псi), яка у фiзичному розумiннi є коренем квадратним вiд ймовiрностi знаходження електрона у певній точці простору з координатами X,Y,Z, (початок координат співпадає з ядром атома). Електрони в багатоелектронних атомах розташовуються на т.з. “ стаціонарних енергетичних рівнях ”, де вони можуть рухатися навколо ядра, як завгодно довго, не витрачаючи своєї енергії. В межах одного рівня електрони розподіляються по підрівнях. Підрівні також характеризуються різною енергією, але ця різниця є значно меншою, ніж різниця енергії між стаціонарними енергетичними рівнями. Кожен електрон в атомі характеризується чотирма квантовими числами: n, ℓ, m, s (ен, ель, ем, ес). n - Головне квантове число. Воно визначає енергетичний рiвень, на якому знаходиться даний електрон і характеризує середню вiддаль електрона вiд ядра, а значить розмiри електронної хмари. Крім того, n визначаєенергiю електрона в атомі. Чим бiльше n, тим бiльша енергія. Головне квантове число може приймати позитивні цiлочисельнi значення. Максимальне значення n відповідає номеру періода, в якому елемент стоїть в періодичній системі. ℓ - Орбітальне квантове число, яке показує підрівень, де знаходиться електрон і визначає форму електронної орбiталi.Орбітальне квантове число може набувати цiлочисельних значень у межах вiд 0 до (n-1). Хiмiки рiдко використовують числовi значення ℓ, а застосовують його умовні позначення (s, p, d, f).
m -Магнітне квантове число, яке показує орієнтацію електронних орбiталей у просторi i може приймати цiлочисельнi значення вiд – ℓ до + ℓ, включаючи 0.
Кількість можливих значень магнітного квантового числа для даного підрівня визначає кількість атомних орбіталей на ньому. Так, на s-підрівні будь-якого енергетичного рівня є тільки одна орбіталь зі значенням магнітного квантового числа нуль. На p-підрівні – три орбіталі зі значеннями магнітного квантового числа (–1); 0; (+1), а на d-підрівні – п’ять орбіталей. s - спінове квантове число, характеризує спосiб обертання електрона навколо своєї осі та може приймати два значення: (+1/2) i (–1/2). Часто спін електрона зображають стрілкою або ¯. Спіни електронів, напрямлені в один бік, називаються паралельними (), (¯¯), а в протилежні – антипаралельними (¯). Числа n, ℓ, m разом взятi описують певну атомну орбiталь. Не слiд орбiталям приписувати реальний фiзичний змiст, як геометричних контурiв, на поверхнi яких знаходяться електрони. В дiйсностi рух електронiв в атомі достатньо складний і описується за допомогою методів теорії ймовірностей рiвнянням Е.Шредiнгера. Точний розв`язок цього рiвняння можливий для простих систем, таких як атом та анiон водню, або атом гелію. Для складніших атомів або молекул розв`язати рiвняння Шредiнгера поки що неможливо. Згідно з “Принципом заборони” Паулі - кожен електрон в атомі характеризується своїм певним значенням чотирьох квантових чисел i в атомi не може бути хоча б двох електрон iв, якi б мали однаковi їх значення. Звiдси витiкає, що на однiй орбiталi може знаходитися не бiльше ніж два електрони, спiни яких протилежнi, а число орбiталей на рiвнi залежить вiд можливих значень ℓ та m і визначається кількістю значень m для кожного підрівня. Допустимі значення квантових чисел та максимально можлива кількість електронів на енергетичних рівнях та підрівнях в атомі представлені в табл.1.1. Таблиця 1.1.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 363; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.210.108 (0.016 с.) |





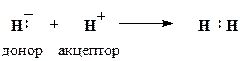



 .
.


 Внутрішньомолекулярний водневий зв'язок виникає між атомами однієї молекули. Найчастіше він виявляється в молекулах органічних сполук, які містять у своєму складі групи ОН, NН2, NO2 тощо, наприклад, у о -нітрофенолі. Водневий зв'язок відіграє важливу роль при асоціації молекул, кристалізації, розчиненні, утворені кристалогідратів, електролітичній дисоціації, у хімії полімерів, білків тощо.
Внутрішньомолекулярний водневий зв'язок виникає між атомами однієї молекули. Найчастіше він виявляється в молекулах органічних сполук, які містять у своєму складі групи ОН, NН2, NO2 тощо, наприклад, у о -нітрофенолі. Водневий зв'язок відіграє важливу роль при асоціації молекул, кристалізації, розчиненні, утворені кристалогідратів, електролітичній дисоціації, у хімії полімерів, білків тощо. Напрямленість зв’язків у просторі зумовлює просторову структуру молекули. Наприклад, молекула води має плоску форму з валентним кутом 104,5о. Молекула ацетилену має лінійну будову. Всі чотири атоми розташовані на одній прямій.
Напрямленість зв’язків у просторі зумовлює просторову структуру молекули. Наприклад, молекула води має плоску форму з валентним кутом 104,5о. Молекула ацетилену має лінійну будову. Всі чотири атоми розташовані на одній прямій. Такий тип гiбридизацiї називається третім валентним станом i характерний для сполук з потрiйним зв`язком -СºС-, -СºN- або для сполук з кумульованими подвійними зв’язками типу алену:.
Такий тип гiбридизацiї називається третім валентним станом i характерний для сполук з потрiйним зв`язком -СºС-, -СºN- або для сполук з кумульованими подвійними зв’язками типу алену:. Розглянемо будову молекули етину (НСºСН). Схеми s - та p -зв’язків в цій молекулі наведені на рис.1.6. Кожен з двох атомів вуглецю витрачає одну sр -гібридну орбіталь на утворення ковалентного зв’язку з атомом водню, а другу з сусіднім атомом вуглецю (рис.1.6 а).
Розглянемо будову молекули етину (НСºСН). Схеми s - та p -зв’язків в цій молекулі наведені на рис.1.6. Кожен з двох атомів вуглецю витрачає одну sр -гібридну орбіталь на утворення ковалентного зв’язку з атомом водню, а другу з сусіднім атомом вуглецю (рис.1.6 а).
 sp3 sp3
sp3 sp3

 До цих замісників відносять елементи більш електронегативні, ніж вуглець (Hal, N, O тощо) або групи атомів з повним позитивним зарядом на атомі, що безпосередньо сполучений з вуглецем. Всі без виключення ненасичені замісники з атомами вуглецю в sp2-, чи sp-гібридному стані, також виявляють ─І-ефект. За здатністю виявляти ─І-ефект замісники, що найчастіше зустрічаються при вивченні курсу органічної хімії, зустрічаються при вивченні курсу органічної хімії, можна розташувати в ряд:
До цих замісників відносять елементи більш електронегативні, ніж вуглець (Hal, N, O тощо) або групи атомів з повним позитивним зарядом на атомі, що безпосередньо сполучений з вуглецем. Всі без виключення ненасичені замісники з атомами вуглецю в sp2-, чи sp-гібридному стані, також виявляють ─І-ефект. За здатністю виявляти ─І-ефект замісники, що найчастіше зустрічаються при вивченні курсу органічної хімії, зустрічаються при вивченні курсу органічної хімії, можна розташувати в ряд:



