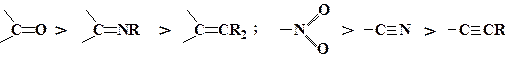Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Мезомерний ефект (ефект спряження, резонансний ефект).Содержание книги
Поиск на нашем сайте
Рис.1.11. Схема розподілу електронів по спряжених p- орбіталях в молекулі фторетену
Атом фтору, що набув октету електронів, внаслідок утворення s -зв'язку з атомом вуглецю, вже не може проявляти електроноакцепторних властивостей, тому що всі його орбіталі заповнені і будь-який подальший перехід електронів до нього суперечить принципу заборони Паулі. Тому електронний заряд передається від атома фтору на подвійний зв’язок і далі на кінцевий (лівий) атом вуглецю в тій мірі, в якій він втрачається фтором. Такий перерозподіл електронної густини показаний на рис.1.11 (б). Обидві структури (а) і (б) можна подати граничними формулами:
Яка ж з них правильно передає розподіл електронної густини в молекулі фторетану? Жодна. В реальній молекулі розподіл електронів є проміжним:
Ще раз підкреслимо, що обидві граничні структури (а) і (б) (рис.2.8) відображають лише один реальний стан молекули. Поляризація, що має місце в молекулі фторетену докорінно відрізняється від тієї, що могла б здійснюватись за індукційним ефектом. У випадку дії індукційного ефекту не спостерігається зміни в перекриванні електронних оболонок атомів, а спостерігається лише зміна полярності s -зв'язків. Електронні зміщення за участю електронів спряжених p- орбіталей, а найчастіше p -зв'язків називають мезомерним ефектом (М-ефектом), С-ефектом або ефектом спряження, R-ефект ом або резонансним ефект.
Залежно від того, які типи орбіталей беруть участь у спряженні розрізняють такі його види: р - p - спряження
p - p - спряження
p - р – спряження
р – р – спряження
Першою вказується електронодонорна орбіталь, а другою – електроноакцепторна, тобто та, на яку передається електронна густина. Які ж умови необхідні для виникнення спряження? 1) Наявність р- орбіталей на двох сусідніх атомах, які формально не зв'язані p- зв'язком. 2) Ці орбіталі не повинні сильно відрізнятись за розмірами. 3) Вісі цих орбіталей мають бути паралельними. Ця умова легко виконується, якщо є можливість вільного обертання атомів довкола ординарного зв'язку, що з'єднує ці атоми. Мезомерний ефект замісника вважають додатним (+М), якщо цей замісник віддає електрон і набуває позитивного заряду, ефект вважається від'ємним (–М), якщо замісник притягує електрон і набуває часткового негативного заряду. Сила М-ефекту залежить, головним чином, від електронної будови замісника. Замісники, які проявляють +М-ефект . +М-Ефект проявляють атоми, що мають на p -орбіталі неподілену пару електронів.Аніони є найсильнішими донорами електронів, і саме вони проявляють найсильніший +М-ефект. У межах однієї групи елементів +М-ефект їх аніонів зменшується зверху до низу, тобто, зі збільшенням заряду ядра атома:
Для нейтральних атомів +М-ефект змінюється в такій самій послідовності, проте прояв цього ефекту значно менший, ніж у відповідних аніонів: F- > Cl- > Br- > I- > O- > O= > S- > S= Така закономірність у зміні прояву +М-ефекту зумовлена такими причинами: 1. Чим більший номер періоду, в якому знаходиться елемент, тим більший розмір і енергію мають його зовнішні р-орбіталі і тим меншою буде можливість їх спряження з 2р-орбіталями атома вуглецю. 2. Зі збільшенням розміру орбіталі зменшується середня густина електронного заряду на ній, а значить і електронодонорні властивості орбіталі. 3. Крім того, здатність замісника проявляти +М-ефект спадає зі збільшенням його електронегативності; тому в межах періоду +М-ефект також зменшується
4. Нарешті, значення +М-ефекту буде зменшуватися у випадку наявності сильної електроноакцепторної групи біля атома з неподіленою парою електронів: Замісники, які проявляють ( – М)-ефект. До цих замісників (акцепторів) відносяться ті, які мають вакантну атомну р- або молекулярну p- орбіталь з низькою енергією. До них належать, в першу чергу, катіони або групи з подвійним зв'язком типу С ═ Y такої природи:
Замісники з карбонільною групою
(–М)-ефект збільшується із збільшенням різниці між величинами електронегативності атомів, які утворюють групу С═Y:
Електронні зміщення викликані М-ефектом, як правло, значніші, ніж ті, що зумовлені індукційним ефектом. Тому, якщо атом одночасно проявляє протилежні ефекти, наприклад (–І) та (+М), то домінуючий внесок у перерозподіл електронної густини зумовлює М-ефект. Адже p -електрони слабше утримуються ядрами, легше поляризуються і тому легше зміщуються. Крім того, мезомерний ефект не так скоро як індукційний згасає по ланцюгу і може передаватися вздовж спряжених p або p- орбіталей на значні відстані.
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 623; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.130.228 (0.006 с.) |

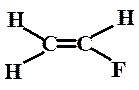 На відміну від індукційного ефекту, який проявляється в поляризації σ-зв`язків, мезомерний ефект спричиняє перерозподіл електронної густини за участю p -зв'язків або p-електронів. Що ж таке спряження, спряжені орбіталі та ефект спряження? Розглянемо ці поняття на прикладі фторетену. Позначимо s -зв'язки рисками, а p -зв'язки перекриванням p- орбіталей (рис.1.11 а). В молекулі фторетану два атоми вуглецю зв'язані крім s - ще і p -зв'язком, утвореним за рахунок бокового перетинання p- орбіталей. Атом фтору має на зовнішньому енергетичному рівні три неподілені пари електронів, що знаходяться на трьох 2p- орбіталях. Коли вісь однієї з них стане паралельною вісям p- орбіталей атомів вуглецю, стане можливим перекриття цієї орбіталі з π- орбіталлю С=С-зв’язку ближнього атома вуглецю, що і називають спряженням. Отже, спряження можна розглядати як додаткове, в порівнянні з класичною формулою, перекриття p- орбіталей. В даному прикладі в результаті спряження утворюється єдина або спільна (спряжена) p -електронна система, що складається з трьох p- орбіталей, на яких знаходяться 4 електрони. В такій системі електрони можуть легко переходити з орбіталі на орбіталь.
На відміну від індукційного ефекту, який проявляється в поляризації σ-зв`язків, мезомерний ефект спричиняє перерозподіл електронної густини за участю p -зв'язків або p-електронів. Що ж таке спряження, спряжені орбіталі та ефект спряження? Розглянемо ці поняття на прикладі фторетену. Позначимо s -зв'язки рисками, а p -зв'язки перекриванням p- орбіталей (рис.1.11 а). В молекулі фторетану два атоми вуглецю зв'язані крім s - ще і p -зв'язком, утвореним за рахунок бокового перетинання p- орбіталей. Атом фтору має на зовнішньому енергетичному рівні три неподілені пари електронів, що знаходяться на трьох 2p- орбіталях. Коли вісь однієї з них стане паралельною вісям p- орбіталей атомів вуглецю, стане можливим перекриття цієї орбіталі з π- орбіталлю С=С-зв’язку ближнього атома вуглецю, що і називають спряженням. Отже, спряження можна розглядати як додаткове, в порівнянні з класичною формулою, перекриття p- орбіталей. В даному прикладі в результаті спряження утворюється єдина або спільна (спряжена) p -електронна система, що складається з трьох p- орбіталей, на яких знаходяться 4 електрони. В такій системі електрони можуть легко переходити з орбіталі на орбіталь.


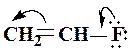 Зсув електронної густини, викликаний мезомерним ефектом позначається вигнутою стрілкою
Зсув електронної густини, викликаний мезомерним ефектом позначається вигнутою стрілкою  або
або  , початок якої показує, які електрони (р- або p -) зміщуються, а кінець стрілки - зв'язки або атоми, до яких зміщується електронна густина:
, початок якої показує, які електрони (р- або p -) зміщуються, а кінець стрілки - зв'язки або атоми, до яких зміщується електронна густина: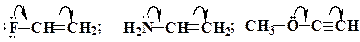
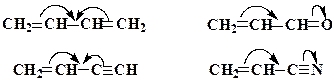
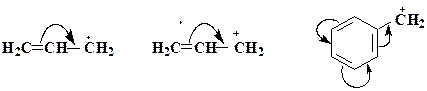

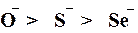

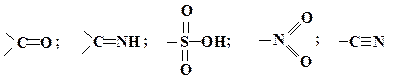
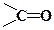 за збільшенням прояву (–М)-ефекту можуть бути розташовані в ряд:
за збільшенням прояву (–М)-ефекту можуть бути розташовані в ряд: