
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Розподіл електронiв по атомних орбіталяхСодержание книги
Поиск на нашем сайте
Схематично атомні орбіталі позначають так:
Вакантна орбіталь Орбіталь з одним електроном Заповнена орбіталь
Рис 1.2. Схематичне зображення p-орбіталей.
На третьому та вищих рiвнях з`являються п’ять d-орбiталей, (m = -2, -1, 0, +1, +2) форма яких ще складніша. Отже, на першому рівні може розташуватися не більше, як 2 електрони, на другому - 8, на третьому – 18 (табл. 1.1). Забудова електронами енергетичних підрівнів відбувається у порядку зростання суми головного та орбітального квантових чисел (n+ℓ), а при однаковій сумі (n+ℓ)спочатку заповнюється орбіталь з меншим значенням n (правило Клечковського). Виходячи з цього, послідовність заповнення енергетичних підрівнів буде наступною: 1s ® 2s ® 2p ® 3s ® 3p ® 4s ® 3d ® 4р ® 5s ® 4d ® 5p ® 6s... (1+2) (2+0) (2+1) (3+0) (3+1) (4+0) (3+2) (4+1) (5+0) (4+2) (5+1) (6+0) У дужках вказані значення суми (n+ℓ). З цієї послідовності витікає, що перед тим, як забудовується d-підрівень відбувається забудова електронами s-підрівня наступного енергетичного рівня. Ця послідовність співпадає зі зростанням енергії електрона. Отже, забудова електронами енергетичних підрівнів відбувається у порядку зростання їх енергії. В органiчнiй хiмiї розглядаються, в основному, 1s, 2s, 2p, 3s, і 3p - орбiталi. У відповідності з правилом Гунда в межах одного підрівня електрони розподіляються так, щоб їх сумарний спін був максимальним, тобто на кожнiй орбiталi спочатку розташовується по одному електрону, причому їхні спіни будуть обов’язково паралельними:
2p
Рx Py Pz
i тiльки пiсля того, як на всіх орбіталях підрівня буде по одному електрону, орбіталі починають доповнюватися другим електроном, спін якого протилежний. Розподіл електронів по рівнях та підрівнях називається електронною конфігурацією атома і схематично зображається за допомогою електронних формул, наприклад:
Властивості атома значною мірою залежать від будови зовнішнього енергетичного рівня. Електрони цього рівня здатні приймати безпосередню участь в утворенні хімічних зв’язків і тому називаються валентними електронами. Природа хімічних зв’язків Чому атоми утворюють один з одним хімічні зв’язки і яка природа цих зв’язків? Справа в тому, що стабільними є тільки ті енергетичні рівні, які повністю забудовані електронами. Зовнішній енергетичний рівень буде стабільним, якщо у нього забудовані s - та p- підрівні, оскільки d -підрівень забудовується електронами після забудови s -підрівня наступного енергетичного рівня і таким чином зовнішній рівень буде знову недобудованим. Отже кожний атом намагається набути стабільної електронної конфігурації свого зовнішнього енергетичного рівня - s2, p6 (крім атома водню, для якого стабільною буде конфігурація 1s2). Цього можна досягти трьома шляхами: 1) прийняти недостаючу кількість електронів на зовнішній рівень; 2) віддати всі електрони з зовнішнього рівня, тоді зовнішнім стає другий ззовні рівень, що вже забудований електронами; 3) об’єднати електрони свого зовнішнього рівня з електронами іншого атома. При реалізації перших двох шляхів, між атомами утворюються іонні зв’язки, а при реалізації третього шляху - ковалентні. Іонний зв’язок утворюється за рахунок сил електростатичного притягання між різнойменно зарядженими іонами. Ці іони утворюються, як правило, внаслідок переходу електронів від одного атома до іншого. Розглянемо утворення іонного зв’язку на прикладі взаємодії натрію з фтором. Атом натрію віддає фтору єдиний електрон 3s-підрівня, перетворюючись на катіон Na+ з електронною оболонкою попереднього інертного газу (Ne) .
1s2 1s2 2s2 2p6 2s2 2p6 3s1
F + 1 e — F — 1s2 1s2 2s2 2p5 2s2 2p6
причому, як Na+, так і F¯ набувають стабільної електронної конфігурації своїх енергетичних рівнів. Але тепер за законом електростатичного притягання катіони натрію притягуються до аніонів фтору, утворюючи іонний зв`язок Na+ F —. Цей зв`язок, не напрямлений, що означає неможливість виділити конкретну пару іонів, які взаємодіють між собою, оскільки кожен катіон притягається до всіх аніонів, які його оточують і навпаки. Крім того, цей зв`язок буде ненасиченим (не слід плутати з ненасичними кратними ковалентними зв’язками) тому, що скільки б іонів протилежного знаку не оточили даний іон він буде взаємодіяти з усіма ними. Отже, у сполуках з іонним зв`язком, як правило, неможливо виділити конкретні два іони, між якими він утворився, тому іонний зв`язок є не векторною, а скалярною величиною. Такий тип зв’язку утворюється, переважно, між активним металом і активним неметалом. Ковалентний (неелектровалентний, гомеополярний) зв`язок виникає між двома конкретними атомами в результаті утворення спільної електронної пари, яка належить їм обом. Наприклад, зв`язок у молекулі водню утворюється внаслідок усуспільнення двох електронів, кожен з яких до утворення зв`язку належав окремому атому водню
Ковалентний зв`язок у фтороводні (Н‒F) також утворюється за рахунок одного електрона атома водню та ще одного електрона атома фтору. В результаті утворення ковалентного зв`язку атоми водню в обох випадках добудували свій єдиний (перший) енергетичний рівень. Атом фтору також довершив свій зовнішній (другий) енергетичний рівень, одержавши на нього один електрон від атома водню і набув електронної конфігурації 1s22s2 2p6. Такий зв’язок є двоелектронним та двоцентровим, тому що утворюється між двома конкретними атомами. Якщо зв’язок утворився між атомами одного елемента, то спільна електронна пара буде в рівній мірі належати обом атомам; заряди на атомах не виникають і такий зв’язок буде неполярним. Якщо зв’язок утворився між атомами різних елементів, то спільна електронна пара буде належати одному атому в більшій мірі, ніж другому. Той атом, що буде сильніше притягати до себе спільну електронну пару набуде часткового негативного заряду (d-), а інший часткового позитивного (d+). Такий зв’язок називається полярним ковалентним зв’язком. Здатність атома притягати до себе валентні електрони називається електронегативністю. Отже, полярність ковалентного зв’язку визначається різницею електронегативностей атомів, що його утворили і буде тим більшою, чим більшою буде ця різниця. Слід пам’ятати, що спільна електронна пара завжди стягнута до більш електронегативного атома. В таблиці 1.2 наведені значення електронегативності елементів, які доволі часто зустрічаються в органічних сполуках. Таблиця 1.2. Електронегативність деяких елементів (шкала Л.Полінга).
* Найвища електронегативність за шкалою Л. Полінга. У залежностi вiд типу орбiталей, якi перекриваються та способу їх перекриття, розрізняють s- та p- ковалентні зв`язки. Якщо обіталі перекриваються так, що місце їх перетинання знаходиться на відрізку прямої, що з’єднує ядра атомів, то такий зв’язок називається s -зв’язком, наприклад:
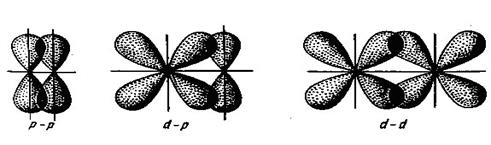
Такий спосіб перекриття орбіталей є найбільш вигідним, тому першим зв`язком, який утворюється між атомами, завжди буває саме s -зв’язок. При боковому (латеральному) перекриванні атомних p - або d -орбіталей поза лінією, що зв’язує ядра, утворюється p -зв’язок:
Такий тип зв’язку є менш енергетично вигідний, ніж s -зв’язок, тому p -зв’язок утворюється лише після того, як між атомами вже утворився s -зв’язок. Отже, другий і третій ковалентні зв’язки між двома атомами бувають зв’язками p -типу. Ковалентний тип зв’язку характерний здебільшого для неметалів, оскільки в результаті утворення цього зв’язку обидва атоми добудовують свій зовнішній енергетичний рівень. Донорно-акцепторним (координаційним або дативним) називається ковалентний зв’язок, на утворення якого один атом (донор) надає пару електронів, а другий (акцептор) ‒ вільну атомну орбіталь. Схема утворення донорно-акцепторного зв’язку між двома атомами водню виглядає так:
За своїми властивостями донорно-акцепторний зв’язок є звичайним ковалентним зв’язком. Його відмінність від розглянутих вище ковалентних зв’язків полягає лише у способі утворення спільної електронної пари. Інші приклади сполук з донорно-акцепторним зв’язком: 1. Утворення іону амонію з аміаку:
2. Утворення оксонієвих іонів:
Крім розглянутих типів зв’язків, в органічних сполуках зустрічаються водневі зв'язки. Водневий зв'язок. При утворенні полярного ковалентного зв'язку між атомом водню та атомом з високою електронегативністю, електронна хмара атома водню сильно зміщується до цього атома. В результаті атом електронегативнішого елемента набуває значного ефективного негативного заряду, а ядро атома водню (протон) майже втрачає свій єдиний електрон. Кажуть, що атом водню протонізується. Такий протонізований атом водню буде притягатися до будь-якого іншого атома, що має надлишок електронної густини. В результаті між ними виникає електростатична взаємодія, яка зумовлює утворення водневого зв'язку. Ще однією складовою водневого зв'язку є донорно-акцепторна взаємодія, оскільки протонізований атом водню має вакантну орбіталь, а атом з надлишком електронної густини ‒ неподілену електронну пару. У графічних формулах водневий зв'язок позначається трьома крапками: Енергія водневого зв'язку становить 8‒40 кДж/мольі за міцністю дещо перевищує енергію вандерваальсівської взаємодії, проте вона набагато менша за енергію ковалентного зв'язку. Водневий зв'язок характерний для речовин у рідкому і твердому станах. У газоподібному стані водневий зв'язок проявляється незначною мірою, оскільки відстані між молекулами дуже великі. Водневий зв'язок виявляється як у неорганічних, так і в органічних сполуках (спирти, кислоти, вуглеводи тощо). Розрізняють міжмолекулярний і внутрішньомолекулярний водневі зв'язки. У твердому, рідкому і навіть газоподібному станах молекули фтороводню асоційовані у ланцюги за рахунок утворення міжмолекулярного водневогозв'язку:
Асоціація молекул спричиняє аномально високі температури плавлення і кипіння фтороводню порівняно з водневими сполуками інших елементів головної підгрупи VII групи. Між молекулами води також утворюються водневі зв’язки. Кожна молекула води може брати участь в утворенні чотирьох водневих зв'язків, в результаті кожен атом кисню зв'язується з чотирма атомами водню (з двома ковалентними зв’язками, а з двома іншими водневими):
Результатом міжмолекулярного водневого зв'язку є асоціація молекул води з утворенням прозірної просторової структури, в якій кожний атом кисню розміщений у центрі тетраедра, вершини якого займають атоми водню. Це зумовлює аномально високі температури танення льоду і кипіння води, а також високі значення теплоємності і теплоти випаровування, не зважаючи на те, що полярний ковалентний зв'язок О‒Н у воді має енергію 489 кДж/моль, а водневий зв'язок між молекулами води лише 42 кДж/моль. Взаємодія молекул, що зумовлена утворенням водневих зв'язків, не завжди приводить до утворення полімерних молекулярних агрегатів, як це має місце для НF, Н2О тощо. Іноді при асоціації утворюються димерні молекули. Наприклад, мурашина кислота існує лише у вигляді димера, який зберігається навіть у газоподібному стані:
Ще раз підкреслимо, що в органічних сполуках водневі зв`язки можуть утворювати тільки ті атоми водню, що зв`язані з киснем або азотом, тобто з атомами, що характеризуються високою електронегативністю. Основні характеристики хімічного зв’язку: довжина ‒ віддаль між ядрами атомів, що утворили зв’язок; як правило, вимірюється в нанометрах (1нм = 10-9м) і дорівнює сумі ковалентних радіусів атомів, що його утворили; енергія ‒ робота, яку треба виконати, щоб розірвати зв’язок; або енергія, що виділяється при утворенні зв’язку з атомів, вимірюється в кДж/моль; полярність ‒ визначається величиною часткових зарядів на атомах, що утворили зв’язок. Вона буде тим більшою, чим більшою буде різниця електронегативностей атомів, що його утворили. Більш електронегативний атом набуде часткового негативного заряду (d-), а інший часткового позитивного (d+). Якщо різниця електронегативностей менша від 1,7, то зв’язок слід розглядати як ковалентний, а якщо більша, то такий зв’язок в більшій мірі нагадує іонний, ніж ковалентний. Отже, іонний зв’язок можна розглядати, як крайній випадок поляризації полярного ковалентного зв’язку; поляризовність – здатність зв’язку поляризуватися під дією зовнішнього електростатичного поля. Вона залежить від рухливості електронних хмар, що приймають участь в утворенні зв’язку та від способу їх перекриття. Так, p- зв`язки поляризуються значно легше, ніж s- зв`язки, оскільки електронна хмара p- зв`язку значно рухливіша, ніж s.
Валентні кути (кути між умовними лініями, вздовж яких утворені хімічні зв’язки) дорівнюють 180о . У структурних формулах ковалентний зв’язок позначається однією рискою (С-С). Подвійний зв’язок, тобто комбінація s - та p -зв'язків ‒ подвійною рискою (С=С). Потрійний зв’язок, (комбінація s - та двох p -зв'язків) ‒ трьома рисками (С º С).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 874; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.82.60 (0.013 с.) |












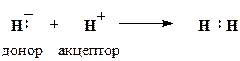



 .
.


 Внутрішньомолекулярний водневий зв'язок виникає між атомами однієї молекули. Найчастіше він виявляється в молекулах органічних сполук, які містять у своєму складі групи ОН, NН2, NO2 тощо, наприклад, у о -нітрофенолі. Водневий зв'язок відіграє важливу роль при асоціації молекул, кристалізації, розчиненні, утворені кристалогідратів, електролітичній дисоціації, у хімії полімерів, білків тощо.
Внутрішньомолекулярний водневий зв'язок виникає між атомами однієї молекули. Найчастіше він виявляється в молекулах органічних сполук, які містять у своєму складі групи ОН, NН2, NO2 тощо, наприклад, у о -нітрофенолі. Водневий зв'язок відіграє важливу роль при асоціації молекул, кристалізації, розчиненні, утворені кристалогідратів, електролітичній дисоціації, у хімії полімерів, білків тощо. Напрямленість зв’язків у просторі зумовлює просторову структуру молекули. Наприклад, молекула води має плоску форму з валентним кутом 104,5о. Молекула ацетилену має лінійну будову. Всі чотири атоми розташовані на одній прямій.
Напрямленість зв’язків у просторі зумовлює просторову структуру молекули. Наприклад, молекула води має плоску форму з валентним кутом 104,5о. Молекула ацетилену має лінійну будову. Всі чотири атоми розташовані на одній прямій.


