
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ковалентні зв’язки атомів вуглецюСодержание книги Поиск на нашем сайте
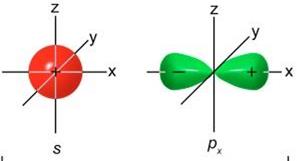
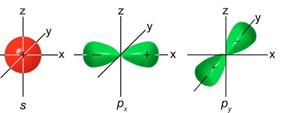
Для того, щоб зрозуміти які зв’язки утворює атом вуглецю, треба розглянути його електронну конфігурацію. На другому (зовнішньому) енергетичному рівні атома вуглецю знаходяться чотири валентних електрони 2s2 і 2р2. В такому стані атом вуглецю має 2 неспарених електрони і може проявляти валентність, що дорівнює двом. Прикладом сполуки, де атом вуглецю є формально двовалентний, може служити оксид вуглецю (ІІ), або чадний газ (СО). Однак, спарювання лише двох валентних електронів не веде до завершення 2-го енергетичного рівня атома вуглецю. Відомо, що при збудженні атома під дією тепла або світлового випромінювання один електрон з 2s -підрівня переходить на 2p- підрівень, в результаті чого на зовнішньому рівні вуглецю з'являються 4 неспарених електрони. При такій електронній конфігурації вуглець міг би утворити 4 ковалентних зв'язки, причому один з них, а саме той, що утворюється 2s- орбіталлю мав би відрізнятись від трьох інших, утворених 2p- орбіталями.
2s2 2p2 2s1 2p3
Однак, відомо, що в метані (СН4), атом С утворює чотири рівноцінні зв'язки з чотирма атомами водню. Цей факт був пояснений на основі такого поняття, як гібридизаціяатомних орбіталей (Л.Полінг, 1931 р). Термін гібридизація означає усереднення, змішування або Відомі такі типи гібридизації атомних орбіталей вуглецю: sp3-гібридизація (перший валентний стан ). При змішуванні однієї s - і трьох p -орбіталей утворюються чотири однакових sp3 -гібридних орбіталі. Умовно таку гібридизацію можна подати схемою, зображеною на рис.1.3.
Чотири sp3–гібридні орбіталі Рис. 1.3. Умовна схема sp3 -гібридизації атома вуглецю
На кожній з чотирьох утворених sp3 -гібридних орбіталей знаходиться по одному електрону, тому вони взаємно відштовхуються і намагаються так розташуватися в просторі, щоб відстань між ними була максимальною. Цій умові відповідає їх напрямленість до вершин тетраедра, центр якого співпадає з ядром атома вуглецю. Валентні кути (кути між осями будь-яких двох гібридизованих орбіталей) дорівнюють 109о28’. В sp3 -гібридному стані атом вуглецю утворює чотири σ-зв'язки з чотирма іншими атомами. Цей тип гібридизації характерний для насичених органічних сполук. На рис. 1.4. наведено схему σ -зв'язків в молекулах метану та етану.
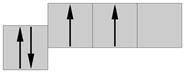
sр2-Гібридизація (другий валентний стан). sр2 -Гібридизація відбувається за рахунок усереднення однієї s та двох p -орбіталей:
Sр-Гібридизація. З однієї 2s і однієї 2р орбіталей утворюються дві sр -гібридні.
Утворенi sр -гібридні орбiталi розташовані вздовж однієї прямої і напрямлені різні боки (пiд кутом 180о), а двi негiбридизованi 2р -орбiталi перпендикулярні одна до одної і до цієї прямої.
а б Рис.1.6. Схема s -зв’язків (а) та p -зв’язків (б) в молекулі етину
Оскільки обидві гібридні орбіталі розташовані вздовж однієї прямої, але напрямлені в різні боки, валентний кут складає 180о. Крім гібридних sр -орбiталей кожен атом вуглецю має дві негібридизованих 2р -орбіталі. Ці орбіталі попарно перетинаються, утворюючи два p -зв’язки, що лежать у двох взаємно перпендикулярних площинах (рис.1.6 б). Таким чином у цій сполуці між атомами вуглецю утворюється потрійний зв’язок, що складається з одного s - та двох p- зв’язків. У таблиці 1.3 наведені основні характеристики ординарного, подвійного та потрійного зв’язків між атомами вуглецю. Характеристики основних типів ковалентних зв’язків між атомами вуглецю
З табл. 1.3 видно, що зі збільшенням кратності зв’язків зростає їх енергія і зменшується довжина. Різниця між енергією зв’язків в етені та етані дозволяє оцінити енергію p- зв’язку. Ця оцінка дає результат в 260 кДж/моль і свідчить про те, що p- зв’язок значно слабший від s -зв’язку.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 567; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.89.126 (0.008 с.) |



 вирівнювання атомних орбіталей.
вирівнювання атомних орбіталей.


 Необхідно пам'ятати, що гібридні орбіталі мають вищу енергію, ніж s - і р -орбіталі, але за рахунок ефективнішого перекривання з іншими орбіталями, гібридні утворюють міцніші зв'язки. Отже енергія, що необхідна для переміщення електронів з атомних орбіталей на гібридні, з надлишком
Необхідно пам'ятати, що гібридні орбіталі мають вищу енергію, ніж s - і р -орбіталі, але за рахунок ефективнішого перекривання з іншими орбіталями, гібридні утворюють міцніші зв'язки. Отже енергія, що необхідна для переміщення електронів з атомних орбіталей на гібридні, з надлишком  компенсується енергією утворення ще двох нових міцніших s -зв`язків і при цьому загальна енергія молекули зменшується.
компенсується енергією утворення ще двох нових міцніших s -зв`язків і при цьому загальна енергія молекули зменшується.

 Вісі трьох утворених sр2 -гібридних орбіталей розміщені в одній площині і утворюють кут 120o. Негібридизована р- орбіталь атома вуглецю розміщена перпендикулярно до цієї площини.
Вісі трьох утворених sр2 -гібридних орбіталей розміщені в одній площині і утворюють кут 120o. Негібридизована р- орбіталь атома вуглецю розміщена перпендикулярно до цієї площини.
 Стан sр2 -гібридизації називається другим валентним станом. В цьому гібридному стані атом вуглецю утворює три σ і один p- зв’язки. Це означає, що вуглець в sp2 – гібридному стані утворює структури типу
Стан sр2 -гібридизації називається другим валентним станом. В цьому гібридному стані атом вуглецю утворює три σ і один p- зв’язки. Це означає, що вуглець в sp2 – гібридному стані утворює структури типу  ,
,  ,
,  тощо. Розглянемо будову молекули етену (Н2С=СН2). У цій молекулі кожен атом вуглецю витрачає по дві sp2-гібридні орбіталі на зв’язки з двома атомами водню, а третю на зв’язок із сусіднім атомом вуглецю (рис.1.5). Всі атоми молекули, а також всі σ-зв’язки лежать в одній площині. Валентні кути складають 120о. Негібридизовані 2р-орбіталі обох атомів вуглецю також перетинаються між собою, утворюючи p- зв’язок. Причому площина p- зв’язку перпендикулярна до площини, в якій розташовані всі атоми молекули. Таким чином, в молекулі етену між атомами вуглецю утворюється подвійний зв’язок,що складається з одного s - таодного p- зв ’ язків.
тощо. Розглянемо будову молекули етену (Н2С=СН2). У цій молекулі кожен атом вуглецю витрачає по дві sp2-гібридні орбіталі на зв’язки з двома атомами водню, а третю на зв’язок із сусіднім атомом вуглецю (рис.1.5). Всі атоми молекули, а також всі σ-зв’язки лежать в одній площині. Валентні кути складають 120о. Негібридизовані 2р-орбіталі обох атомів вуглецю також перетинаються між собою, утворюючи p- зв’язок. Причому площина p- зв’язку перпендикулярна до площини, в якій розташовані всі атоми молекули. Таким чином, в молекулі етену між атомами вуглецю утворюється подвійний зв’язок,що складається з одного s - таодного p- зв ’ язків. Такий тип гiбридизацiї називається третім валентним станом i характерний для сполук з потрiйним зв`язком -СºС-, -СºN- або для сполук з кумульованими подвійними зв’язками типу алену:.
Такий тип гiбридизацiї називається третім валентним станом i характерний для сполук з потрiйним зв`язком -СºС-, -СºN- або для сполук з кумульованими подвійними зв’язками типу алену:. Розглянемо будову молекули етину (НСºСН). Схеми s - та p -зв’язків в цій молекулі наведені на рис.1.6. Кожен з двох атомів вуглецю витрачає одну sр -гібридну орбіталь на утворення ковалентного зв’язку з атомом водню, а другу з сусіднім атомом вуглецю (рис.1.6 а).
Розглянемо будову молекули етину (НСºСН). Схеми s - та p -зв’язків в цій молекулі наведені на рис.1.6. Кожен з двох атомів вуглецю витрачає одну sр -гібридну орбіталь на утворення ковалентного зв’язку з атомом водню, а другу з сусіднім атомом вуглецю (рис.1.6 а).
 sp3 sp3
sp3 sp3



