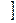Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вода как вещество, её молекулярная структура и изотопный составСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Вода – это простейшее устойчивое химическое вещество-соединение водорода с кислородом. Это оксид водорода Н2О. В чистом виде вода – вещество бесцветное, без вкуса и запаха (11,19 % весовых Н и 88,81 % О2, молекулярный вес 18,0160). Молекула воды несимметрична: в виде равнобедренного треугольника с двумя ядрами водорода в основании и ядом кислорода в вершине
О
Н 1,53 х 10-8 см Н
Рис. 1. Строение молекулы воды
Атом кислорода в молекуле воды присоединяет к себе два электрона, отнятых от атомов водорода и тем самым приобретает отрицательный заряд. В свою очередь, оба атома водорода лишенные электронов, становятся положительно заряженными протонами. Молекула воды поэтому образует электрический диполь (рис. 1). Полярное строение воды и возникающее в воде электрическое поле обуславливает большую диэлектрическую проницательность (показывает во сколько раз силы взаимодействия электрозарядов уменьшаются в воде по сравнению с вакуумом), которая предопределяет большую её ионизирующую способность, т.е. способность расщеплять молекулы других веществ, что обуславливает сильное растворяющее действие воды. Поэтому вода – сильный растворитель. В зависимости от агрегатного состояния организация молекул может быть различной (рис. 2): 1) В кристаллах льда молекулы воды составляют гексагональную систему с прочными водородными связями. Эта структура рыхлая, ажурная, чем и объясняется резкое снижение плотности льда, в результате чего он плавает на воде. Во льду преобладают молекулярные агрегаты тригидроли – (Н2О)3. 2) В жидкой воде обычна тетраэдрическая структура, при которой 4 молекулы по вершинам тетраэдра окружают пятую. Здесь преобладают дигидроли – (Н2О)2.
Рис. 2. Изменение структуры воды в зависимости от агрегатного состояния
3) Водяной пар состоит из мономерных одиночных молекул воды (гидролей), не имеющих водородных связей. 4) В состоянии плазмы происходит разрушение мономерных молекул с появлением отрицательно и положительно заряженных частиц. Вода же имеет наибольшую плотность не при температуре плавления, а при +40 С. В ней одновременно присутствуют разные типы агрегатов молекул. По изотопному составуН2О – это вода, образованная двумя атомами водорода с атомным весом 1 (называется протий) и атомом кислорода с атомным весом 16. Однако наличие тяжелых изотопов водорода (2Н, 3Н), природных и искусственных изотопов кислорода (14О-19О) допускает комбинации из нескольких десятков изотопных типов воды. Д2О – это тяжёлая вода, образованная двумя атомами изотопа водорода дейтерия с атомным весом 2 (протон-нейтрон-электрон). Т2О – сверхтяжёлая вода, образованная двумя атомами изотопа водорода трития с атомным весом 3 (протон, 2 нейтрона, электрон). Д и Т – сами по себе уникальные изотопы, так как их атомные веса не на доли процента, а в 2 и 3 раза отличаются от атомного веса стабильного протия. Поэтому дейтериевая (тяжёлая) и тритиевая (сверхтяжёлая) вода, выделенная в чистом виде, также отличается рядом особых свойств (табл. 1) Это определяет и биологические свойства тяжёлой воды. Доказано, что в ней задерживается размножение микробов, не прорастают семена растений, погибают некоторые простейшие, происходят необратимые изменения у высших организмов. То есть в высокой концентрации тяжёлая вода – это «мёртвая вода» наших сказок… Но имеются и другие данные. Д2О стимулирует рост некоторых плесневых грибов. В настоящее время содержание Д2О в природных водах составляет примерно 145 атомов на 1 млн. атомов Н2О в реках и озёрах и 180 атомов в морях. В ходе геологического времени происходило прогрессивное увеличение содержания Д2О за счёт испарения, вымораживания, поступления из космоса. Таблица 1 Свойства воды разного изотопного состава
Т2О естественного происхождения на Земле всего 20 кг. Основная масса трития образуется при термоядерных реакциях.
Химические свойства воды Вода – слабый электролит, диссоциирующий по уравнению: Н2О↔ H+ + OH– Это ионное равновесие воды, состояние которого отражает водородный показатель рН – логарифм концентрации водородных ионов (моль/л) с обратным знаком рН= –lg рН=7 характеризует нейтральную реакцию воды, рН>7 – щелочную, рН<7-кислую. Природная вода - это слабый раствор. Суммарное содержание в воде растворённых веществ, т.е. концентрация солей, называемая минерализацией, выражается в мг/л, г/л, реже в %. Минерализация варьирует от 0,01 г/л в атмосферных осадках до 600 г/л в рассолах. Солёность воды S – это содержание растворённых в воде веществ, выраженное в промиллях (о/оо, тысячные доли части) или в г/кг.
По минерализации или солёности вода подразделяется на: Пресные – менее 1о/оо ; Солоноватые – 1-25о/оо; Солёные – 25 –50о/оо ; (средняя солёность морской воды 35,16 о/оо) Высокосолёные: рассолы – более 50о/оо, рапа – более 60 о/оо Примеры природных вод различной солености представлены на рисунке 3.
Рис. 3. Примеры природных вод различной солености
В связи с диссоциацией многие химические соединения в воде находятся в ионной форме. Все природные воды делятся по преобладающему аниону (отрицательно заряженные ионы) на три класса: 1 – гидрокарбонатный – НСО3— 2 – сульфатный – SO2- 3 – хлоридный – Cl-4 а по преобладающему катиону (положительный ион) на три группы: 1 – кальциевая – Ca2+ 2 – магниевая – Mg2+ 3- натриевая – Na+ и K+ Общей жёсткостью воды называется сумма концентрации катионов Ca2+ и Mg2+ в воде. В природных водах растворены газы: О2 – кислород, N2 – азот, СО2 - диоксид углерода, H2S – сероводород и другие. В воде находятся микроэлементы (в концентрациях менее 1 мг/л и «следах»), бром - Br, йод - J, фтор - F, литий - Li, барий - Ba, и тяжёлые металлы Fe, Ni, Zn, Co, Cu, Pb, Hg, Cd и другие, а также радиоактивные вещества: калий 40K, уран 238U, стронций 90Sr, цезий 137Cs). В воде растворены также биологические вещества: соединения азота, фосфора, натрия и кремния. Особую категорию составляют содержащиеся в воде загрязнители – нефтепродукты, ядохимикаты, удобрения, моющие средства, тяжёлые токсичные металлы.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-11; просмотров: 996; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.36.36 (0.01 с.) |






 0,97х10-8 см
0,97х10-8 см


 H+
H+