Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Технологические особенности процессовСодержание книги
Поиск на нашем сайте
В пром-сти наиб. распространены реакторы с неподвижным слоем катализатора, в к-рых через слой гранулиров. или таблетированного кат. пропускается (обычно сверху вниз) поток газовых, иногда жидких, реагентов. Катализаторы, используемые в этих реакторах, кроме необходимой активности и селективности, должны обладать достаточной прочностью к истиранию, т.к. истирание увеличивает гидравлич. сопротивление слоя. Высокая уд. пов-сть и пористость катализатора повышают его общую активность, однако способствуют диффузионному торможению р-ции. Диффузионные процессы особенно вредны в случае последоват. каталитич. р-ций, когда в результате диффузионных затруднений с отводом продукта последний может претерпевать нежелательные дальнейшие превращения. Напр., при окислении этилена в этиленоксид на пористом кат. селективность может ухудшаться в результате доокис-ления С2Н4О. Для ликвидации диффузионных осложнений применяют непористые носители или дробят зерна катализатора. Жидкофазный Г.к. проводят в реакторах смешения, в к-рых мелко зернистый кат. суспендируют в среде реагентов или р-рителя. Такие реакторы используют как в периодич., так и в непрерывном режимах. Для устранения внешне-диффузионных осложнений смесь обычно интенсивно перемешивают. По окончании р-ции катализатор необходимо отделить от реагентов. Применяют также реакторы с кипящим, или псевдоожиженным, слоем катализатора, в к-рых пылевидный катализатор поднимается восходящим потоком жидкости или газа. Преимущества Г. к. в псевдоожиженном слое - возможность использования мелкодисперсных непористых частиц, что снижает влияние внутр. диффузии, непрерывное удаление отработанного катализатора и возможность его замены, высокий коэф. теплопередачи, позволяющий поддерживать постоянную т-ру по всему объему кипящего слоя. Псевдоожиженный слой используют для р-ций с интенсивным тепловыделением, напр. при каталитич. окислении. К его недостаткам относятся повышенная истираемость катализатора и вынос частиц катализатора из реактора, к-рые затем необходимо улавливать. В нек-рых процессах, напр. риформинге, применяют реакторы с движущимся слоем гранулиров. катализатора, в к-рый постоянно подается свежий катализатор, а отработанный катализатор идет на регенерацию.
Для конструирования реакторов Г. к. необходимо разработать кинетич. модель процесса, к-рая позволяет определить требуемое кол-во катализатора и объем реактора, обеспечивающий макс. скорость р-ции и выход продукта. Расчеты реакторов должны учитывать также явления тепло- и массопереноса. При осуществлении экзотермич. р-ций часто используют проточно-циркуляц. схемы, включающие теплообменники между слоями катализатора. Расчеты пром. реакторов основываются на методах макрокинетики. Энергия активации в элементарных реакциях, минимальная энергия реагентов (атомов, молекул и других частиц), достаточная для того, чтобы они вступили в хим. реакцию, т. е. для преодоления барьера на поверхности потенциальной энергии, отделяющего реагенты от продуктов реакции. Потенциальный барьер - максимум потенциальной энергии, через который должна пройти система в ходе элементарного акта химического превращения. Высота потенциального барьера для любого пути, проходящего через переходное состояние, равна потенциальной энергии в переходном состоянии. Если в сложной реакции, состоящей из последовательных и параллельных элементарных реакций, имеется лимитирующая элементарная реакция (реакция с максимальным характерным временем), то ее энергия активации является и энергией активации сложной реакции. В макроскопической химической кинетике энергия активации - энергетический параметр Еа, входящий в <i.Аррениуса уравнение. Любой процесс, сопровождающийся каким-либо изменением энергии, является экзотермическим в одном направлении и эндотермическим в другом. Энергия активации экзотермического и эндотермического направлений реакции, обозначаемые соотв.
где Q -.теплота реакции при Т= 0. Качественная одномерная геометрическая иллюстрация связи энергии активации с высотой потенциального барьера и теплотой реакции представлена на рис., где q -координата реакции; Е1 и Е2 - уровни энергии соответственно основного состояния реагентов и продуктов реакции.
Энергетич. схема элементарной реакции. Для реакций рекомбинации свободных радикалов (в том числе и атомов), а также для широкого класса экзотермических ионно-молекулярных реакций энергия активации равна нулю или очень мала по сравнению с типичными значениями энергий хим. связей Е св. Для реакций, сопровождающихся одновременно разрывом одних и образованием других химических связей, Известны эмпирические корреляции, устанавливающие приближенную связь между Еа и Q для однотипных реакций, например правило Поляни-Семенова:
где Е 0и Для придания системе необходимой энергии активации используют нагревание, действие электромагнитного излучения и другое, а также вводяткатализаторы. направляющие химические реакции по пути с меньшей энергией активации. Вопрос27. ЦЕПНЫЕ РЕАКЦИИ, хим. превращения и ядерные процессы, в к-рых появление промежуточной активной частицы (свободного радикала, атома, возбужденной молекулы в хим. превращениях, нейтрона - в ядерных процессах) вызывает цепь превращений исходных в-в. Примеры хим. цепных реакций- радикальная полимеризация, окисление, пиролиз и галогенирование углеводородов и др. орг. соед.; ядерные цепные процессы - цепноеделение атомных ядер. Данная статья посвящена в основном химическим цепным реакциям.
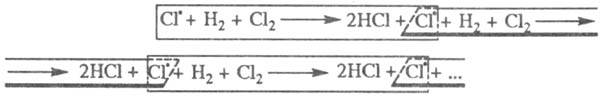
Суммирование р-ций 7 и 2 дает брутто-р-цию, к-рая отражает стехиометрию превращения Н2 + С12
|
|||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 190; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.71.149 (0.01 с.) |

 где к - константа скорости. А - предэкспоненциальный множитель (постоянная или слабо зависящая от температуры величина); k - константа Больцмана; Т - абсолютная температура. График зависимости ln k от 1 /kT (аррениусов график) - прямая линия. Наблюдаемая энергия активации вычисляется из тангенса угла наклона этой прямой. В общем случае сложных реакций параметр Еа в уравнении Аррениуса является функцией энергии активации отдельных стадий, и определяемая энергия активации называется эффективной (эмпирической, кажущейся).
где к - константа скорости. А - предэкспоненциальный множитель (постоянная или слабо зависящая от температуры величина); k - константа Больцмана; Т - абсолютная температура. График зависимости ln k от 1 /kT (аррениусов график) - прямая линия. Наблюдаемая энергия активации вычисляется из тангенса угла наклона этой прямой. В общем случае сложных реакций параметр Еа в уравнении Аррениуса является функцией энергии активации отдельных стадий, и определяемая энергия активации называется эффективной (эмпирической, кажущейся). и
и  , связаны соотношением:
, связаны соотношением: 

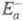 составляет обычно от сотых до десятых долей Е св, если среди реагентов есть свободные радикалы, и сравнима с Е св , если реагенты - химически насыщенные молекулы.
составляет обычно от сотых до десятых долей Е св, если среди реагентов есть свободные радикалы, и сравнима с Е св , если реагенты - химически насыщенные молекулы.  может быть аномально большой (например, больше энергии возбуждения атома Е *) в реакциях тушения электронного возбуждения при столкновениях атомов: А + А
может быть аномально большой (например, больше энергии возбуждения атома Е *) в реакциях тушения электронного возбуждения при столкновениях атомов: А + А  А + А, если точка пересечения термов реагентов и продуктов реакции расположена высоко по сравнению с Е* или термы не пересекаются.
А + А, если точка пересечения термов реагентов и продуктов реакции расположена высоко по сравнению с Е* или термы не пересекаются.
 - константы. Теоретические расчеты Еа производятся приближенными методами квантовой химии. Точные последовательные квантовомеханические вычисления выполнены пока для систем, содержащих не более 3 электронов. например для 3 атомов водорода.
- константы. Теоретические расчеты Еа производятся приближенными методами квантовой химии. Точные последовательные квантовомеханические вычисления выполнены пока для систем, содержащих не более 3 электронов. например для 3 атомов водорода. 2НС1, СО + С12
2НС1, СО + С12  СОС12) один поглощенный фотон вызывает превращение сотен тысяч молекул. Поскольку согласно закону квантовой эквивалентности Штарка-Эйнштейна при поглощении одного фотона в р-цию вступает лишь одна частица, остальные молекулы реагируют без непосредственного светового воздействия. Боденштейн предположил, что активной частицей, вызывающей цепь превращений, является возбужденная молекула
СОС12) один поглощенный фотон вызывает превращение сотен тысяч молекул. Поскольку согласно закону квантовой эквивалентности Штарка-Эйнштейна при поглощении одного фотона в р-цию вступает лишь одна частица, остальные молекулы реагируют без непосредственного светового воздействия. Боденштейн предположил, что активной частицей, вызывающей цепь превращений, является возбужденная молекула 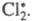 В 1916 В. Нернст высказал предположение об атомарной природе активных частиц и предложил след, механизм цепных реакций с участием Сl2. Поглощение фотона приводит к образованию из молекулы С12 двух атомов
В 1916 В. Нернст высказал предположение об атомарной природе активных частиц и предложил след, механизм цепных реакций с участием Сl2. Поглощение фотона приводит к образованию из молекулы С12 двух атомов  к-рые вступают последовательно в р-ции:
к-рые вступают последовательно в р-ции:
 2НС1. Атом
2НС1. Атом  образовавшийся в р-ции 2, идентичен атому
образовавшийся в р-ции 2, идентичен атому  вступившему в р-цию 7, поэтому последовательность р-ций можно представить в виде, иллюстрирующем наглядность термина "цепные реакции":
вступившему в р-цию 7, поэтому последовательность р-ций можно представить в виде, иллюстрирующем наглядность термина "цепные реакции":