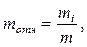Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Статистическая физика и термодинамикаСодержание книги
Поиск на нашем сайте
Термодинамические параметры. Равновесные состояния и процессы, их изображение на термодинамических диаграммах. Газовые законы. Уравнение состояния идеального газа.
Основные формулы
· Уравнение состояния идеальных газов (уравнение Клапейрона-Менделеева):
где m- масса газа, M - молярная масса, R-газовая постоянная; · Закон Дальтона р = р1 + р2 + pi.+... + рn, где р - давление смеси газов; рi - парциальное давление i-го компонента смеси. · Молярная масса смеси газов Мсм = (m1 + m2 +...+mi.+.....+mk)/( где mi- масса i-го компонента смеси; · Относительная массовая доля i-го компонента смеси газа
где mi =m0Ni - масса i-го компонента смеси; m0- масса одной молекулы i-го компонента; Ni - число частиц i-го компонента; m - масса смеси.
Семестровые задания
8.1. Какую температуру имеют 2 г азота, занимающего объем 820 см3 при давлении 0,2 МПа? 8.2. Какой объем занимает 10 г кислорода при давлении 100 кПа и температуре 200 С? 8.3. Баллон емкостью 12 л наполнен азотом при давлении 8,1 МПа и температуре 170 С. Какое количество азота находится в баллоне? 8.4. Каков наименьший объем баллона, вмещающего 6,4 кг кислорода, если его стенки при температуре 200 С выдерживают давление 15,7 МПа? 8.5. В баллоне находилось 10 кг газа при давлении 10 МПа. Найти какую массу газа взяли из баллона, если окончательное давление стало равно 2,5МПа. Температуру газа считать постоянной. 8.6. Найти массу сернистого газа (SO2), занимающего объем 25 л при температуре 270С и давлении 100 кПа. 8.7. В сосуде при температуре t = 200 C и давлении р = 0,2 МПа содержится смесь газов - кислорода, массой m1 = 16 г и азота массой m2 = 21 г. Найти плот-ность смеси. 8.8. Определить давление Р1 и Р2 газа, содержащего N = 109 молекул и имеющего объем V = 1 см3 при температурах Т1 = 3 К и Т2 = 1000 К. 8.9. При температуре t = 350 С и давлении р = 708 кПа плотность некоторого газа r = 12,2 кг/м3. Определить относительную молекулярную массу газа. 8.10. Какой объем V занимает смесь азота массой m1 =1 кг и гелия массой m2=1 кг при нормальных условиях? 8.11. В сосуде вместимостью 0,01 м3 содержится смесь газов- азота массой 7 г и водорода массой 1 г при температуре 70 С. Определить давление смеси газов. 8.12. При температуре 500 С упругость насыщенных водянных паров равна 12,3кПа. Чему равна плотность? 8.13. Найти плотность водорода при температуре 150 С и давлении 97,3 кПа. 8.14. Плотность некоторого газа при температуре 100 С и давлении 0,2 МПа равна 0,34 кг/м3. Чему равна молярная масса этого газа. 8.15. 12 г газа занимает объем 4×10-3 м3 при температуре 70 С. После нагревания газа при постоянном давлении его плотность стала равна 6×10-4 г/м3. До какой температуры нагрели газ? 8.16. В закрытом сосуде емкостью 1 м3 находится 0,9 кг воды и 1,6 кг кислорода. Найти давление в сосуде при температуре 5000 С. 8.17. 6 г углекислого газа (СО2) и 5 г закиси азота (N2 O) заполняют сосуд объемом 2×10-3 м3. Каково общее давление в сосуде при температуре 1270 С? 8.18. В сосуде находится 14 г азота и 9 г водорода при температуре 100 С и давлении 1 МПа. Найти: 1) молярную массу смеси; 2) объем сосуда. 8.19. Найти массу атома:1) водорода; 2) гелия. 8.20. Вычислить массу m атома азота. 8.21. Газ при температуре 309 К и давлении 0,7 МПа имеет плотность r = =12кг/м3. Определить относительную молекулярную массу газа. 8.22. В сосуде объемом 30 л содержится идеальный газ при температуре 00С. После того, как часть газа была выпущена наружу, давление в сосуде понизилось на Dр = 0,78 атм (без изменения температуры). Найти массу выпущенного газа. Плотность данного газа при нормальных условиях 1,3 г/л. 8.23. Два одинаковых баллона соединены трубкой с клапаном, пропускающим газ из одного баллона в другой при разности давлений Dр³ 1,1 атм. Сначала в одном баллоне был вакуум, а в другом - идеальный газ при температуре t1 = =270С и давлении р1 = 1,0 атм. Затем оба баллона нагрели до температуры t2 = =1070 С. Найти давление газа в баллоне, где был вакуум. 8.24. Газ с молярной массой М находится под давлением р между двумя одинаковыми горизонтальными пластинами. Температура газа растет линейно от Т1 у нижней пластины до Т2 у верхней. Объем газа между пластинами равен V. Найти его массу. 8.25. Какой объем занимает смесь газов - азота массой m1 = 1 кг и гелия массой m2=1 кг при нормальных условиях? 8.26. В баллонах объемом V1 = 20 л и V2 = 44 л содержится газ. Давление в первом баллоне р1 = 2,4 МПа, во втором - р2 = 1,6 МПа. Определить общее давление р и парциальные р1’ и р2’ после соединения баллонов, если температура газа осталась прежней. 8.27. В сосуде объемом 0,01 м3 при температуре 280 К содержится смесь газов - азота массой m1 = 7 г и водорода массой m2 = 1 г. Определить давление смеси газов. 8.28. Найти плотность газовой смеси водорода и кислорода, если их относительные массовые доли m1отн и m2отн равны соответственно 1/9 и 8/9. Давление смеси равно 100 кПа, температура 300 К. 8.29. Газовая смесь, состоящая из кислорода и азота, находится в баллоне под давлением 1 МПа. Определить парциальные давления р1 кислорода и р2 азота, если относительная массовая доля m1отн кислорода в смеси равна 0,2. 8.30. В 1 кг сухого воздуха содержится m1 = 232 г кислорода и m2 = 768 г азота (массами других газов пренебрегаем). Определить относительную молекулярную массу М воздуха.
|
||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 115; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.134.195 (0.007 с.) |


 или
или  ,
, - количество вещества; Т - термодинамическая температура.
- количество вещества; Т - термодинамическая температура.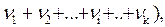
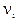 - количество вещества i-го компонента смеси; k- число компонентов смеси.
- количество вещества i-го компонента смеси; k- число компонентов смеси.