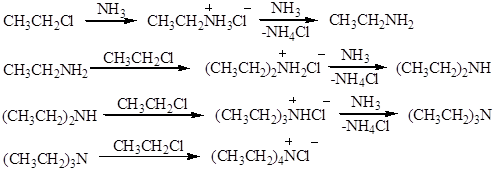Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы получения алифатических аминовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Способы получения алифатических аминов Аммонолиз галогеналканов При нагревании галогеналканов со спиртовым раствором аммиака в запаянных трубках образуется смесь продуктов. При взаимодействии аммиака с галогеналканами образуются первичные алкиламины. Моноалкиламины являются более сильными нуклеофилами, чем аммиак; они будут легко реагировать с галогеналканом, давая значительные количества вторичных и третичных аминов и даже четвертичные соли аммония:
Аммонолиз галогенпроизводных относится к реакциям нуклеофильного замещения. В частности, реакция СН3СН2Сl с NН3 протекает по механизму SN2:
Как было отмечено выше, в результате реакции образуется смесь первичных, вторичных и третичных аминов, а также четвертичные аммонийные соли, поэтому первичные амины обычно получают другими способами. 2.Аммонолиз спиртов Реакция состоит в замещении атомов водорода в аммиаке или амине на алкильные группы. Это важнейший способ синтеза первичных аминов:
Аммонолиз спиртов реализован в значительных масштабах для синтеза низших алифатических аминов (метил- и этиламины). Они применяются в качестве топлива для жидкостных ракетных двигателей и как промежуточные продукты органического синтеза (получение других аминов, диметилгидразина, анионообменных смол и анионоактивных веществ, пестицидов, карбаматов и дитиокарбаматов). Синтез Габриэля Синтез Габриэля позволяет получать первичные амины, свободные от более высокоалкилированных продуктов. Алкилирование фталимидакалия по механизму SN2 дает N-алкилфталимид, который можно легко гидролизовать до соответствующего амина:
Фталимид получают при нагревании фталевого ангидрида с аммиаком:
Фталимид обладает кислотными свойствами из-за делокализации отрицательного заряда имид-аниона на двух ацильных атомах кислорода Он теряет протон, связанный с азотом, при взаимодействии с основанием типа гидроксида калия. В результате этой реакции образуется фталимид-ион - анион, который стабилизируется:
Восстановительное аминирование карбонильных соединений Многие карбонильные соединения превращаются в амины в процессе восстановления в присутствии аммиака. Восстановление осуществляется либо каталитическим гидрированием, либо с помощью цианборгидрида натрия NaBH3CN. Механизм этой реакции включает две важные стадии: образование имина и восстановление имина в амин:
Если вместо аммиака использовать первичный амин, то продуктом реакции будет вторичный амин. Химические свойства аминов Химические свойства аминов определяются наличием и характером (первичная, вторичная, третичная) аминогруппы. Реакции аминов с кислотами Амины, подобно аммиаку, являются основаниями. Они реагируют с разбавленными кислотами с образованием солей: R-NH2 + HCl → R-NH3+Cl- Эти соли при взаимодействии с водными растворами оснований выделяют амины. В водных растворах амины подобно аммиаку существуют в виде гидратов: СН3NH3+OH- (СН3)2NH2+OH- (СН3)3NH+OH- Основность аминов определяется легкостью, с которой амин отщепляет протон от воды. Константа равновесия этой реакции называется константой основности Кb амина:
Увеличение Кb означает повышение основности (см. табл. 26.1). Таблица 26.1 Константы основности аммиака и некоторых аминов
Как видно из этого примера, замена атомов водорода на алкильные группы увеличивает основность азота. Это согласуется с электронодонорной природой алкильных групп, стабилизирующих сопряженную кислоту амина R3NH+ и тем самым повышающим его основность. Дополнительная стабилизация сопряженной кислоты амина происходит за счет эффекта сольватации молекулами растворителя. Триэтиламин обладает несколько меньшей основностью, чем диэтиламин. Полагают, что это вызвано уменьшением эффекта сольватации. Поскольку пространство вокруг атома азота занято алкильными группами, стабилизация на нем положительного заряда молекулами растворителя затруднена. В газовой фазе, где нет влияния молекул растворителя, триэтиламин обладает большей основностью, чем диэтиламин. Образование изонитрилов Первичные алифатические амины образуют изонитрилы при слабом нагревании с хлороформом в присутствии концентрированного раствора щелочи:
Отдельные представители Все амины ядовиты и являются кровяными ядами. Особенно опасны их N-нитрозопроизводные. Метиламин применяется в производстве инсектицидов, фунгицидов, ускорителей вулканизации, поверхностно-активных веществ, красителей, ракетных топлив, растворителей. Некоторые амины применяются как селективные растворители для извлечения урана из сернокислых растворов. Амины, обладающие запахом рыбы, используются как приманка в борьбе с полевыми грызунами. В последние годы третичные амины и соли четвертичных аммониевых оснований получили широкое распространение в качестве катализаторов межфазного переноса в органическом синтезе. Лекция №27. АРОМАТИЧЕСКИЕ АМИНЫ Ароматические амины. Классификация, изомерия. Номенклатура, Способыполучения: из нитросоединений (реакция Зинина) и арилгалогенидов. Получение вторичных и третичныхаминов. Химические свойства. Влияние бензольного кольца и заместителей в нем на основность. Реакции алкилирования и ацилирования. Основания Шиффа. Реакции первичных, вторичных и третичных аминов с азотистой кислотой. Реакции электрофильного замещения у ароматическихаминов. Особенности этой реакции. Анилин, п-толуидин, N,N-диметиламин. Способы получения, применение. Ароматические амины могут быть первичными ArNН2 (анилин, толуидины), вторичными Ar2NH (дифениламин), и третичными Ar3N (трифениламин), а также жирноароматическими ArN(СН3)2 (N,N-диметиланилин). Третичные амины Третичные ароматические амины получают алкилированием или арилированием первичных или вторичных аминов: C6H5-NH2 + 2 CH3OH → C6H5-N(CH3)2 + 2 H2O Менее доступные третичные ароматические амины получают нагреванием вторичных аминов с арилиодидами в присутствии медного порошка: (C6H5)2NH + C6H5I → (C6H5)3N + HI Химические свойства ароматических аминов Ароматические амины имеют менее выраженный основный характер, чем алифатические. Так, Кb метиламина составляет 4,5·10-4, тогда как для анилина 3,8∙10-10. Уменьшение основности анилина по сравнению с алифатическими аминами объясняется взаимодействием неподеленной пары электронов азота с электронами ароматического ядра - их сопряжением. Сопряжение уменьшает способность неподеленной электронной пары присоединять протон. Присутствие электроноакцепторных групп в ядре уменьшает основность. Например, константа основности для о-, м- и п -нитроанилинов составляет соответственно 1∙10-14, 4∙10-12 и 1∙10-12. Ведение второго ароматического ядра также заметно уменьшает основность (для дифениламина ~7,6∙10-14). Дифениламин образует сильно гидролизующиеся в растворах соли только с сильными кислотами. Трифениламин основными свойствами практически не обладает. С другой стороны, введение алкильных групп (электронодонорные группы) увеличивает основность (Кb N-метиланилина и N,N-диметиланилина равны соответственно 7,1∙10-10 и 1,1∙10-9) Способы получения алифатических аминов Аммонолиз галогеналканов При нагревании галогеналканов со спиртовым раствором аммиака в запаянных трубках образуется смесь продуктов. При взаимодействии аммиака с галогеналканами образуются первичные алкиламины. Моноалкиламины являются более сильными нуклеофилами, чем аммиак; они будут легко реагировать с галогеналканом, давая значительные количества вторичных и третичных аминов и даже четвертичные соли аммония:
Аммонолиз галогенпроизводных относится к реакциям нуклеофильного замещения. В частности, реакция СН3СН2Сl с NН3 протекает по механизму SN2:
Как было отмечено выше, в результате реакции образуется смесь первичных, вторичных и третичных аминов, а также четвертичные аммонийные соли, поэтому первичные амины обычно получают другими способами. 2.Аммонолиз спиртов Реакция состоит в замещении атомов водорода в аммиаке или амине на алкильные группы. Это важнейший способ синтеза первичных аминов:
Аммонолиз спиртов реализован в значительных масштабах для синтеза низших алифатических аминов (метил- и этиламины). Они применяются в качестве топлива для жидкостных ракетных двигателей и как промежуточные продукты органического синтеза (получение других аминов, диметилгидразина, анионообменных смол и анионоактивных веществ, пестицидов, карбаматов и дитиокарбаматов). Синтез Габриэля Синтез Габриэля позволяет получать первичные амины, свободные от более высокоалкилированных продуктов. Алкилирование фталимидакалия по механизму SN2 дает N-алкилфталимид, который можно легко гидролизовать до соответствующего амина:
Фталимид получают при нагревании фталевого ангидрида с аммиаком:
Фталимид обладает кислотными свойствами из-за делокализации отрицательного заряда имид-аниона на двух ацильных атомах кислорода Он теряет протон, связанный с азотом, при взаимодействии с основанием типа гидроксида калия. В результате этой реакции образуется фталимид-ион - анион, который стабилизируется:
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 1540; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.189.194.225 (0.007 с.) |