
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Алгоритм расчета объема исходного раствора кислотыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
1. Найти, сколько моль эквивалентов кислоты необходимо для приготовления заданного раствора по формуле: nэкв. (кислоты) = Vр-ра·СN, где: Vр-ра - объем раствора, в литрах, который надо приготовить; СN - нормальная концентрация заданного раствора. 2. Найти массу данного количества эквивалентов кислоты по формуле: m = nэкв.·МЭ , где: МЭ - молярная масса эквивалента кислоты. МЭ(HCl) = M/1 = 36.5 г/моль; МЭ(H2SO4) = M/2 = 49 г/моль. 3. Найти, в какой массе исходного раствора содержится нужная Вам масса кислоты:
где: w - массовая доля кислоты в исходном растворе. 4. Найти объем исходного раствора по формуле:
где: r - плотность, определенная экспериментально с помощью ареометра. Определение точной концентрации кислоты методом титрования Определение концентрации раствора кислоты, основанное на реакции нейтрализации, выполняется следующим образом: 1. Чисто вымытую бюретку установите вертикально в зажиме штатива и ополосните ее несколькими миллилитрами того раствора кислоты, который будет затем наливаться в бюретку. 2. Налейте в бюретку приготовленный раствор кислоты и установите уровень жидкости на нулевом делении, считая по нижнему мениску, уберите воронку из бюретки. Следите, чтобы кончик бюретки был заполнен раствором и не содержал пузырьков воздуха. 3. Ополосните чистую пипетку раствором щелочи известной концентрации, отмерьте ею 10 мл раствора и вылейте его в коническую колбочку, прибавив туда 1-2 капли индикатора метилоранжа. 4. Поместите колбочку с раствором щелочи под бюретку и приливайте постепенно раствор кислоты из бюретки в колбочку до нейтрализации раствора щелочи, то есть до изменения цвета раствора от желтого до слаборозового. Прибавляйте раствор в колбу небольшими порциями при непрерывном перемешивании. Изменение окраски раствора должно произойти от прибавления одной лишней капли раствора кислоты. После этого отмерьте уровень жидкости в бюретке, считая по нижнему мениску. Титрование повторите 3 раза. Отклонение результатов отдельных титрований не должно превышать 0.2 мл (данные с большим отклонением в расчет не принимать). Результаты занесите в таблицу:
По результатам титрования вычислите нормальность кислоты. Для растворов нормальной концентрации существует соотношение, вытекающее из закона эквивалентов:
где: V1 - объем раствора щелочи известной концентрации:
V2 - объем исследуемого раствора кислоты;
Из приведенного равенства легко подсчитать нормальную концентрацию исследуемого раствора:
Лабораторная работа «Изучение зависимости скорости химических реакций от различных факторов. Химическое равновесие» Опыт № 1 Зависимость скорости химической реакции от концентрации реагирующих веществ Налейте в четыре стаканчика следующие растворы: 1) 10 мл 0.1 М раствора тиосульфата натрия + 30 мл воды; 2) 20 мл 0.1 М раствора тиосульфата натрия + 20 мл воды; 3) 30 мл 0.1 М раствора тиосульфата натрия + 10 мл воды; 4) 40 мл 0.1 М раствора тиосульфата натрия. Последовательно в каждый стаканчик прилейте по 10 мл 0.05 М раствора кислоты. Отметьте с помощью секундомера промежуток времени от момента сливания растворов до появления мути, вызванной началом выпадения в осадок серы, в соответствии с уравнением: Na2S2O3 + H2SO4 ® Na2SO4 + SO2 + S¯ + H2O. Вычислите относительную скорость реакции по формуле:
Результаты занесите в таблицу:
Найденную зависимость скорости от концентрации изобразите графически, отложив по оси абсцисс концентрацию тиосульфата, а по оси ординат - относительную скорость. Сделайте вывод.
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 1327; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.203.204 (0.009 с.) |

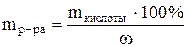
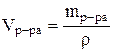 ,
,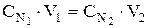 ,
, - нормальность раствора щелочи;
- нормальность раствора щелочи; - нормальность исследуемого раствора кислоты.
- нормальность исследуемого раствора кислоты. .
. , где t – время (по секундомеру), в секундах.
, где t – время (по секундомеру), в секундах.


