
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные классификации: по дисперсности, агрегатному состоянию вещества, структуре, межфазному взаимодействию. Получение дисперсных систем.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Основные разделы и методы. Содержание и задачи курса. Общенаучное и практическое значение науки о поверхностных явлениях и дисперсных системах. Исторические этапы развития науки. Основные направления современной коллоидной химии – это термодинамика поверхностных явлений, адсорбция и контактные явления на границах раздела фаз, образование и устойчивость дисперсных систем, физико-химические свойства дисперсных систем, кинетика и механизмы технологических процессов и природных явлений с участием дисперсных систем. Коллоидная химия служит базой для изучения реальных дисперсных систем в живой природе, горных породах, промышленных материалах, а также для обоснования многих технологических процессов в промышленности. Поскольку все продукты питания относятся к дисперсным системам, законы коллоидной химии приобретают первостепенную важность для понимания технологических процессов в пищевой промышленности. В России М.В. Ломоносов – основоположник отечественной физической химии. В 1751г. он изучал эффекты кристаллизации и коагуляции. Разработал методы получения цветных стекол. Т.Е. Ловиц в 1789г. успешно использовал адсорбцию на угле для очистки сахарного сиропа, растительного масла и др.прод. Ф.Ф. Рейс в 1808г. впервые исследовал электрокинетические явления. Отцом современной коллоидной химии считают англ. химика Т. Грэма, который в 1861 году определил и ввел в химию понятие «коллоид». Т.Грэм исследовал диффузию различных веществ через растительные и биологические мембраны. Дж.Гиббс в 70-е годы XIX века заложил основы термодинамики поверхностных процессов. Примерно в то же время Д.И. Менделеев высказал идею о возможности получать любое вещество в коллоидном состоянии. В начале XX века И. Ленгмюр, Н.А.Шилов, М.Поляни и др. исследователи выполнили фундаментальные работы по изучению механизма адсорбционных процессов. Эти работы получили развитие в исследованиях Г.Фрейндлиха, Н.П. Пескова, М.М. Дубинина, Н.Адама. М.Смолуховский и А.Эйнштейн выполнили основополагающие исследования в области молекулярно-кинетических явлений в дисперсных системах. В середине XX века Б.В. Дерягин высказал идеи о расклинивающем давлении в дисперсных системах. Его идеи в дальнейшем были развиты другими учеными (Л.Д.Ландау, Е.И.Фервеем и Дж. Овербеком) и положены в основу теории устойчивости коллоидных систем. Теория двойного слоя на частицах дисперсной фазы была создана Г. Квинке, М Смолуховским и др. Значительный вклад в развитие коллоидной химии внес П.А Ребиндер с сотрудниками, которые развили физико-химическую механику до современного уровня. 2.Мицеллообразование. Понятие о ККМ. Строение мицелл. Мицеллы ПАВ в водных растворах. Моющее действие мыл. Мицеллы- нейтральные частицы дисперсной фазы коллоидных размеров, равномерно распределенные в дисперсионной среде. Мицеллообразование в растворах полуколлоидов протекает самопроизвольно, без введения стабилизатора. Мицеллообразование становится возможным при достижении в растворе некоторой критической концентрации полуколлоида (ККМ).ККМ-это сравнительно узкий интервал концентраций, обозначающих предел, ниже которого мицелла практически не обнаруживается, а выше которого практически все добавляемые ПАВ образуют мицеллы. Состав и форма мицеллы определяется концентрацией молекул полуколлоидов. Мицеллы могут быть сферическими, плоскими, цилиндрическими. Число молекул связывающих мицеллу, называют числом агрегации, а произведение мицеллы на число Авогадро- мицеллярной массой. Мицеллу полуколлоидов обычно представляют как некоторое довольно однородное образование из дифильных молекул, полярные группы которых обращены к полярному растворителю, а неполярные радикалы переплетены друг с другом, образуя ядро мицеллы. Вокруг ядра, состоящего из углеводородных радикалов, образуется двойной электрический слой за счет диссоциации ионогенных групп. Поверхность частицы при этом гидратируется. Этим в частности объясняется растворимость мыл в воде. При разбавлении растворов мицеллы распадаются на отдельные молекулы или ионы, в чем проявляется обратимый характер мицеллярных систем ПАВ. Признаки мицеллообразующего ПАВ:1)достаточно низкое значение ККМ, 2)отсутствие при концентрациях, равных или выше ККМ, ассоциатов с числами агрегации (q), существенно меньшими среднего,3)резкий рост q в области ККМ (до значений не менее 20) и его неизменность с дальнейшим увеличением концентрации ПАВ, 4) зависимость кооперативности процесса мицеллообразования от велчины q, тем вышекоопер-ть процесса и тем в более узком концентрационном интервале лежит ККМ. ККМ явл-ся важнейшей хар-кой ПАВ Моющее действие мыл – это совокупность коллоидно–химических процессов, которые приводят к удалению загрязнений с различных поверхностей и удержанию этих загрязнений в растворе. Оптимальным моющим действием при 25-35ºС обладают ПАВ с алкильной цепью С12-С14. Общетермпдинамические оценки возможности отделения примесей заключаются в оценках изменения поверх-ной энергии при отрыве частицы грязи от пов-ти тела. Оценку можно выполнить: ΔG = σв-ж +σт-в +σт-ж.Самопроизвольный отрыв частицы произойдет при условии: σт-ж ≥σв-ж +σт-в Растворы мыл являются лиофильными термодинамическими устойчивыми обратимыми системами. В равновесии находятся формы мицелл, недиссоциированные молекулы, а также ионы. С повышением температуры и уменьшением концентрации равновесие сдвигается в сторону диссоциации мицелл на молеклы о ионы. В механизме моющего действия обычно выделяют три стадии: 1)смачивание изделия водой;2)вытеснение с поверхности изделия загрязненителя;3)стабилизация загрязнения в растворе. Эффективность первого этапа определяется прежде всего способностью ПАВ уменьшать поверхностное натяжение на границе раздела ткань- загрязнение. Возможными вариантами второй стадии могут быть:1) десорбция грязи вследствие ее вытеснения с поверхности молекулами ПАВ, которые обладают лучшими адсорбционными свойствами;2)солюбилизация загрязнений мицеллами ПАВ. Солюбилизация – это самопроизвольное растворение в воде под действием добавок коллоидных ПАВ обычно не растворимых в воде веществ. Вещество, которое растворяется в мицелле, наз-ся солюбилизат. В процессе солюбилизации мицеллы полуколлоидов втягивают внутрь частицы загрязнений. Обьем мицелл увеличивается. Этот эффект лежит в основе механизма моющего действия ПАВ. 3.Для коагуляции 10 -3 золя гидроксида алюминия требуется 10 мл раствора сульфата алюминия с концентрацией 0,01 кмоль/м3. Определите порог коагуляции золя. Порог коагуляции золя определяется по формуле спк=(сэлVэл1000)/Vз; Дано: сэл=0,01 кмоль/м3 Vэл=10мл Vз=10-3 м3, учитывая, что 1л=10-3 м3=103 см3 спк=(0,01·103 моль/м3 ·10-2 л·1000)/1л=105 ммоль/м3 Поверхностные явления как результат межфазного взаимодействия. Классификация поверхностных явлений: адсорбция, абсорбция, капиллярная конденсация, адгезия, когезия, смачивание поверхностей. Поверхностное натяжение. Среди поверхностных явлений выделяют: фазовые переходы, на границе раздела фаз; контактные взаимодействия; сорбцию; смачивание. Фазовые переходы возникают при изменении термодинамических условий существования системы. Процесс заключается в переходе вещества из одной фазы в другую. Поскольку любая фаза ограничена некоторой поверхностью, фазовый переход протекает на границе раздела фаз. Стержневой характеристикой фазового перехода является температура, при которой он происходит. Значение температуры фазового перехода зависит от степени дисперсности частиц дисперсной фазы. Для сферических частиц температура фазового перехода можно оценить:
dG = -SdT + Vdp + σds + Σμidni + φdq,где G-энергия Гиббса, S-энтропия, T-температура, V-объем, p-давление, σ-поверхностное натяжение,s-площадь,μi-химический потенциал компонента i, ni –число молей компонента i, φ-электрический потенциал, q-количество электричества. Составляющие этого ур-я σds-пов-я энергия, Σμidni –массовая энергия определяют величину свободной энергии в целом ты другими учеными (Л.Д.ии в дисперсных системах.ких явлений в дисперсных системах. важность, а значит, и характер процесса, который можно оценить, исходя из принципа термодинамики: «любой процесс протекает самопроизвольно, если уменьшается полная энергия системы» Поэтому поверхностные явления, устойчивость или разрушение зависят от соотношений этих видов энергии. Поверхностное натяжение -термодинамическая характеристика поверхности раздела фаз, определяемая как работа обратимогог изотермического образования единицы площади поверхности раздела фаз. σ = W/s, где σ – коэффициент пов-го натяжения, W –работа, затрачиваемая на образование (разрушение) поверхности, s – площадь поверхности раздела фаз. Поверхностное натяжение можно выразить как частную производную от любой термодинамической функции по площади межфазной границы при постоянных термодин-х параметрах, опред-х условия процесса. Для чистой жидкости σ=(ΔG)/(Δs). Эта формула раскрывает физ. смысл пов-го натяжения, которое прдставляется как энергия образования единицы поверхности тела, состоящего из чистого вещества. Электрофорез Электрическая цепь с двумя электродами, соединенными ч/з влажную глину (2 стеклянные трубки погрузили во влажную глину и наполнили водой, в эти же трубки ввели металлические пластины). Подали напряжение постоянного тока→удаление частиц глины с пов-ти трубки и перемещение их к электроду (аноду), т.к. они заряжены отрицательно, поэтому они перемещаются под действием эл.поля. Частицы дисперсной фазы др. систем могут быть заряжены «+» или вовсе не иметь заряда, находясь в изоэлектрическом состоянии. «+» заряженные частицы движутся к катоду (катофорез), «-» заряженные- к аноду (анафорез), а на незаряженные частицы в эл.поле не действует. Эффект седиментации ( эффект Дорна ) При механическом движении твердых частиц в жидкой фазе на электродах, находящихся в жидкости, возникает скачок потенциала – потенциал протекания. Связь дзета-потенциала со скоростью движения частиц дисп.фазы (u) любой формы: u где ε0 и ε – относит.диэлектрическая проницаемость и электрическая постоянная, κδ – коэффициент, величина которого определяется отношением радиуса частицы r к толщине диффузного слоя δ, η – вязкость среды, E – напряжение приложенного эл.поля, l – расстояние между электродами. Если u предпочтительнее использовать метод потенциала течения:
35. что такое частичная концентрация? Какие методы ее определения вы знаете? Для оценки концентрации золя и др. дисп.систем определяют численную концентрацию. Частичная концентрация – число частиц (Nф) в единичном объеме дисп.системы (Vс), т.е. число частиц в 1 м3,
Если проинтегрировать данное ур-ие в пределах от υ = υ0 при τ = 0 до υτ при τ, то:
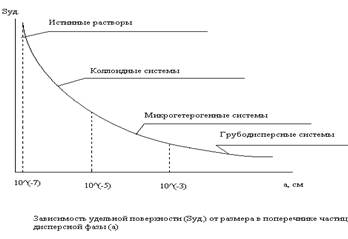
Основные разделы и методы. Содержание и задачи курса. Общенаучное и практическое значение науки о поверхностных явлениях и дисперсных системах. Исторические этапы развития науки. Основные направления современной коллоидной химии – это термодинамика поверхностных явлений, адсорбция и контактные явления на границах раздела фаз, образование и устойчивость дисперсных систем, физико-химические свойства дисперсных систем, кинетика и механизмы технологических процессов и природных явлений с участием дисперсных систем. Коллоидная химия служит базой для изучения реальных дисперсных систем в живой природе, горных породах, промышленных материалах, а также для обоснования многих технологических процессов в промышленности. Поскольку все продукты питания относятся к дисперсным системам, законы коллоидной химии приобретают первостепенную важность для понимания технологических процессов в пищевой промышленности. В России М.В. Ломоносов – основоположник отечественной физической химии. В 1751г. он изучал эффекты кристаллизации и коагуляции. Разработал методы получения цветных стекол. Т.Е. Ловиц в 1789г. успешно использовал адсорбцию на угле для очистки сахарного сиропа, растительного масла и др.прод. Ф.Ф. Рейс в 1808г. впервые исследовал электрокинетические явления. Отцом современной коллоидной химии считают англ. химика Т. Грэма, который в 1861 году определил и ввел в химию понятие «коллоид». Т.Грэм исследовал диффузию различных веществ через растительные и биологические мембраны. Дж.Гиббс в 70-е годы XIX века заложил основы термодинамики поверхностных процессов. Примерно в то же время Д.И. Менделеев высказал идею о возможности получать любое вещество в коллоидном состоянии. В начале XX века И. Ленгмюр, Н.А.Шилов, М.Поляни и др. исследователи выполнили фундаментальные работы по изучению механизма адсорбционных процессов. Эти работы получили развитие в исследованиях Г.Фрейндлиха, Н.П. Пескова, М.М. Дубинина, Н.Адама. М.Смолуховский и А.Эйнштейн выполнили основополагающие исследования в области молекулярно-кинетических явлений в дисперсных системах. В середине XX века Б.В. Дерягин высказал идеи о расклинивающем давлении в дисперсных системах. Его идеи в дальнейшем были развиты другими учеными (Л.Д.Ландау, Е.И.Фервеем и Дж. Овербеком) и положены в основу теории устойчивости коллоидных систем. Теория двойного слоя на частицах дисперсной фазы была создана Г. Квинке, М Смолуховским и др. Значительный вклад в развитие коллоидной химии внес П.А Ребиндер с сотрудниками, которые развили физико-химическую механику до современного уровня. 2.Мицеллообразование. Понятие о ККМ. Строение мицелл. Мицеллы ПАВ в водных растворах. Моющее действие мыл. Мицеллы- нейтральные частицы дисперсной фазы коллоидных размеров, равномерно распределенные в дисперсионной среде. Мицеллообразование в растворах полуколлоидов протекает самопроизвольно, без введения стабилизатора. Мицеллообразование становится возможным при достижении в растворе некоторой критической концентрации полуколлоида (ККМ).ККМ-это сравнительно узкий интервал концентраций, обозначающих предел, ниже которого мицелла практически не обнаруживается, а выше которого практически все добавляемые ПАВ образуют мицеллы. Состав и форма мицеллы определяется концентрацией молекул полуколлоидов. Мицеллы могут быть сферическими, плоскими, цилиндрическими. Число молекул связывающих мицеллу, называют числом агрегации, а произведение мицеллы на число Авогадро- мицеллярной массой. Мицеллу полуколлоидов обычно представляют как некоторое довольно однородное образование из дифильных молекул, полярные группы которых обращены к полярному растворителю, а неполярные радикалы переплетены друг с другом, образуя ядро мицеллы. Вокруг ядра, состоящего из углеводородных радикалов, образуется двойной электрический слой за счет диссоциации ионогенных групп. Поверхность частицы при этом гидратируется. Этим в частности объясняется растворимость мыл в воде. При разбавлении растворов мицеллы распадаются на отдельные молекулы или ионы, в чем проявляется обратимый характер мицеллярных систем ПАВ. Признаки мицеллообразующего ПАВ:1)достаточно низкое значение ККМ, 2)отсутствие при концентрациях, равных или выше ККМ, ассоциатов с числами агрегации (q), существенно меньшими среднего,3)резкий рост q в области ККМ (до значений не менее 20) и его неизменность с дальнейшим увеличением концентрации ПАВ, 4) зависимость кооперативности процесса мицеллообразования от велчины q, тем вышекоопер-ть процесса и тем в более узком концентрационном интервале лежит ККМ. ККМ явл-ся важнейшей хар-кой ПАВ Моющее действие мыл – это совокупность коллоидно–химических процессов, которые приводят к удалению загрязнений с различных поверхностей и удержанию этих загрязнений в растворе. Оптимальным моющим действием при 25-35ºС обладают ПАВ с алкильной цепью С12-С14. Общетермпдинамические оценки возможности отделения примесей заключаются в оценках изменения поверх-ной энергии при отрыве частицы грязи от пов-ти тела. Оценку можно выполнить: ΔG = σв-ж +σт-в +σт-ж.Самопроизвольный отрыв частицы произойдет при условии: σт-ж ≥σв-ж +σт-в Растворы мыл являются лиофильными термодинамическими устойчивыми обратимыми системами. В равновесии находятся формы мицелл, недиссоциированные молекулы, а также ионы. С повышением температуры и уменьшением концентрации равновесие сдвигается в сторону диссоциации мицелл на молеклы о ионы. В механизме моющего действия обычно выделяют три стадии: 1)смачивание изделия водой;2)вытеснение с поверхности изделия загрязненителя;3)стабилизация загрязнения в растворе. Эффективность первого этапа определяется прежде всего способностью ПАВ уменьшать поверхностное натяжение на границе раздела ткань- загрязнение. Возможными вариантами второй стадии могут быть:1) десорбция грязи вследствие ее вытеснения с поверхности молекулами ПАВ, которые обладают лучшими адсорбционными свойствами;2)солюбилизация загрязнений мицеллами ПАВ. Солюбилизация – это самопроизвольное растворение в воде под действием добавок коллоидных ПАВ обычно не растворимых в воде веществ. Вещество, которое растворяется в мицелле, наз-ся солюбилизат. В процессе солюбилизации мицеллы полуколлоидов втягивают внутрь частицы загрязнений. Обьем мицелл увеличивается. Этот эффект лежит в основе механизма моющего действия ПАВ. 3.Для коагуляции 10 -3 золя гидроксида алюминия требуется 10 мл раствора сульфата алюминия с концентрацией 0,01 кмоль/м3. Определите порог коагуляции золя. Порог коагуляции золя определяется по формуле спк=(сэлVэл1000)/Vз; Дано: сэл=0,01 кмоль/м3 Vэл=10мл Vз=10-3 м3, учитывая, что 1л=10-3 м3=103 см3 спк=(0,01·103 моль/м3 ·10-2 л·1000)/1л=105 ммоль/м3 Основные классификации: по дисперсности, агрегатному состоянию вещества, структуре, межфазному взаимодействию. Получение дисперсных систем. Дисперсная система-это гетерогенная система, одна из фаз которой представляет собой непрерывную дисперсионную среду, а другие фазы равномерно распределены в ней в виде мелких частиц. В дисперсной системе выделяют непрерывную дисперсионную среду и дисперсионную фазу. Агрегатное состояние вещества в разных фазах может быть любым: жидким, твердым, газообразным. Основными признаками дисперсионного состояния являются гетерогенность, дисперсность и высокая поверхностная энергия у частиц дисперсной фазы. Классификация по дисперсности: Дисперсность (радробленность) до размеров частиц от 10-7 до 10-1 см. Количественными характеристиками дисперсности служат удельная поверхность Sуд. и степень дисперсности D.
Свободнодисперсные хар-ся тем, что в них отдельные частицы дисперсной фазы не связаны между собой и могут независимо перемещаться в дисперсионной среде под влиянием теплового движения и силы тяжести. Они обладают свойствами, характерными для любых жидкостей вязкостью, текучестью и т.д. Примеры: лиозоли, разбавленные эмульсии и суспензии, аэрозоли. Среди пищевых продуктов –молоко, сметана, напитки и др. Связнодисперсные явл-ся структурированными системами. Частицы дисперсной фазы в них связаны молекулярными силами и образуют в дисперсионной среде пространственные сетки или структуры. К типичным структурированным системам можно отнести высококонцентрированные эмульсии, слежавшиеся порошки, гели (дисперсные системы, полученные из плохо растворимых осадков в результате возникновения и упрочнения связей между отдельными частицами), студни. Гели представляют собой твердые или твердообразные вещества. Классификация по способности частиц дисп. фазы взаимодействовать с растворителем. Если р-ль вода, то системы наз-ся гидрофильными, если р-ль спирт – алкофильными, бензол – бензофильными; в общем случае – лиофильные, если частицы дисперсной фазы не взаимодействуют с р-лем – лиофобные. Классификация по виду частиц дисперсной фазы. Одномерная-дисперсность опре-ся лишь одним размером, а два других размера показывают габариты тела (тонкие пленки). Двухмерная – дисперсность опре-ся двумя измерениями размеров частиц дисп. фазы (волокна, нити, капилляры, поры). Трехмерная – дисперсность опред-ся тремя измерениями частиц дисп. фазы.(тверд. частицы,капли, пузырьки газа) Получение дисперсных систем. Делятся на две группы: методы первой – диспергирование (измельчение) твердых частиц, в методах второй – вещество дисперсной фазы получается в результате химической или физической конденсации из систем с более высокой степенью дисперсности (растворов, газов, паров).Промежуточное место занимает пептизация. Условия для получения коллоидных систем 1)малая растворимость вещества дисперсной фазы в дисперсионной среде; 2) наличие в дисперсионной среде веществ, которые могут стабилизировать образующиеся коллоидные частицы. 5.Пены. Способы получения пен. Строение и свойства пены. Пена – лиофобная дисперсная система с газовой дисперсной фазой и жидкой или твердой дисперсионной средой. Условно обозначают г/ж и г/т. Пены можно отнести как к грубодисперсным так и к микрогетерогенным системам. Грубодисперсными они считаются с учетом значительных размеров объема газовой фазы. Микрогетерогенность пен связывают с микроразмерами пленок, образующих газовую оболочку. Конфигурация пен бывает разной. Бывают пены из почти сферических пузырьков, разделенных толстыми пленками жидкости. А чаще всего бывают полиэдрические(более устойчивые). Пузырьки газа разделены тонкими прослойками жидкой дисперсионной среды(показано серым цветом).В зоне соприкосновения трех пленок (трех соприкасающихся пузырьков) образуется канал Плато, куда и выдавливается жидкость. В каждой вершине ячейки сходятся четыре канала, образуя угол 109º28´. Место пересечения каналов называется узлом. Каналы пронизывают всю структуру пены, составляя цельную систему, которая в разрезе напоминает соты.Такая конструкция хар-ся минимальной поверхностной энергией и явл-ся поэтому более устойчивой. При хранении пузырек пены может изменять размеры, становиться больше за счет слияния с другими или вовсе лопаться.
|
||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 463; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.178.145 (0.017 с.) |

 где Т∞ и Тд- температуры фазового перехода недиспергированного и диспергированного веществ соответственно; Vм- мольный объем; ∆Нф.п. –тепловой эффект фазового перехода; r- радиус частиц дисперсной фазы. К контактным взаимодействиям относят адгезию(прилипание), когезию, и аутогезию. Адгезия – сцепление приведенных в контакт разнородных тел(фаз). Одна из фаз,адгезив, представляет собой клеящее вещество (в основном в жидком состоянии),другая, субстрат, это тело(ж или т), на поверхность которого наносят адгезив. Причиной адгезии м/б как межмолекулярное взаимодействие так и образование химических связей. Когезия определяет связь между частицами (молекулами, атомами, ионами)внутри тела в пределах одной фазы. Причиной когезии явл-ся межмолек. взаимод-е внутри однородного тела. Поэтому когезия- это мера прочности тела, его способности противостоять разрыву. Аутогезия характеризует взаимодействие отдельных твердых частиц. На практике аутогезия проявляется при контакте между частицами сыпучих материалов (сахар-песок, мука и др.), вызывая их комкование. Сорбция заключается в самопроизвольном поглощении одного вещества(сорбтива) другим веществом (сорбентом). Она включает след. явления: абсорбцию (объемное концентрирование), адсорбцию (перераспределение компонентов системы между поверхностным слоем и объемной фазой или поверхностное концентрирование), капиллярную конденсацию (сжижение паров в порах сорбента); смачивание – поверхностное явление, близкое по характеристикам к адгезии, оно проявляется в самопроизвольном взаимодействии смачивающей жидкости с поверхностью тв. тела или другой жидкости. Объединяющими признаками названных явлений явл-ся то, что они происходят на межфазных поверхностях, обладающих значительной избыточной энергией, которая при опр. усл-ях может доминировать в изменении энергии в целом. Это положение становится очевидным при анализе осн. ур-я термодинамики, записанного для изменения энергии Гиббса для гетерогенных процессов (с учетом вкладов разл. видов энергии):
где Т∞ и Тд- температуры фазового перехода недиспергированного и диспергированного веществ соответственно; Vм- мольный объем; ∆Нф.п. –тепловой эффект фазового перехода; r- радиус частиц дисперсной фазы. К контактным взаимодействиям относят адгезию(прилипание), когезию, и аутогезию. Адгезия – сцепление приведенных в контакт разнородных тел(фаз). Одна из фаз,адгезив, представляет собой клеящее вещество (в основном в жидком состоянии),другая, субстрат, это тело(ж или т), на поверхность которого наносят адгезив. Причиной адгезии м/б как межмолекулярное взаимодействие так и образование химических связей. Когезия определяет связь между частицами (молекулами, атомами, ионами)внутри тела в пределах одной фазы. Причиной когезии явл-ся межмолек. взаимод-е внутри однородного тела. Поэтому когезия- это мера прочности тела, его способности противостоять разрыву. Аутогезия характеризует взаимодействие отдельных твердых частиц. На практике аутогезия проявляется при контакте между частицами сыпучих материалов (сахар-песок, мука и др.), вызывая их комкование. Сорбция заключается в самопроизвольном поглощении одного вещества(сорбтива) другим веществом (сорбентом). Она включает след. явления: абсорбцию (объемное концентрирование), адсорбцию (перераспределение компонентов системы между поверхностным слоем и объемной фазой или поверхностное концентрирование), капиллярную конденсацию (сжижение паров в порах сорбента); смачивание – поверхностное явление, близкое по характеристикам к адгезии, оно проявляется в самопроизвольном взаимодействии смачивающей жидкости с поверхностью тв. тела или другой жидкости. Объединяющими признаками названных явлений явл-ся то, что они происходят на межфазных поверхностях, обладающих значительной избыточной энергией, которая при опр. усл-ях может доминировать в изменении энергии в целом. Это положение становится очевидным при анализе осн. ур-я термодинамики, записанного для изменения энергии Гиббса для гетерогенных процессов (с учетом вкладов разл. видов энергии): , ур-ие Смолуховского – Гельмгольца – Генри
, ур-ие Смолуховского – Гельмгольца – Генри r/ δ
r/ δ 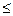 1 (для сферических коллоидных частиц, окруженных обширным диффузным слоем) κδ =0,66, тогда:
1 (для сферических коллоидных частиц, окруженных обширным диффузным слоем) κδ =0,66, тогда: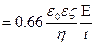
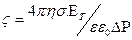 , где ЕТ – потенциал течения, ΔΡ – перепад давления при течении дисп.среды, σ – удельная электропроводность дисп.среды.
, где ЕТ – потенциал течения, ΔΡ – перепад давления при течении дисп.среды, σ – удельная электропроводность дисп.среды. , выражается в м-3, также можно найти из определения скорости коагуляции:
, выражается в м-3, также можно найти из определения скорости коагуляции: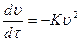 где К – константа скорости коагуляции, υ – частичная концентрация, τ – время коагуляции
где К – константа скорости коагуляции, υ – частичная концентрация, τ – время коагуляции а также
а также 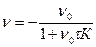 .
. Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды: г/г (атмосфера Земли), ж/г (туманы пар, облака) т/г (порошки, табачный дым,ткани,нити) г/ж (мыльная пена, пивная пена) ж/ж (молоко, майонез, кремы) т/ж (дисперсии в водах, бактерии, пасты) г/т (хлеб, пористые тела в газе, сыр, силикагель) ж/т (растения, яичница, кисели) т/т (минералы, сплавы, уголь). Также различают свободнодисперсные и связнодисперсные системы
Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды: г/г (атмосфера Земли), ж/г (туманы пар, облака) т/г (порошки, табачный дым,ткани,нити) г/ж (мыльная пена, пивная пена) ж/ж (молоко, майонез, кремы) т/ж (дисперсии в водах, бактерии, пасты) г/т (хлеб, пористые тела в газе, сыр, силикагель) ж/т (растения, яичница, кисели) т/т (минералы, сплавы, уголь). Также различают свободнодисперсные и связнодисперсные системы Получение пены. Жидкие пены получают в присутствии стабилизатора при пропускании газа через раствор или при технологическом процессе, связанном со встряхиванием, бурным перемешиванием либо выделением газа в результате химических реакций. Для получения твердых тел чаще всего применяют методы вспенивания и пеносушки. Вспенивание выполняют в жидкой фазе. При снижении давления или повышении температуры растворимость газа в ней падает и он бурно выделяется. В присутствии пенообразователя возникает обильная пена. Подобный процесс происходит при открывании бутылки пива. Твердая пена получается если пенообразователь полимеризуется, превращаясь в твердое вещество. Пеносушка состоит в приготовлении вспененной массы с одновременным сублимационным высушиванием продукта. Образование пены ускоряет процесс сушки, т.е. переход жидкой фазы в твердую.
Получение пены. Жидкие пены получают в присутствии стабилизатора при пропускании газа через раствор или при технологическом процессе, связанном со встряхиванием, бурным перемешиванием либо выделением газа в результате химических реакций. Для получения твердых тел чаще всего применяют методы вспенивания и пеносушки. Вспенивание выполняют в жидкой фазе. При снижении давления или повышении температуры растворимость газа в ней падает и он бурно выделяется. В присутствии пенообразователя возникает обильная пена. Подобный процесс происходит при открывании бутылки пива. Твердая пена получается если пенообразователь полимеризуется, превращаясь в твердое вещество. Пеносушка состоит в приготовлении вспененной массы с одновременным сублимационным высушиванием продукта. Образование пены ускоряет процесс сушки, т.е. переход жидкой фазы в твердую.


