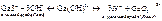Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Билет 3. Периодический закон Д. И. Менделеева, как основа развитий неорганической химии, его значение. Современнная фор-ка периодического закона.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Билет2. Характеристика энергетического состояния электрона квантовыми числами. Расположение электронов во многоэлектронных атомах. Принцип мин энергии. Принцип запрети Паули. Правило Гунда. Правило Клечковского. Максимальное число электронов на энергетических уровнях и подуровнях. Для характеристики поведения электрона в атоме введены квантовые числа. n – энергия и размеры квантовых орбиталей (1..7) Электроны с одинаковыми n образуютэлектронные уровни. Чем больше n, тем больше энергия. Орбитальное квантовое число l (0…n-1) характеризует форму орбиталей и энергетическое состояние электрона на подуровне. Различная форма орбиталей обусловлена различной энергией электрона в пределах одного уровня. Подуровни обозначаются буквами: L=0 – s L=1 – p L=2 – d L=3 – f Es<Ep<Ed<Ef Магнитное квантовое число m характеризует ориентацию орбиталей в пространстве и и принимает значение от –l до l. Каждому l соответствует 2l+1 возможных расположений орбитали в пр-ве. Состояние электрона в атоме характеризуется определёнными размерами, формой и ориентацией в пространстве электронного облака – атомная орбиталь. S ф P ф ф ф D ф ф ф ф ф F ф ф ф ф ф ф Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси (спин). Вращение электрона может происходить как по часовой стрелке, так и против. Ms= +½; -½ Запись распределения электронов по уровням, Билет 3. Периодический закон Д. И. Менделеева, как основа развитий неорганической химии, его значение. Современнная фор-ка периодического закона. В основу систематизации элементов Менделеев положил их фтомную массу. Расположив все элементы в порядке возрастания атомной массы, Менделеев обнаружил, что сходные в химическом отношении элементы встречаются через определённые интервалы и свойства их периодически повторяются. «Свойства простых тел, а также форма и свойства соединений элементов ПСХЭ отражает элементарное строение атомов в виде рядов, групп и периодов. Период – ряд элементов, в пределах которого свойства изменяются последовательно и происходит заполнение одинакового числа электронных уровней. При этом номер периода соответствует числу заполненных уровней. Каждый период начин. щелочным металлом и заканч-ся благородным газом. С ростом порядкового номера металлич. св-ва эл-ов ослабевают, а неметаллические усиливаются. Билет 5. Периодическое изменение св-в хим. эл. Атомные радиусы, энергия ионизации, сродство к электрону, электроотрицательность, изменение их в периодах и группах. Т.к. электронное строение элементов изменяется периодически, то соответственно периодически изменяются свойства элементов. 1.Энергия ионизации. Энергия, необходимая для удаления одного электрона от атома элемента называется первой энергией ионизации. Энергия ионизации характеризует восстановительную способность элементов. Она возрастает по периоду. В одной и той же группе энергия ионизации уменьшается с увеличением порядкового номера элемента, что обусловлено увеличением размеров атомов и расстоянием внешних подуровней от ядра. 2.Сродство к электрону. Энергия, выделяющаяся при присоединении одного моля электронов к одному молю нейтронов атомов называется сродством к электронов. Под хим/св. понимают различные виды взаимодействий обуславливающие устойчивое существование соединений молекул ионов, кристаллов веществ и сопровождающихся уменьшением потенциальной энергии системы Билет 7. Ковалентная связь. Изменение потенциальной энергии. Ковалентная связь – хим/св. образованная путём обобщения пары электронов двумя атомами. При сближении атомов водорода происходит вхождение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков. Электронной плотностью между ядрами возрастает, ядра притягиваются друг к другу, вследствие этого энергия системы снижается. При совпадающем Билет 8. Основные положения метода валентных связей. Этот метод является приближенным методом расчета в распределении плотности в молекулах. 1). Хим/св. между атомами возникают как результат перекрывания атомных орбиталей с образованием электронных пар. 2). Атомы вступающие в хим/св. обмениваются между собой электронами. 3). Хим/св. образуется лишь при взаимодействии электронами с антипараллельными спинами. 4). Энергия, длина, полярность ковалентной связи Билет 20. Необратимые и обратимые процессы. Химическое равновесие в гомогенных и гетерогенных системах. Константа равновесия. Смещение химического равновесия. Принцип Ле- Шаталье. Влияние температуры, давления и концентрации на смещение химического равновесия. Необратимые р. протек. До конца до полного расходования 1го из реагирующих в-в. Zn+2HCl=ZnCl2+H2 Реак. кот могут одноврем. протек. в прямом и в обрат. направл. наз. обратимыми N2(г)+3H2(г)=2NH3(г)
В начальн. момент вр. концентр. АВ=0, а концентр. А и В максимальны. Скор. прямой р. максим., а обрат.=0. По мере протек. р. исходн. в-ва расходуются и их концюпадает в рез. этого < скор. прямой р. одновр. появл-ся продукты р. и их конц. в след. Этого начинает идти обрат. р. и скор. ее постоянно увелич-ся. Kp=K1/K2=[AB]/[A]*[B] Отношение констант скоростей прямой и обрат. р. наз. константой хим. равновесия К, кот. = отношению произведения равновесных концентраций исход. в-в, взятых в степенях стехеометрических коэф. Значение константы равновесия зав. от прир. Реаг. в-в и Т0 но не зав. от концентр. в-в. По велич. Константы равновесия судят о полноте пртекания р. Для необратимой р K стреи. к бескон-ти, поскольку равновесные концентр. продуктов р. на много превыш. Конц. исход. в-в. Если К стрем. к бескон. это свидетельствует о Билет 34. Кислоты, основания, соли, с точки зрения электролитической диссоциации. Ступенчатая диссоциация кислот и оснований. Характер диссоциации средних, кислых, основных, двойных солей. Амфотерные электролиты. Кислота – электролит, диссоциирующий с образованием ионов водорода H+: HCl «H+ + Cl- Чем больше константа диссоциации тем больше диссоциирована кислота. Двух и многоосновные кислоты диссоциируют ступенчато:
Основание - электролит, диссоциирующий с образованием ионов OH-: KOH «K + OH- Чем больше константа диссоциации основания тем оно сильнее. Двух и много - кислотные основания диссоциируют ступенчато:
CaOH+ Амфотерные электролиты - электролиты, диссоциирующие как кислоты и как основания:
Билет2. Характеристика энергетического состояния электрона квантовыми числами. Расположение электронов во многоэлектронных атомах. Принцип мин энергии. Принцип запрети Паули. Правило Гунда. Правило Клечковского. Максимальное число электронов на энергетических уровнях и подуровнях. Для характеристики поведения электрона в атоме введены квантовые числа. n – энергия и размеры квантовых орбиталей (1..7) Электроны с одинаковыми n образуютэлектронные уровни. Чем больше n, тем больше энергия. Орбитальное квантовое число l (0…n-1) характеризует форму орбиталей и энергетическое состояние электрона на подуровне. Различная форма орбиталей обусловлена различной энергией электрона в пределах одного уровня. Подуровни обозначаются буквами: L=0 – s L=1 – p L=2 – d L=3 – f Es<Ep<Ed<Ef Магнитное квантовое число m характеризует ориентацию орбиталей в пространстве и и принимает значение от –l до l. Каждому l соответствует 2l+1 возможных расположений орбитали в пр-ве. Состояние электрона в атоме характеризуется определёнными размерами, формой и ориентацией в пространстве электронного облака – атомная орбиталь. S ф P ф ф ф D ф ф ф ф ф F ф ф ф ф ф ф Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси (спин). Вращение электрона может происходить как по часовой стрелке, так и против. Ms= +½; -½ Запись распределения электронов по уровням, Билет 3. Периодический закон Д. И. Менделеева, как основа развитий неорганической химии, его значение. Современнная фор-ка периодического закона. В основу систематизации элементов Менделеев положил их фтомную массу. Расположив все элементы в порядке возрастания атомной массы, Менделеев обнаружил, что сходные в химическом отношении элементы встречаются через определённые интервалы и свойства их периодически повторяются. «Свойства простых тел, а также форма и свойства соединений элементов ПСХЭ отражает элементарное строение атомов в виде рядов, групп и периодов. Период – ряд элементов, в пределах которого свойства изменяются последовательно и происходит заполнение одинакового числа электронных уровней. При этом номер периода соответствует числу заполненных уровней. Каждый период начин. щелочным металлом и заканч-ся благородным газом. С ростом порядкового номера металлич. св-ва эл-ов ослабевают, а неметаллические усиливаются.
|
||||
|
Последнее изменение этой страницы: 2016-08-25; просмотров: 721; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.82.108 (0.007 с.) |

 Сродство к электрону характеризует окислительную способность элемента. В периоде возрастает с лева на право, в главных подгруппах с верху в низ. 3.Электроотрицательность. Способность атомов в соединении притягивать к себе электроны. Мерой электроотрицательности Х считают энергию
Сродство к электрону характеризует окислительную способность элемента. В периоде возрастает с лева на право, в главных подгруппах с верху в низ. 3.Электроотрицательность. Способность атомов в соединении притягивать к себе электроны. Мерой электроотрицательности Х считают энергию 

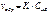 В некот. ммент вр. скор. прямой и обратной р. становятся одинаковым и наступ. равновесие
В некот. ммент вр. скор. прямой и обратной р. становятся одинаковым и наступ. равновесие 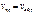 . Количественной характ-ой хим. равновесия служит константа хим. равновесия K1*[A]*[B]=K2*[AB]
. Количественной характ-ой хим. равновесия служит константа хим. равновесия K1*[A]*[B]=K2*[AB]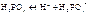

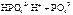 .
.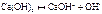
 Ca2+.
Ca2+.