
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Билет 5. Периодическое изменение св-в хим. Эл. Атомные радиусы, энергия ионизации, сродство к электрону, электроотрицательность, изменение их в периодах и группах. ⇐ ПредыдущаяСтр 2 из 2
Т.к. электронное строение элементов изменяется периодически, то соответственно периодически изменяются свойства элементов. 1.Энергия ионизации. Энергия, необходимая для удаления одного электрона от атома элемента называется первой энергией ионизации. Энергия ионизации характеризует восстановительную способность элементов. Она возрастает по периоду. В одной и той же группе энергия ионизации уменьшается с увеличением порядкового номера элемента, что обусловлено увеличением размеров атомов и расстоянием внешних подуровней от ядра. 2.Сродство к электрону. Энергия, выделяющаяся при присоединении одного моля электронов к одному молю нейтронов атомов называется сродством к электронов. Под хим/св. понимают различные виды взаимодействий обуславливающие устойчивое существование соединений молекул ионов, кристаллов веществ и сопровождающихся уменьшением потенциальной энергии системы Билет 7. Ковалентная связь. Изменение потенциальной энергии. Ковалентная связь – хим/св. образованная путём обобщения пары электронов двумя атомами. При сближении атомов водорода происходит вхождение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков. Электронной плотностью между ядрами возрастает, ядра притягиваются друг к другу, вследствие этого энергия системы снижается. При совпадающем Билет 8. Основные положения метода валентных связей. Этот метод является приближенным методом расчета в распределении плотности в молекулах. 1). Хим/св. между атомами возникают как результат перекрывания атомных орбиталей с образованием электронных пар. 2). Атомы вступающие в хим/св. обмениваются между собой электронами. 3). Хим/св. образуется лишь при взаимодействии электронами с антипараллельными спинами. 4). Энергия, длина, полярность ковалентной связи Билет 9. Полярность ков/св. Диполь. Электрический момент диполя. Полярные и неполярные молекулы. Поляризуемость.
Распределение электронной плотности в молекуле с ковалентной связью может быть различна. Если ков/св. один атом (Cl2, H2), то обобществленные электроны равномерно распределяются между ними. Центры тяжести положительных и отрицательных зарядов в них совпадают. Такая связь называется неполярной связью, а атомы неполярными. При взаимодействии двух атомов различных элементов электронное облако смещается в сторону электроотрицательных атомов. У молекулы появляется диполь, центры тяжести положительных и отрицательных зарядов не совпадают. Такая связь и молекула называется полярными. Вследствие смещения электронной пары к одному из ядер повышается плотность Билет 10. Св-ва ков/св. 1). Способность атомов участвующих в образовании ограниченного числа ковалентных связей называется насыщаемостью ков/св. 2). Ков/св. обладает направленностью - область перекрывания электронных облаков взаимодействующих атомов располагающихся в определенном направлении по отношению к взаимодействующим атомам. В зависимости от способа перекрывания атомных орбиталей различают Связь образованная перекрыванием атомных орбиталей по линии соединяющей ядра взаимодействующих атомов называется сигма связью Способ образования ков. связи, когда каждый из взаимодействующих атомов отдает по 1 электрону для образования общей электр. пары назыв. обменным. Во многих случаях образование ков. связи идет и за счет спаренных электронов имеющихся на внешнем энерг. уровне атомов. Азот
|
|||||
|
Последнее изменение этой страницы: 2016-08-25; просмотров: 258; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.185.147 (0.005 с.) |
 Сродство к электрону характеризует окислительную способность элемента. В периоде возрастает с лева на право, в главных подгруппах с верху в низ. 3.Электроотрицательность. Способность атомов в соединении притягивать к себе электроны. Мерой электроотрицательности Х считают энергию
Сродство к электрону характеризует окислительную способность элемента. В периоде возрастает с лева на право, в главных подгруппах с верху в низ. 3.Электроотрицательность. Способность атомов в соединении притягивать к себе электроны. Мерой электроотрицательности Х считают энергию 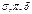 связи.
связи. .Связь образованная перекрыванием
.Связь образованная перекрыванием 


