
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Билеты по химии для 8 класса.Стр 1 из 2Следующая ⇒
Билеты по химии для 8 класса. (по учебнику О.С.Габриелян) 1. Предмет химии. Вещества. Превращения веществ. Человек в мире веществ, материалов и химических реакций. Проблемы безопасного использования веществ и химических реакций в повседневной жизни. Разделение смесей и очистка веществ. Химическое загрязнение окружающей среды и его последствия. 2. Атомы и молекулы. Химический элемент. Строение атома. Состав ядра. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И.Менделеева. 3. Периодический закон и Периодическая система химических элементов 4. Строение молекул. Химическая связь: ковалентная (полярная и неполярная), 5. Химические формулы. Относительная атомная и молекулярная массы. Количество вещества. Молярная масса и молярный объем. 6. Степень окисления химических элементов. Высшая положительная степень окисления, низшая степень окисления. Окислитель и восстановитель. 7. Простые и сложные вещества. Основные классы неорганических веществ. Но- 8. Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях. Расстановка коэффициентов. 9. Классификация химических реакций по различным признакам: количеству и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии. 10. Электролиты и неэлектролиты. Катионы и анионы. Сильные и слабые электролиты. Электролитическая диссоциация кислот, щелочей и солей (средних). Реакции ионного обмена и условия их осуществления. 11. Чистые вещества и смеси. Способы разделения смесей. Правила безопасной работы в школьной лаборатории. 12. Кислоты: определение, классификация, типичные химические свойства. 13. Основания: определение, классификация, типичные химические свойства.
14. Оксиды: определение, классификация, типичные химические свойства. 15. Соли: определение, классификация, типичные химические свойства. 16. Простые вещества металлы и неметаллы. Нахождение в периодической системе элементов Д. И. Менделеева. Аллотропия. Аллотропные видоизменения углерода и кислорода. 17. Генетическая связь между классами веществ. Генетические ряды элементов. 18. Аморфные и кристаллические вещества. Типы кристаллических решеток. Закон постоянства состава вещества.
Задачи Задачи на расчет массы, объема, числа частиц вещества с использованием понятия количества вещества 3) Сколько будут весить 12 * 1023 молекул водорода? 4) Какой объем займут 12 * 1023 молекул водорода? 5) Какой объем займут при н. у. 16 г кислорода? 6) Сколько молекул содержится в воде массой 72 г. 8) Найти массу оксида меди количеством вещества 0,4 моль. 10) Рассчитайте массу 5 л озона (О3). 11) Найдите объём, который при н. у. займут 3 г водорода. 12) Сколько молей содержится в 100 г при нормальных условиях аммиака (NH3)? 13) Какое количество вещества содержится в 1 г воды? 14) Сколько молекул содержится в 342 г гидроксида бария Ва(ОН)2? 15) Какова масса 33,6л углекислого газа СО2?
1. Вычислите массовую долю (в %) сахарозы в растворе, содержащем воду массой 250 г и сахарозу массой 50 г. 3. Массовая доля йода в аптечной йодной настойке составляет 5%. Какую массу йода и спирта нужно взять, чтобы приготовить 200 г настойки? 4. В 150 г воды растворили 25 г поваренной соли. Определите массовую долю соли в полученном растворе. 5. В 200 г столового уксуса содержится 6 г уксусной кислоты. Определите массовую долю кислоты в столовом уксусе. 6. Найдите массу воды и лимонной кислоты, необходимую для приготовления 50 г 5%-го раствора. 7. Из 240 г 3%-го раствора питьевой соды выпарили 80 г воды. Найдите массовую долю соды в полученном растворе.
8. К 150 г 20%-го раствора сахара добавили 30 г сахара. Найдите массовую долю 9. Смешали два раствора серной кислоты: 80 г 40%-го и 160 г 10%-го. Найдите 10. Пять чайных ложек поваренной соли (с горкой) растворите в 450 г (450 мл) воды. Учитывая, что масса соли в каждой ложке примерно 10 г, рассчитайте массовую долю соли в растворе. 12. Сахар массой 12,5г растворили в 112,5г воды. Определите массовую долю сахара в полученном растворе. 13. Смешали два раствора соли: 120г 5%-ного раствора и 130г 15%-ного раствора. 14. Вычислите массовую долю растворённого вещества, если в 88г воды растворили 12г соли. 15. Рассчитайте массы соли и воды, необходимые для приготовления 400г раствора с массовой долей соли 0,05. 16. Как изменится процентная концентрация раствора, если к 10%-раствору соли массой 100г добавить 20г воды. 17. Как изменится процентная концентрация раствора, если к 10%-раствору соли массой 100г добавить 20г соли. 18. В 100 г 20%-ного раствора соли добавили 300 г её 10%-ного раствора. Определите процентную концентрацию раствора. 19. Смешали 400 г 15%-ного раствора соли с 50 г 20%-ного соли к смеси добавили 100 г чистой воды. Какова концентрация полученной смеси? 20. Смешали 250 г 10% и 750 г 15%-ного растворов глюкозы. Вычислите массовую долю глюкозы в полученном растворе. 21. Сколько граммов 40%-ного раствора азотной кислоты нужно прибавить к 120 г 5%-ного раствора азотной кислоты, чтобы образовался 20% раствор? 22. В 380 г воды растворили 20 г иодида калия. Определите массовую долю соли в 23. Сколько граммов хлорида натрия потребуется для приготовления 250 г 10% -го раствора? 24. 800 г раствора с массовой долей соли равной 1% упарили до 400 г. Определите массовую долю соли в полученном растворе и массу испарившейся воды. 25. Вычислите массовую долю нитрата серебра в растворе, полученном при растворении 40 соли в 20 моль воды 26. При выпаривании 25 г раствора получили 0,25 г соли. Определите массовую долю растворенного вещества и выразите её в %.
Цепочки превращений 1.
3. Записать уравнения реакций, с помощью которых можно осуществить следующие превращения: S→ SO2 → H2SO3 → Na2SO3 → SO2
4. Составьте уравнения химических реакций в молекулярном и ионном видах согласно схеме Fe → FeCl2 → Fe(OH)2 → FeO → Fe. Назовите все вещества, укажите тип реакции.
5. Составьте уравнения химических реакций согласно схеме: HCl → ZnCl2 → Zn(OH)2 → Zn(NO3)2 ¯ ZnO Назовите все сложные вещества, укажите тип реакции. 6. Составьте уравнения химических реакций согласно схемам:
в) K → K2O → KOH → Cu(OH)2 → CuO → CuSO4
г) Cu → Cu(NO3)2 → X t CuO
Уровень А А 1.Что такое физические явления: 1)Явления, в результате которых изменяются агрегатное состояние и состав вещества, 2) Явления, в результате которых из одних веществ образуются другие.
3) Явления, в результате которых изменений веществ не наблюдается. 4) Явления, в результате которых изменяются размеры, форма тел или агрегатное состояние вещества, но состав их остается постоянным. А 6.Что такое основания? 1) Сложные вещества, состоящие из ионов металлов, связанных с одной или несколькими гидроксильными группами. 2) Сложные вещества, в состав которых входит водород 3) Сложные вещества, в состав которых входит кислотный остаток 4) Сложные вещества, в состав которых входят атомы водорода и кислотный остаток. А 7.Что относится к химическим явлениям? 1) Испарение воды 2) Замерзание воды 3) Перегонка нефти 4) Скисание молока Уровень В В 1. Установите соответствие:
В 2. Установите соответствие
В 3. Установите соответствие:
В 4. Установите соответствие:
Уровень С Билеты по химии для 8 класса. (по учебнику О.С.Габриелян) 1. Предмет химии. Вещества. Превращения веществ. Человек в мире веществ, материалов и химических реакций. Проблемы безопасного использования веществ и химических реакций в повседневной жизни. Разделение смесей и очистка веществ. Химическое загрязнение окружающей среды и его последствия. 2. Атомы и молекулы. Химический элемент. Строение атома. Состав ядра. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И.Менделеева. 3. Периодический закон и Периодическая система химических элементов
4. Строение молекул. Химическая связь: ковалентная (полярная и неполярная), 5. Химические формулы. Относительная атомная и молекулярная массы. Количество вещества. Молярная масса и молярный объем. 6. Степень окисления химических элементов. Высшая положительная степень окисления, низшая степень окисления. Окислитель и восстановитель. 7. Простые и сложные вещества. Основные классы неорганических веществ. Но- 8. Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях. Расстановка коэффициентов. 9. Классификация химических реакций по различным признакам: количеству и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии. 10. Электролиты и неэлектролиты. Катионы и анионы. Сильные и слабые электролиты. Электролитическая диссоциация кислот, щелочей и солей (средних). Реакции ионного обмена и условия их осуществления. 11. Чистые вещества и смеси. Способы разделения смесей. Правила безопасной работы в школьной лаборатории. 12. Кислоты: определение, классификация, типичные химические свойства. 13. Основания: определение, классификация, типичные химические свойства. 14. Оксиды: определение, классификация, типичные химические свойства. 15. Соли: определение, классификация, типичные химические свойства. 16. Простые вещества металлы и неметаллы. Нахождение в периодической системе элементов Д. И. Менделеева. Аллотропия. Аллотропные видоизменения углерода и кислорода. 17. Генетическая связь между классами веществ. Генетические ряды элементов. 18. Аморфные и кристаллические вещества. Типы кристаллических решеток. Закон постоянства состава вещества.
Задачи Задачи на расчет массы, объема, числа частиц вещества с использованием понятия количества вещества 3) Сколько будут весить 12 * 1023 молекул водорода? 4) Какой объем займут 12 * 1023 молекул водорода? 5) Какой объем займут при н. у. 16 г кислорода? 6) Сколько молекул содержится в воде массой 72 г. 8) Найти массу оксида меди количеством вещества 0,4 моль. 10) Рассчитайте массу 5 л озона (О3). 11) Найдите объём, который при н. у. займут 3 г водорода. 12) Сколько молей содержится в 100 г при нормальных условиях аммиака (NH3)? 13) Какое количество вещества содержится в 1 г воды? 14) Сколько молекул содержится в 342 г гидроксида бария Ва(ОН)2? 15) Какова масса 33,6л углекислого газа СО2?
1. Вычислите массовую долю (в %) сахарозы в растворе, содержащем воду массой 250 г и сахарозу массой 50 г.
3. Массовая доля йода в аптечной йодной настойке составляет 5%. Какую массу йода и спирта нужно взять, чтобы приготовить 200 г настойки? 4. В 150 г воды растворили 25 г поваренной соли. Определите массовую долю соли в полученном растворе. 5. В 200 г столового уксуса содержится 6 г уксусной кислоты. Определите массовую долю кислоты в столовом уксусе. 6. Найдите массу воды и лимонной кислоты, необходимую для приготовления 50 г 5%-го раствора. 7. Из 240 г 3%-го раствора питьевой соды выпарили 80 г воды. Найдите массовую долю соды в полученном растворе. 8. К 150 г 20%-го раствора сахара добавили 30 г сахара. Найдите массовую долю 9. Смешали два раствора серной кислоты: 80 г 40%-го и 160 г 10%-го. Найдите 10. Пять чайных ложек поваренной соли (с горкой) растворите в 450 г (450 мл) воды. Учитывая, что масса соли в каждой ложке примерно 10 г, рассчитайте массовую долю соли в растворе. 12. Сахар массой 12,5г растворили в 112,5г воды. Определите массовую долю сахара в полученном растворе. 13. Смешали два раствора соли: 120г 5%-ного раствора и 130г 15%-ного раствора. 14. Вычислите массовую долю растворённого вещества, если в 88г воды растворили 12г соли. 15. Рассчитайте массы соли и воды, необходимые для приготовления 400г раствора с массовой долей соли 0,05. 16. Как изменится процентная концентрация раствора, если к 10%-раствору соли массой 100г добавить 20г воды. 17. Как изменится процентная концентрация раствора, если к 10%-раствору соли массой 100г добавить 20г соли. 18. В 100 г 20%-ного раствора соли добавили 300 г её 10%-ного раствора. Определите процентную концентрацию раствора. 19. Смешали 400 г 15%-ного раствора соли с 50 г 20%-ного соли к смеси добавили 100 г чистой воды. Какова концентрация полученной смеси? 20. Смешали 250 г 10% и 750 г 15%-ного растворов глюкозы. Вычислите массовую долю глюкозы в полученном растворе. 21. Сколько граммов 40%-ного раствора азотной кислоты нужно прибавить к 120 г 5%-ного раствора азотной кислоты, чтобы образовался 20% раствор? 22. В 380 г воды растворили 20 г иодида калия. Определите массовую долю соли в 23. Сколько граммов хлорида натрия потребуется для приготовления 250 г 10% -го раствора? 24. 800 г раствора с массовой долей соли равной 1% упарили до 400 г. Определите массовую долю соли в полученном растворе и массу испарившейся воды. 25. Вычислите массовую долю нитрата серебра в растворе, полученном при растворении 40 соли в 20 моль воды 26. При выпаривании 25 г раствора получили 0,25 г соли. Определите массовую долю растворенного вещества и выразите её в %.
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-14; просмотров: 679; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.61.246 (0.062 с.) |
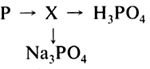
 а) б)
а) б)


