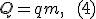Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа в термодинамике – ебала какая-тоСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Работа в термодинамике — обобщение понятия «работа в механике» (выраженного в дифференциальной форме). Обобщённые координаты в термодинамике — это внешние параметры термодинамической системы (объём, напряжённость внешние магнитное или электрические поля и т. п.), а обобщённые силы (давление и др.) — величины, зависящие не только от координат, но и от внутренних параметров системы (температуры или энтропии). Работа термодинамической системы над внешними телами заключается в изменении состояния этих тел и определяется количеством энергии, передаваемой системой внешним телам при изменении внешних параметров системы. В квазистатических (т. е. бесконечно медленных) адиабатических процесса работа равна изменению внутренней энергии системы, в квазистатических изотермических процессах — изменению энергии Гелъмголъца. В ряде случае работа может быть выражена через другие термодинамические потенциалы. В общем случае величина работы при переходе системы из начального состояния в конечное зависит от способа (пути), каким осуществляется этот переход. Это означает, что бесконечно малая (элементарная) работа системы не является полным дифференциалом какой-либо функции состояния системы; поэтому элементарная работа обозначают обычно A. Зависимость работы от пути приводит к тому, что для кругового процесса, когда система вновь возвращается в исходное состояние, работа системы может оказаться не равной нулю, что используется во всех тепловых двигателях. Примерами работы при изменении одного из внешних параметров системы могут служить: -работа сил давления p при изменении объёма V системы δA = pdV, -работа сил поверхностного натяжения при изменении поверхности системы δA = − σdΣ, (σ — коэфф. поверхностного натяжения, dΣ — элемент поверхности); -работа намагничивания системы δA = − HdJ (H — напряжённость в магн. поля, J — намагниченность) и т. д. Работа системы в неравновесном (необратимом) процессе всегда выше, чем в равновесном.
Количество теплоты Количество теплоты — это мера изменения внутренней энергии, которую тело получает (или отдает) в процессе теплообмена. Таким образом, и работа, и количество теплоты характеризуют изменение энергии, но не тождественны энергии. Они не характеризуют само состояние системы, а определяют процесс перехода энергии из одного вида в другой (от одного тела к другому) при изменении состояния и существенно зависят от характера процесса. Основное различие между работой и количеством теплоты состоит в том, что работа характеризует процесс изменения внутренней энергии системы, сопровождающийся превращением энергии из одного вида в другой (из механической во внутреннюю). Количество теплоты характеризует процесс передачи внутренней энергии от одних тел к другим (от более нагретых к менее нагретым), не сопровождающийся превращениями энергии. Опыт показывает, что количество теплоты, необходимое для нагревания тела массой m от температуры T1 до температуры T2, рассчитывается по формуле
Единицей удельной теплоемкости в СИ является джоуль на килограмм-Кельвин (Дж/(кг·К)). Удельная теплоемкость c численно равна количеству теплоты, которое необходимо сообщить телу массой 1 кг, чтобы нагреть его на 1 К. Теплоемкость тела CT численно равна количеству теплоты, необходимому для изменения температуры тела на 1 К:
Единицей теплоемкости тела в СИ является джоуль на Кельвин (Дж/К). Для превращения жидкости в пар при неизменной температуре необходимо затратить количество теплоты где L — удельная теплота парообразования. При конденсации пара выделяется такое же количество теплоты. Для того чтобы расплавить кристаллическое тело массой m при температуре плавления, необходимо телу сообщить количество теплоты где λ — удельная теплота плавления. При кристаллизации тела такое же количество теплоты выделяется. Количество теплоты, которое выделяется при полном сгорании топлива массой m, где q — удельная теплота сгорания. Единица удельных теплот парообразования, плавления и сгорания в СИ — джоуль на килограмм (Дж/кг).
|
||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 590; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.007 с.) |

 где c — удельная теплоемкость вещества;
где c — удельная теплоемкость вещества;