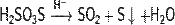Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Получение и св-ва гидроксидов,солей fe(ii и III). Качественная реакция на ионы железа.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
1)FeO – оксид железа(II), черный; Fe(OH)2 — гидроксид железа(II), белый; проявляют осно?вные свойства; 2) Fe2О3 — оксид железа(III), красно-бурый; Fe(OH)3 – гидроксид железа(III), бурый; проявляют амфотерные свойства.
1)4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3+ 12KCl. Это качественная реакция нa ионы Fe3+. 2) 3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2+ 3K2SO4. Это качественная реакция на ионы Fe2+ Получение:
2) Осаждение из раствора солей железа(III) гидрата Fe2O3 · n H2O и его частичное обезвоживание. В природе — оксидная руда железа лимонит Fe2O3 · n H2O и минерал гётит FeO(OH). 3) 4) Термическое разложение соединений солей железа(III) на воздухе: Fe2(SO4)3 → Fe2O3 + 3SO3, 4Fe(NO3)3·9H2O → 2Fe2O3 + 12NO2 + 3O2 + 36H2O. Пирометаллургический метод получение Pb,Cu, Zn из сульфидных руд. 1) при t,диоксид кремния 2PbS+3O2=2PbO+2SO2 PbS+2O2=PbSO4 2)при t: PbO+C=Pb+CO PbSiO+CaCO+CO=Pb+CaSiO3+CO2 Сu2S+2Fe2(SO4)3=4FeSO4+2CuSO4+S Из р-ра медь осождают действием порошкообразного железа или электролизом. 1)2ZnS+3O2=2ZnO+2SO2 2) 2ZnO+C=2Zn+CO2 Реакции термического разложения некоторых К-х солей.(NaHCO3,NaH2PO4,NaHSO4) 1)
2)Прокаливание солей приводит к следующим превращениям: NaH2PO4 = NaPO3 + H2O. 3)
Окислительное действие нитрата калия и хлората калия при t (сплавление). Разлагается при 400 °C с выделением кислорода. Разлагается при разогреве или при сжигании с образованием нитрита калия икислорода, что увеличивает пожароопасность. Является сильным окислителем и реагирует с горючими материалами и восстановителями. Чаще всего используется как удобрение. Реже — как компонент топлива пиротехнических устройств.
Чёрный порох, реакция горения:
При температуре ~ 400 °C разлагается с выделением кислорода с промежуточным образованием перхлората калия: 4KClO3 = 3KClO4 + KCl (400 °C); KClO4 = KCl + 2O2↑ (550—620 °C) В присутствии катализаторов (MnO2, Fe2O3, CuO и др.) температура разложения значительно снижается (до ~ 200 °C). 2KClO3 = 2KCl + 3O2 (150—300 °C, кат. MnO2). Гидролиз солей по катиону,но аниону,совместнй гидролиз. Различают обратимый и необратимый гидролиз солей: § 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени) § 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени) § 3. Гидролиз соли слабой кислоты и слабого основания:
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа). Слабые к-ты: Муравьиная кислота(НСООН) Сильные кислоты HCl, HBr, HI, (внимание! HF - слабая), HClO4, HClO3, H2SO4, H2SeO4, HNO3, HMnO4, H2CrO4, H2Cr2O7 и некоторые другие. Окислительное действие Cl,Br в щелочной среде. K2SO3 + 2KOH(конц.) + Cl2 = K2SO4 + 2KCl + H2O 2Ni(OH)2 + Cl2 + 2KOH(конц.) = 2NiO(OH)↓ + 2KCl + 2H2O K2SO3 + 2KOH(конц.) + Br2 = K2SO4 + 2KBr + H2O
Образование аммиакатов и гироксокомплексов Металлов,их разрещение. Гидроксокомплексы – комплексные соединения, содержащие в качестве лигандов гидроксид-ионы OH-. Гидроксокомплексы образуются в реакциях протолиза из аквакомплексов: [Al(H2O)6]3+ + H2O либо при растворении амфотерных гидроксидов в водных растворах гидроксидов щелочных металлов: Zn(OH)2 + 2 OH- = [Zn(OH)4]2- Водные растворы гидроксокомплексов имеют щелочную реакцию. Появление гидроксид-ионов в растворе вызвано замещением во внутренней сфере комплексов гидроксидных лигандов на молекулы воды: [Zn(OH)4]2- + H2O Гидроксокомплексы устойчивы только в сильнощелочных растворах. В нейтральной, а тем более в кислой среде, а также при нагревании растворов они разрушаются: [Al(OH)4]- + CO2 = Al(OH)3¯ + HCO3- [Be(OH)4]2- + 2NH4+ = Be(OH)2¯ + 2NH3. H2O [Zn(OH)4]2- + 4 H3O+ = [Zn(H2O)4]2+ + 4 H2O Na[Al(OH)4] = NaAlO2¯ + 2 H2O (при нагревании) Некоторые гидроксокомплексы можно использовать в качестве реагентов для идентификации отдельных ионов в растворе. Na+ + [Sb(OH)6]- = Na[Sb(OH)6]¯ Аммиакаты – это комплексные соединения, в которых функции лигандов выполняют молекулы аммиака NH3. Более точное название комплексов, содержащих аммиак во внутренней сфере – аммины; однако молекулы NH3 могут находиться не только во внутренней, но и во внешней сфере соединения – аммиаката. Аммиачные комплексы обычно получают при взаимодействии солей или гидроксидов металлов с аммиаком в водных или неводных растворах, либо обработкой тех же солей в кристаллическом состоянии газообразным аммиаком: AgCl(т) + 2 NH3. H2O = [Ag(NH3)2]Cl + 2 H2O Cu(OH)2(т) + 4 NH3. H2O = [Cu(NH3)4](OH)2 + 4 H2O NiSO4 + 6 NH3. H2O = [Ni(NH3)6]SO4 + 6 H2O CoCl2 + 6 NH3(г) = [Co(NH3)6]Cl2 В тех случаях, когда аммиачный комплекс неустойчив в водном растворе, его можно получить в среде жидкого аммиака: AlCl3(s) + 6 NH3(ж) = [Al(NH3)6]Cl3(s) Химическая связь молекул аммиака с комплексообразователем устанавливается через атом азота, который служит доноромнеподеленной пары электронов. [Cu(H2O)4]2+ + NH3. H2O [Cu(H2O)3(NH3)]2+ + NH3. H2O ..... Самые устойчивые среди аммиачных комплексов: [Co(NH3)6]3+; [Cu(NH3)4]2+ [Zn(NH3)4]2+ (b4 = 4,2. 109) и некоторые другие. Аммиакаты разрушаются при любых воздействиях, которые удаляют (при нагревании) или разрушают (действием окислителя) молекулу аммиака, переводят аммиак в кислотной среде в катион аммония (катион аммония не содержит неподеленных пар электронов и поэтому не может выполнять функции лиганда), либо связывают центральный атом комплекса, например, в виде малорастворимого осадка: [Cu(NH3)4]SO4 + 6 Br2 = CuSO4 + 12 HBr + 2 N2(г) [Ni(NH3)6]SO4 + 3 H2SO4 = NiSO4 + 3 (NH4)2SO4 [Cu(NH3)4](OH)2 + Na2S + 4 H2O = CuS¯ + 2 NaOH + 4 NH3. H2O Тиокислоты и их соли. В формулах тиокислот, образованных из оксикислот замещением атомов кислорода на атомы серы, последние помещают в конце: H3PO3S — тиофосфорная кислота, H2SO3S — тиосерная кислота.Пример: Получение: Св-ва: 1)Термически очень неустойчива
2) В присутствии серной кислоты разлагается:
3)Реагирует с щелочами:
4)Реагирует с галогенами:
Химические свойства Тиосерная кислота (H2S2O3) в присутствии воды разлагается:
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 1646; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.140.108 (0.011 с.) |














 [Al(H2O)5(OH)]2+ + H3O+
[Al(H2O)5(OH)]2+ + H3O+