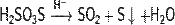Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая хар.и хим.св-ва щел Ме.Содержание книги Поиск на нашем сайте
Общая хар.и хим.св-ва щел Ме. Щелочные металлы: литий,натрий,калий,рубидий,цезий,франций. На посл.энергитическом уровне атомов этих эл-тов один s-электрон. По группе ↓r атомов закономерно растут,что связано с увелич.числа эл. В атоме и размеров орбиталей занимаемых последним эл. По группе ↓ уменьшаются Еионизации и электроотрий.Степень окисления этил эл-тов (+1).Низкая Еиониз. способствует легкому образованию однозарядных катионов и ионных связей в соединениях.Образование ковалентных связей мало характерны.Вследствие низких Еион. валентные эл. Переходят на более высокий энергич.поуровень,даже при повышенной t.Электронные переходы, сопровождаются поглощ.и испусканием электромагнитного излучения видимой обл.спектра.Поэтому щел.Ме окрашивают пламя в харктерные цвета.В пламени соли щел. Эл-тов испаряются.В газовой фазе катионы Ме присод.свободные электроны,присутствующие в пламени и правращ.в нейтральные атомы.Под влиянием высокой t происходит возбуждение атомов и испускание ими электромагнитного излучения опред. длин волн.Li-малиново-красный, Na-Желтый, K-розово-фиолетовый, Rb-красно-фиолетовый,Cs-голубой.
Щелочные Ме бурно реагируют с водой.Сильнейшие вос-ли,реагируют со всеми неметаллами,кроме благородных газов,легкоокисляются кислородом,при скорании на воздухе превращ. в Li2O,Na2O2;K,Rb,Cs-надпероксиды.Литий вступает в реакцию с азотом при комнатной t,с фосфором получаются фосфиды,при нагревании взаим.с углеродом. 2Na+2HCl(p)=2NaCl+H2 2Li+3H2SO4(k)=2LiHSO4+SO2+2H2O. 3Li+4HNO3(p)=3LiNO3+NO+2H2O Хорошо растворяются в жидком аммиаке. Особенности химии Li. Маленькие размры атома лития приводят к появлению особых св-в его соединений.Он смешивается с Na при t=380 и не смеш. с расплавленным K,Rb,Cs.Литий имеет сходство с Mg из-за близости радиусов.Атом Li харак. большим приятяженим электронов к ядру,поэтому менее реакционно способен,чем аналоги,но легче реагирует с N,C,Si.Некторые соли Li(карбонат,фторид,сульфат) растроримость понижается с повышением t.Малорастворимые соли Li можно получить дейтвием средних и кислых солей других щел Ме.3Li(+) +2HPO4(2-)=Li3PO4↓+H2PO4(-) Соли Li с большими неполяризуемыми анионами,такими как ClO4(-),более растворимы,чем для других щел Ме из-за высокой энергии мольватации.По той же причине многие простые соли лития обычно гидратированны,а безводные гидроскопичны.Термическая устойчивость гидроксида Li и его солей ниже,чем аналогич.соед.др.щел.Ме 2 LiHS= Li2S+H2S; Li2CO3=Li2O+CO2. При термическом разложении нитрата Li: 4LiNO3=2Li2O+4NO2+O2,но др.Ме 2MeNO3=2MeNO2+O2.В гидридах щел Ме обнаруж. Меньшая полярность связи Li-Н,чем например Na-Н.Гидрид лития термически устойчивее.Li может давать металлоорганические реагенты,получают их: 2Li+RX(алкилгалогениды)= LiR+ LiX.Для получения винильных,аллильных и др. ненасыщенных производных-трансметаллирование: 4 LiPh+Sn(CH=CH2)4=4LiCH=CH2+SnPh. Соединения термически неустойчивы. Только оксид Li можно получить сжиганием его на воздухе или в О2
Гидриды,оксиды,пероксиды,гидрокиды щМе:хим.связь в соединении и получение. Все кислородные соединения щел.эл.-кристаллические вещества с ионной связью.В узлах кристаллической решетки располагаются катионы металлов и кислородные анионы.Все щ.эл образуют оксиды состава М2О.Оксиды Li,Na бесцветные,оксиды K,Rb-желтые,Cs-оранжево-красный.Только оксид Li можно получить сжиганием его на воздухе или в О2.Например Na2O синтезируют по р-циям: Na2O2+2Na=2Na2O;2NaOH+2Na=2Na2O+H2; 2NaNO2+6Na=4Na2O+N2(предпочтительней) так же 3NaN3+NaNO2=2Na2O+5N2 Ме2О+Н2О=2МеОН. Все щел.эл-ты образуют пероксиды состава Ме2О2.Li2O2 в промыш. Получают реакцией: 2LiOH∙H2O+H2O2=Li2O2+3H2O.Na2O2-образуется при окислении Na.K2O2,Rb2O2,Cs2O2 этим спообом затруднительно,т.к они окисляются до надпероксидов MeO2.Для их синтеза используют окисление Me с помощью оксидов азота,но наилучший способ получения явл. окисление металлов,растворенных в жизком аммиаке.Пероксиды можно рассматривать как соли двухосновной кислоты,р-ция при t: 2М2О2+2Н2О=4МОН+О2.Надпероксиды МО2 содержат парамагнитный ион О2(-),который устойчив в присутствии крупных катионов.LiO2 образуется только при 15К,NaO2 был получен по реакции О2 с натрием, растворенным в жидком аммиаке.Полуторные оксиды М2О3 образуются в виде темных магнитных порашков при осторожном термическом разложении МО2(М=К,Rb,Cs).Можно получить окислением металлов,раств. В жидком аммиаке,или контр окислением пероксидов. Получение Na,NaOH,Na2CO3 в промыш. Na: из расплава гироксида натрия катод(железный) Na(+)+e=Na анод(никелевый) 4OH(-)-4e=O2+2H2O из смеси 40% NaCl,60%CaCl2 при t=580 катод(жел) Na(+)+e=Na Ca(2+)+2e=Ca анод(ник) 2Cl-2e=Cl2 а)Na 2 CО 3 + Са (ОН) 2 = 2NaOH + CaCО 3 б)1)Na2CО3 + Fe2О3 = 2NaFeО2 + CО 2 2)2NaFeО2 + xH2О = 2NaOH + Fe2O 3 *xH 2 О в) 2NaCl + 2H2О ±2е- → H2↑ + Cl2↑ + 2NaOH Способ Леблана 2NaCl + H2SO4 → Na2SO4 + 2HCl↑. Na2SO4 + 2C → Na2S + 2CO2↑. Na2S + СаСО3 → Na2CO3 + CaS. Способ Сольве 1)NaС1 + NН3 + СO2 + Н2O = NаНСО3 + NН4С1 (образование NаНСО3 происходит в водном растворе при 30-40°С). 2)Кальцинирование с образованием соды: 2NаНСО3 = Nа2СО3 + СО2 + Н2О (СО2частично остается в замкнутом процессе). 3)Регенерация аммиака: 2NН4С1 + СаО = СаС12 + Н20 + 2NН3. Взаимодействие с растворами щелочей а)амофотерных М б)неметаллов в)кислотных оксидов г) амфотерных оскидов А) 2NaOH(конц.) + 2H2O + Zn = Na2[Zn(OH)4] + H2↑ Б) 4S + 6NaOH(конц.) = Na 2 SO 3 S + 2Na 2 S + 3H 2 O 4Р + 3NaOH + 3Н2О → РН3+ 3NaH2РО2. 3S + 6NaOH → 2Na2S + Na2SO3+ 3H2O В) SO2 + NaOH(разб.) = NaHSO 3 Г) твёрдыми при сплавлении: ZnO + 2NaOH → Na2ZnO2+ H2O так и с растворами: ZnO + 2NaOH(раствор)+ H2O → Na2[Zn(OH)4](раствор) Получ. 1)Метакремниевую кислоту получают действием сильных кислот на соли метакремниевой кислоты: Na2SiO3 + 2HCl = H2SiO3 + 2NaCl. 2)При высокой температуре вода выпаривается: H2SiO3 = SiO2 + H2O В этой реакции оксид кремния(IV) выделяется виде силикагеля. Кремниевые кислоты — очень слабые, малорастворимые в воде кислоты. Известны соли метакремниевой кислоты Н2SiO3 (SiO2•H2О) — силикаты, ортокремниевой кислоты H4SiO4 (SiO2•2H2O) — ортосиликаты и других кислот с различным числом SiO2•nH2О. Гидраты кремнезема с содержанием более 2Н2О на каждую молекулу SiO2 в индивидуальном состоянии, по-видимому, не существуют, однако известны многие их соли. В воде кремниевые кислоты образуют коллоидные растворы.Соли кремниевых кислот называют силикатами (силикаты широко распространены в природе) Силикаты: 1)При нагревании SiO2 вытесняет более летучий кислотный оксид из солей: SiO2 + Na2CO3 = Na2SiO3 + CO2↑ 2)Обработка аморфного кремнезёма концентрированным раствором щёлочи: SiO2 + 2NaOH = Na2SiO 3 + H2O Силикаты взаимодействуют со следующими веществами: 1)С кислотами, даже с очень слабыми, например с угольной: Na2SiO3 + H2CO3 = Na2CO3 + H2SiO3↓ 2)С растворимыми солями: Na2SiO3 + MgCl2 = MgSiO3↓ + 2NaCl 3)Гидролиз: Na2SiO3 + H2O ↔ NaHSiO3 + NaOH гексафторокремниевая к-та в свободном виде не выделена H2SiF6↔SiF4+2HF(при упаривании или добав.к сильным кислотам.) При охлаждении насыщенного водного р-ра выпадает дигидрат H2SiF6∙2H2O в виде твердого бесцветных кристаллов.На стекло кислота не действует. Образование аммиакатов и гироксокомплексов Металлов,их разрещение. Гидроксокомплексы – комплексные соединения, содержащие в качестве лигандов гидроксид-ионы OH-. Гидроксокомплексы образуются в реакциях протолиза из аквакомплексов: [Al(H2O)6]3+ + H2O либо при растворении амфотерных гидроксидов в водных растворах гидроксидов щелочных металлов: Zn(OH)2 + 2 OH- = [Zn(OH)4]2- Водные растворы гидроксокомплексов имеют щелочную реакцию. Появление гидроксид-ионов в растворе вызвано замещением во внутренней сфере комплексов гидроксидных лигандов на молекулы воды: [Zn(OH)4]2- + H2O Гидроксокомплексы устойчивы только в сильнощелочных растворах. В нейтральной, а тем более в кислой среде, а также при нагревании растворов они разрушаются: [Al(OH)4]- + CO2 = Al(OH)3¯ + HCO3- [Be(OH)4]2- + 2NH4+ = Be(OH)2¯ + 2NH3. H2O [Zn(OH)4]2- + 4 H3O+ = [Zn(H2O)4]2+ + 4 H2O Na[Al(OH)4] = NaAlO2¯ + 2 H2O (при нагревании) Некоторые гидроксокомплексы можно использовать в качестве реагентов для идентификации отдельных ионов в растворе. Na+ + [Sb(OH)6]- = Na[Sb(OH)6]¯ Аммиакаты – это комплексные соединения, в которых функции лигандов выполняют молекулы аммиака NH3. Более точное название комплексов, содержащих аммиак во внутренней сфере – аммины; однако молекулы NH3 могут находиться не только во внутренней, но и во внешней сфере соединения – аммиаката. Аммиачные комплексы обычно получают при взаимодействии солей или гидроксидов металлов с аммиаком в водных или неводных растворах, либо обработкой тех же солей в кристаллическом состоянии газообразным аммиаком: AgCl(т) + 2 NH3. H2O = [Ag(NH3)2]Cl + 2 H2O Cu(OH)2(т) + 4 NH3. H2O = [Cu(NH3)4](OH)2 + 4 H2O NiSO4 + 6 NH3. H2O = [Ni(NH3)6]SO4 + 6 H2O CoCl2 + 6 NH3(г) = [Co(NH3)6]Cl2 В тех случаях, когда аммиачный комплекс неустойчив в водном растворе, его можно получить в среде жидкого аммиака: AlCl3(s) + 6 NH3(ж) = [Al(NH3)6]Cl3(s) Химическая связь молекул аммиака с комплексообразователем устанавливается через атом азота, который служит доноромнеподеленной пары электронов. [Cu(H2O)4]2+ + NH3. H2O [Cu(H2O)3(NH3)]2+ + NH3. H2O ..... Самые устойчивые среди аммиачных комплексов: [Co(NH3)6]3+; [Cu(NH3)4]2+ [Zn(NH3)4]2+ (b4 = 4,2. 109) и некоторые другие. Аммиакаты разрушаются при любых воздействиях, которые удаляют (при нагревании) или разрушают (действием окислителя) молекулу аммиака, переводят аммиак в кислотной среде в катион аммония (катион аммония не содержит неподеленных пар электронов и поэтому не может выполнять функции лиганда), либо связывают центральный атом комплекса, например, в виде малорастворимого осадка: [Cu(NH3)4]SO4 + 6 Br2 = CuSO4 + 12 HBr + 2 N2(г) [Ni(NH3)6]SO4 + 3 H2SO4 = NiSO4 + 3 (NH4)2SO4 [Cu(NH3)4](OH)2 + Na2S + 4 H2O = CuS¯ + 2 NaOH + 4 NH3. H2O Тиокислоты и их соли. В формулах тиокислот, образованных из оксикислот замещением атомов кислорода на атомы серы, последние помещают в конце: H3PO3S — тиофосфорная кислота, H2SO3S — тиосерная кислота.Пример: Получение: Св-ва: 1)Термически очень неустойчива
2) В присутствии серной кислоты разлагается:
3)Реагирует с щелочами:
4)Реагирует с галогенами:
Химические свойства Тиосерная кислота (H2S2O3) в присутствии воды разлагается: Общая хар.и хим.св-ва щел Ме. Щелочные металлы: литий,натрий,калий,рубидий,цезий,франций. На посл.энергитическом уровне атомов этих эл-тов один s-электрон. По группе ↓r атомов закономерно растут,что связано с увелич.числа эл. В атоме и размеров орбиталей занимаемых последним эл. По группе ↓ уменьшаются Еионизации и электроотрий.Степень окисления этил эл-тов (+1).Низкая Еиониз. способствует легкому образованию однозарядных катионов и ионных связей в соединениях.Образование ковалентных связей мало характерны.Вследствие низких Еион. валентные эл. Переходят на более высокий энергич.поуровень,даже при повышенной t.Электронные переходы, сопровождаются поглощ.и испусканием электромагнитного излучения видимой обл.спектра.Поэтому щел.Ме окрашивают пламя в харктерные цвета.В пламени соли щел. Эл-тов испаряются.В газовой фазе катионы Ме присод.свободные электроны,присутствующие в пламени и правращ.в нейтральные атомы.Под влиянием высокой t происходит возбуждение атомов и испускание ими электромагнитного излучения опред. длин волн.Li-малиново-красный, Na-Желтый, K-розово-фиолетовый, Rb-красно-фиолетовый,Cs-голубой.
Щелочные Ме бурно реагируют с водой.Сильнейшие вос-ли,реагируют со всеми неметаллами,кроме благородных газов,легкоокисляются кислородом,при скорании на воздухе превращ. в Li2O,Na2O2;K,Rb,Cs-надпероксиды.Литий вступает в реакцию с азотом при комнатной t,с фосфором получаются фосфиды,при нагревании взаим.с углеродом. 2Na+2HCl(p)=2NaCl+H2 2Li+3H2SO4(k)=2LiHSO4+SO2+2H2O. 3Li+4HNO3(p)=3LiNO3+NO+2H2O Хорошо растворяются в жидком аммиаке. Особенности химии Li. Маленькие размры атома лития приводят к появлению особых св-в его соединений.Он смешивается с Na при t=380 и не смеш. с расплавленным K,Rb,Cs.Литий имеет сходство с Mg из-за близости радиусов.Атом Li харак. большим приятяженим электронов к ядру,поэтому менее реакционно способен,чем аналоги,но легче реагирует с N,C,Si.Некторые соли Li(карбонат,фторид,сульфат) растроримость понижается с повышением t.Малорастворимые соли Li можно получить дейтвием средних и кислых солей других щел Ме.3Li(+) +2HPO4(2-)=Li3PO4↓+H2PO4(-) Соли Li с большими неполяризуемыми анионами,такими как ClO4(-),более растворимы,чем для других щел Ме из-за высокой энергии мольватации.По той же причине многие простые соли лития обычно гидратированны,а безводные гидроскопичны.Термическая устойчивость гидроксида Li и его солей ниже,чем аналогич.соед.др.щел.Ме 2 LiHS= Li2S+H2S; Li2CO3=Li2O+CO2. При термическом разложении нитрата Li: 4LiNO3=2Li2O+4NO2+O2,но др.Ме 2MeNO3=2MeNO2+O2.В гидридах щел Ме обнаруж. Меньшая полярность связи Li-Н,чем например Na-Н.Гидрид лития термически устойчивее.Li может давать металлоорганические реагенты,получают их: 2Li+RX(алкилгалогениды)= LiR+ LiX.Для получения винильных,аллильных и др. ненасыщенных производных-трансметаллирование: 4 LiPh+Sn(CH=CH2)4=4LiCH=CH2+SnPh. Соединения термически неустойчивы. Только оксид Li можно получить сжиганием его на воздухе или в О2
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 481; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.41.109 (0.008 с.) |


 [Al(H2O)5(OH)]2+ + H3O+
[Al(H2O)5(OH)]2+ + H3O+