
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вивчення лінійчатих спектрів випромінюванняСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Мета роботи Вивчення спектральних закономірностей випромінювання розрідженими двоатомними газами.
Теоретичні відомості. Атоми усіх хімічних елементів складаються з позитивно заряджених ядер, в яких зосереджена майже вся маса атома, та електронів. Сумарний від’ємний заряд електронів рівний додатному заряду ядра. Електрони в атомах можуть мати тільки визначенні значення енергії. Ці значення при графічному зображенні позначаються як енергетичні рівні атома. Найнижчий рівень відповідає основному стану атома, а більш високий – збудженому. Кожен енергетичний рівень атома характеризується головним квантовим числом n, яке може приймати значення послідовного ряду чисел: n = 1, 2, 3,… Випромінювання та поглинання енергії атомами відбувається при їхніх переходах з одного енергетичного рівня на інший, тобто дискретно. Енергія поглинутого або випроміненого кванта при цьому:
При отриманні ззовні енергії (нагрівання, опромінювання, бомбардування частинками тощо) атоми, поглинаючи кванти енергії, переходять у збуджені стани. Потім вони можуть повернутися на більш низькі енергетичні рівні, випускаючи при цьому енергію. Випромінювання можна розкласти у спектр за допомогою призми або дифракційної гратки. Розжарені тверді та рідкі тіла дають світло, при розкладанні якого отримують суцільний спектр, що має вигляд кольорової смуги з неперервним переходом одного спектрального кольору в інший (рис. 1).
Рис. 1. Суцільний спектр видимого випромінювання [http://uk.wikipedia.org/wiki/Файл:Spectrum_roygbiv.jpg].
Спектр молекул газу або пару складається з окремих смуг, чітких з одного краю і розмитих з іншого. Такий спектр називається смугастим. Ці смуги утворені великою кількістю близько розташованих вузьких ліній (рис. 2).
Рис. 2. Смугастий спектр азоту [http://uk.wikipedia.org/wiki/Файл:Nitrogen.Spectrum.Vis.jpg].
Гази і пари, що складаються із окремих атомів дають так звані лінійчаті спектри у вигляді окремих ліній. При проходження білого світла через гази в останніх відбувається поглинання тих довжин хвиль, які присутні в спектрі випромінювання цих газів. Лінійчаті спектри поглинання складаються з окремих темних ліній, розташованих на фоні суцільного спектру. Ці темні лінії відповідають поглинутим довжинам хвиль атомами (рис. 3). Кожен хімічний елемент має характерний для нього лінійчатий спектр (рис. 4). Тому вивчення спектрів є важливим методом дослідження складу речовини. По яскравості спектральних ліній можна також оцінити відсоткове співвідношення окремих елементів у складі речовини.
Рис. 3. Лінійчатий сонячний спектр поглинання із чіткими фраунгоферовими лініями [http://commons.wikimedia.org/wiki/File:Fraunhofer_lines_DE.svg].
Рис. 4. Лінійчатий спектр випромінювання водню [http://upload.wikimedia.org/wikipedia/commons/4/4c/Emission_spectrum-H.png].
Лінії в спектрі атомів об’єднуються у групи, які називаються спектральними серіями. В одній і тій же серії лінії зближуються в сторону більш коротких довжин хвиль і мають деяку границю, біля якої іони розташовуються дуже щільно аж до злиття одна з одною. У спектрі атома водню спостерігаються наступні серії ліній: - в ультрафіолетовій частині спектру – серія Лаймана; - у видимій – серія Бальмера; - в інфрачервоній – серії Пашена, Бреккета та Пфунда. Довжини хвиль спектральних ліній водню обчислюються за формулою:
де R = 1,097∙107 м-1 – стала Рідберга, n та m – головні квантові числа, що відповідають енергетичним рівням атома, причому завжди n<m.
Так, для серії Лаймана n =1, а m = 2, 3, 4, … Бальмера n =2, а m = 3, 4, 5, … Пашена n =3, а m = 4, 5, 6, … Бреккета n =4, а m = 5, 6, 7, … Пфунда n =5, а m = 6, 7, 8, …
Схематично переходи зображені на рис. 5.
Рис. 5.
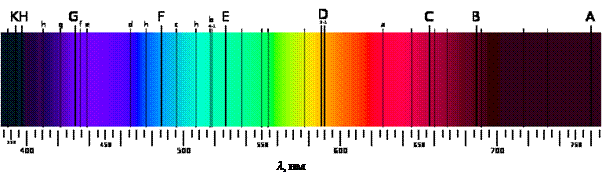
Відмітимо, що перші чотири лінії бальмерівської серії лежать в області видимого спектру:
Теоретичні відомості. В даній лабораторній роботі лінійчаті спектри спостерігаються за допомогою спектроскопа. Основними частинами спектроскопа є коліматор (К), призма (П) та зорова труба (Т), закріплені на спільній основі (рис. 6). Коліматор служить для отримання паралельного пучка променів. Світло від джерела (Д) освітлює щілину коліматора (1). На протилежному кінці коліматора є об’єктив (2), розташований так, що щілина (1) знаходиться в його фокальній площині.
Рис. 6.
Пучок паралельних променів, які вийшли з коліматора, попадають на призму (П), потім внаслідок дисперсії виходить з неї вже розкладений у спектр. Далі промені входять в об’єктив (3) зорової труби (Т) та збираються в його фокальній площині, утворюючи зображення щілини (1) для різних довжин хвиль у різних місцях. Якщо щілина коліматора освітлюється світлом газорозрядної лампи, то у фокальній площині об’єктива зорової труби присутнє випромінювання тільки деяких довжин хвиль. В результаті буде видно лінійчатий спектр. Спостерігається спектр за допомогою окуляру 4 зорової труби Т, в полі зору якого одночасно видно спектр та вказівник, який можна сумістити з довільною лінією спектра. Спеціальними поворотними механізмами зорова труба або призма повертаються так, що можна було розглянути різні ділянки спектру. Положення ліній визначається по шкалі з конусом на барабані (Б), яким переміщується вказівник. Хід променів у спектроскопі схематично показаний на рис. 6.
4. Контрольні запитання. 1. Як відбувається випромінювання та поглинання енергії атомами? 2. Що являє собою лінійчатий спектр випромінювання? Поглинання? 3. Які серії ліній спостерігаються в лінійчатому спектрі водню? 4. за якою формулою обчислюються довжини хвиль лінійчатого спектру водню? 5. Які значення головних квантових чисел n та m відповідають довжинам хвиль видимої області водневого спектру? 6. Поясніть в чому суть спектрального аналізу та з якою метою він проводиться? 7. В чому полягає методика виконання даної роботи? Домашнє завдання. Для виконання даної лабораторної роботи необхідно вивчити такі питання з курсу фізики: спектри випромінювання, спектральні закономірності, спектри поглинання, лінії Фраунгофера, спектральні лінії атома водню.
Лабораторне завдання. Перед дослідженням спектра газу необхідно провести градуювання спектроскопа. Проградуювати шкалу спектроскопа означає встановити залежність між поділками шкали та довжиною хвилі компоненти світла, яка відмічається вказівником в окулярі зорової труби. Для цього використовується лінійчатий спектр з відомими довжинами хвиль (зазвичай як градуювальний газ використовують водень). Вказівник спектроскопа (в окулярі) наводять послідовно на кожну з вказаних ліній і одночасно відраховують покази по шкалі вимірювального пристрою. Відрахування записують в таблиці навпроти відповідної лінії. За результатами вимірювань будують графік, відкладаючи на осі абсцис покази вимірювального пристрою, а на осі ординат – відповідні значення довжин хвиль. Через точки на графіку проводять плавну криву. Користуючись графіком, можна визначити довжину хвилі для довільної точки спектру досліджуваного газу, якщо відомо її положення на шкалі вимірювального пристрою спектроскопа. Як градуювальний газ можна використовувати біле світло, яке випромінюється довільним джерелом (Сонце, лампа розжарення тощо). Це спосіб ґрунтується на тому, що людське око має високу чутливість до кольорового сприйняття. Налаштовуючи спектроскоп на середні положення кожного з основних кольорів спектру, можна аналогічно провести градуювання приладу (див. табл. 2)
Таблиця 2. Середні значення довжин хвиль різних кольорів спектру.
Як вимірювальний пристрій спектроскопа використовується мікрометр, суміщений з вказівником в окулярі спектроскопа. Один оборот мікрометра вивільнює або закриває (в залежності від напрямку обертання) цілі поділки шкали мікрометра. Соті частини від цілих поділок відраховують по вказівнику, розташованому напроти цілих поділок вимірювального пристрою, на рухомій його частині.
Порядок виконання роботи 1. Огляньте вимірювальний пристрій спектроскопа, визначте ціну поділки вимірювальної шкали. 2. Спрямуйте спектроскоп на звичайне джерело світла (лампа розжарювання), розташувавши її перед щілиною коліматора. 3. Проведіть калібрування спектроскопа, скориставшись даними таблиці 2. При калібрувальних вимірюваннях наводьте вказівник спектроскопу на різні спектральні складові світла (кольори). 4. Результати вимірювань запишіть у таблицю:
5. Вимкніть установку. Побудуйте калібрувальну характеристику спектроскопа за результатами вимірювань. 6. Спрямуйте спектроскоп на джерело світла з трубкою, заповненою невідомим газом, розташувавши її перед щілиною коліматора. Під’єднати до джерела живлення. 7. Увімкніть установку і, наводячи вказівник по черзі на всі лінії спектру, знімайте покази по шкалі спектроскопа. Результати вимірювань розміщуйте в таблицю:
8. Вимкніть установку, від’єднайте трубку з невідомим газом від джерела живлення. 9. За допомогою градуювального графіка визначте довжини хвиль для ліній спектра досліджуваного газу та занесіть їх до таблиці. 10. За каталогом визначте хімічну формулу невідомого газу.
Прилади та обладнання. В роботі використовуються: спектроскоп, газорозрядні трубки, штатив для кріплення трубок, джерело живлення.
Література. 1.Савельев Н.В. Курс общей физики. М.:Наука. Т. 2, 1978; Т. 3 1979. 2. Ландсберг Г.С. Оптика. М.:Наука. 1976. 3. Зисман Г.А., Тодес О.М. Курс общей физики. М.: Наука. Т.2, 1972; Т.3, 1978.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 416; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.180.253 (0.012 с.) |





 ,
,
 =656,28
=656,28
 =486,12
=486,12
 =434,05
=434,05
 =410,17
=410,17




