
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакції каталітичного гідруванняСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Остання реакція називається реакцією десульфування і використовується для очищення нафти від сірковмісних домішок, які є отрутою для каталізаторів процесу крекінгу. Реакції електрофільного заміщення
Реакції дієнового синтезу
Диціанацетилен о -Фталодинітрил
Пірол і його похідні Одержання Пірол одержують із фурану та аміаку (Ю.К.Юр'єв,1936)
Аналогічним шляхом вдається замінити один гетероатом на інший (взаємне перетворення циклів за Юр'євим)
Хімічні властивості Кислотно-основні властивості Завдяки участі неподіленої пари електронів атома азоту в спряженні, пірол є дуже слабкою основою і одночасно слабкою кислотою (за силою кислоти порівняний з етанолом). Як слаба кислота він утворює солі, які у воді повністю гідролізовані.
Піролкалій Ацидофобні властивості Пірол ацидофобний. Він легко протонується, що веде до руйнування його спряженого циклу, аналогічно до фурану. Реакції електрофільного заміщення
Реакції приєднання. Пірол приєднує водень у момент виділення з утворенням піроліну або каталітично збуджений водень, в результаті чого утворюється піролідин.
Реакції розщеплення пірольного кільця Гідроксиламін легко розщеплює пірольне кільце за схемою:
Діоксим бурштинового альдегіду
Реакція розширення гетероциклу
3-Хлоропіридин З похідних піролідину велике значення має піролідон (лактам γ-амінобутиратної кислоти). При нагріванні він полімеризується з утворенням поліаміду, з якого виготовляють синтетичне волокно “найлон-4”.
При конденсації з ацетиленом утворюється вінілпіролідон. При температурі вищій 140о він полімеризується з утворенням полівініпіралідону, який застосовується як замінник плазми крові, для виготовлення ліків пролонгованої дії, біосумісних полімерних матеріалів тощо. П'ятичленні гетероцикли з конденсованими ядрами
Індол Тіонафтен (α,β -бензопірол) (α,β -бензотіофен)
Індол Одержання Індол міститься у кам'яновугільній смолі. Синтетично його отримують реакцією циклізації фенілгідразонів
або конденсацією аніліну з ацетиленом за методом О.Чічібабіна.
За своєю будовою і властивостями він нагадує нафтален.
Хімічні властивості Індол виявляє ацидофобні властивості, а під дією лугів утворює металічні похідні індолу
На відміну від піролу, в індолі реакції електрофільного заміщення протікають не біля другого, а біля третього атома вуглецю, що зумовлено впливом бензенового кільця. Індол та його похідні відіграють надзвичайно важливу роль у живій природі. Велике значення має β-індолілоцтова кислота (гетероауксин) – стимулятор росту рослин:
β-Індоліланін (триптофан) – одна з найважливіших незамінимих амінокислот.
Індоксил Найважливішим з кисневмісних похідних індолу є індоксил (3-оксоіндол), який отримують циклізацією феніламінооцтової кислоти (метод Геймана):
або з орто -амінобензоатної кислоти
Індоксил у розчинах здатний до кето-енольної таутомерії.
Індиго При окисненні індоксилу на повітрі утворюється барвник синього кольору - індиго:
Транс -форма індиго
Раніше індиго добували з тропічної рослини “indigofera”. Він здавна відомий, але й сьогодні не втратив свого значення. Ним традиційно фарбують джинсові тканини. Хоч тепер замість натурального індиго майже всюди використовують синтетичний барвник. Індиго не розчиняється у воді. Тому, щоб пофарбувати ним волокно, треба перевести його у водорозчинну форму. Для цього індиго відновлюють і одержують у воді безбарвну форму – “біле індиго”. Волокно просочують розчином “білого індиго” і потім сушать на повітрі. Під дією кисню повітря “біле індиго” окиснюється до “синього індиго” і волокно набуває забарвлення. Такий процес фарбування, при якому нерозчинний барвник переводять у розчинну форму, наносять у вигляді розчину на тканину або волокно і потім знову роблять нерозчинним – називають кубовим фарбуванням.
Кетонна форма Єнольна форма “біле індиго”
Шестичленні гетероцикли з одним Гетероатомом Одним з головних представників такого типу гетероциклів є піридин.
Піридин
1. Одержання 1.1. Основним джерелом піридину для промисловості служитькам'яновугільна смола. Гомологи піридину можна одержувати синтетичними методами. Метод Реппе
5-Етил-2-метилпіридин 5-Вініл-2- метилпіридин З альдегідів
Акролеїн 3-Метилпіридин (β-Піколін) Хімічні властивості Основність піридину. У молекулі піридину кожен атом циклу надає у спряжену систему один електрон, тому неподілена пара електронів атома азоту не приймає участь в ароматичному секстеті. В результаті азот проявляє електронодонорні властивості, що робить піридин доволі сильною основою. Основність піридину близька до основності аніліну. З кислотами він утворює солі піридинію.
2.2. Гідрування піридину Піридин гідрується легше, ніж бензен. Водень для процесу гідрування зручно добувати при взаємодії спирту з металічним натрієм.
Піперидин (гексагідропіридин)
2.3. Реакції∙ електрофільного заміщення. Оскільки атом азоту характеризується більшою електронегативністю ніж вуглець і стягує на себе електронну густину ядра, реакції електрофільного заміщення протікають набагато важче, ніж для бензену, причому електрофіл заміщує водень переважно у третьому положенні, де залишається найбільша електронна густина.
Увести замісник α-положення у такий спосіб неможливо. Здійснити пряме електрофільне заміщення в γ-положення також неможливо. Однак для одержання γ-заміщених похідних піридину часто використовують N-оксид піридину (див.стор.).
|
||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 779; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.211.246 (0.01 с.) |











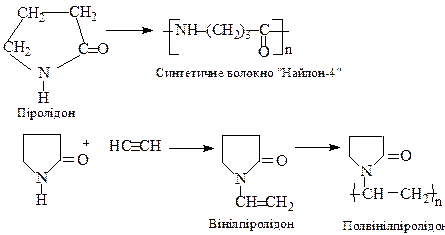


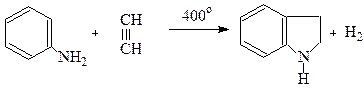








 Піридин можна розглядати як бензен, у якого один атом вуглецю замінений на азот. Оскільки електронегативність азоту вища, ніж вуглецю, він стягує на себе електронну густину і на вуглецевих атомах виникає частковий позитивний заряд.
Піридин можна розглядати як бензен, у якого один атом вуглецю замінений на азот. Оскільки електронегативність азоту вища, ніж вуглецю, він стягує на себе електронну густину і на вуглецевих атомах виникає частковий позитивний заряд.







