Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
По пм. 02 проведение лабораторных гематологических исследованийСодержание книги
Поиск на нашем сайте
Учебно-методическое пособие для самостоятельной аудиторной работы студентов ПО ПМ.02 пРОВЕДЕНИЕ ЛАБОРАТОРНЫХ гематологических ИССЛЕДОВАНИй МДК.02.01 Теория и практика лабораторных гематологических исследований (теоретически-практический курс) специальность 060604 Лабораторная диагностика
Волгоград 2014г
Составитель: Коцюба А.Н., преподаватель первой квалификационной категории ГБОУ СПО «Волгоградский медицинский колледж»
Рецензенты: Яшина В.Ю., заведующая КДЛ ГУЗ ВОКБ №1 Крайнова С.В., преподаватель высшей квалификационной категории ГБОУ СПО «Волгоградский медицинский колледж» Учебно-методическое пособие разработано в соответствии с программой ПМ.02 Проведение лабораторных гематологических исследований для студентов специальности 060604 Лабораторная диагностика.
Цель создания пособия - помощь студентам в приобретение умений и проведении лабораторных гематологических исследований. Компьютерный набор: Коцюба А.Н Корректор методического отдела: Чудина Т Содержание
Раздел I Кроветворение. Состав и функции крови. 1.1 Схема кроветворения 1.2 Клеточный состав крови и диагностическое значение исследования. Гематологическая норма. Раздел II Исследования крови на общий анализ 2.1 Основные правила инфекционной безопасности при взятии крови на общий анализ. 2.2 Понятие о клиническом анализе. 2.2.1 Технология взятия капиллярной крови на общий клинический анализ 2.3 Определение гемоглобина 2.3.1 Унифицированный метод определения количества гемоглобина на гемоглобинометре фотометрическом портативном МиниГЕМ. 2.3.2Унифицированный метод определения концентрации гемоглобина на минифотометре MF-1020 2.3.3 Унифицированный метод определения гемоглобина на фотоэлектроколориметре. 2. 4. Методы подсчетаэритроцитов 2.4.1 Методика подсчета эритроцитов в камере Горяева 2.5 Подсчет лейкоцитов 2.5.1 Методика подсчета лейкоцитов в камере Горяева 2.6Скорость оседания эритроцитов 2.6.1 Метод Панченкова. 2.6.2 Метод Ванстенгрена 2.7 Индексы красной крови 2.7.1Подсчет индексов красной крови 2.8 Приготовление мазков крови 2.8.1 Методика приготовления мазков крови 2.9 Лейкоцитарная формула 2.9.1 Методика подсчета лейкоцитарной формулы Раздел III Дополнительные гематологические исследования 3.1 Клинические методы определения тромбоцитов. 3.1.1 Методика окраски мазков крови на тромбоциты по Алексееву (подсчет по Фонио). 3.1.2Методика определения длительности кровотечения (уколочная проба по Дуке) 3.1.3Методика определения времени свертывания капиллярной крови (метод Сухарева) 3.2 Методы исследования ретикулоцитов. 3..2.1 Методика окраски мазков крови на ретикулоциты по Алексееву (подсчет по Фонио) 3.3 Объем эритроцитов 3.3.1 Методики определения общего объема эритроцитов (гематокритная величина) 3.3.2 Унифицированный микрометод (модификации. Тодорова) 3.4.Осмотическая резистентность 3.4.1 Унифицированный метод определения осмотической резистентности эритроцитов в модификации Идельсона Раздел IV Патологические изменения состава крови 4.1Анемии 4.2Лейкозы 4.3Геморрагические диатезы
Раздел V Исследование на гематологических анализаторах. Пояснительная записка Учебно-методическое пособие по профессиональному модулю ПМ.02 Проведение лабораторных гематологических исследований МДК 02.01 Теория и практика лабораторных гематологических исследований (практическая часть) составлено для студентов специальности 060604 Лабораторная диагностика. Цель создания пособия - помощь студентам в приобретение умений и проведении лабораторных гематологических исследований. Пособие составлено в соответствии с профессиональным модулем по теории и практике гематологических исследований. Пособие предназначено для самостоятельной аудиторной работы студентов на практических занятиях. Данное пособие содержит пять разделов: кроветворение; состав и функции крови; исследования крови на общий анализ; дополнительные гематологические исследования; патологические изменения состава крови; исследование крови на гематологических анализаторах. Пособие адресовано студентам и слушателям медицинских колледжей, а также лабораторным техниками, технологам, работающим в клинико-диагностических лабораториях лечебно-профилактических учреждений.
Уважаемые студенты! В современных условиях в связи с реформой здравоохранении и образовании наибольшее значение приобретает серьезная теоретическая и практическая подготовка специалистов со средним профессиональным образованием и поэтому был внедрен федеральный государственный образовательный стандарт среднего профессионального образования. Данное учебное пособие поможет Вам сформировать профессиональные и общие компетенции: ПК 2.1. Готовить рабочее место для проведения лабораторных гематологических исследований. ПК 2.2. Проводить забор капиллярной крови. ПК 2.3.Проводить общий анализ крови и дополнительные гематологические исследования; участвовать в контроле качества. ПК 2.4. Регистрировать полученные результаты. ПК 2.5. Проводить утилизацию капиллярной и венозной крови, дезинфекцию и стерилизацию использованной лабораторной посуды, инструментария, средств защиты. ОК1.Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес. ОК2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество. ОК3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность. ОК4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития. ОК5. Использовать информационно-коммуникационные технологии в профессиональной деятельности. ОК6. Работать в коллективе и команде, эффективно общаться с коллегами, руководством, пациентами. ОК7. Брать ответственность за работу членов команды (подчиненных), за результат выполнения заданий. ОК8. Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать повышение квалификации. ОК9. Ориентироваться в условиях смены технологий в профессиональной деятельности. ОК10. Бережно относиться к историческому наследию и культурным традициям народа, уважать социальные, культурные и религиозные различия. ОК.11 Быть готовым брать на себя нравственные обязательства по отношению к природе, обществу и человеку. ОК12. Оказывать первую медицинскую помощь при неотложных состояниях. ОК13. Организовывать рабочее место с соблюдением требований охраны труда, производственной санитарии, инфекционной и противопожарной безопасности. ОК14. Вести здоровый образ жизни, заниматься физической культурой и спортом для укрепления здоровья, достижения жизненных и профессиональных целей. Своевременная и точная диагностика различных заболеваний невозможна без лабораторных исследований. Проявления любого заболевания отражаются в первую очередь на обменных процессах в организме. Это наиболее важный факт в доклинической диагностике заболеваний, поскольку более 70% информации о пациенте дают показатели состояния крови. Результаты, полученные при лабораторном анализе, могут подсказать направления дальнейшего поиска и выбор тактики лечения. Признание лабораторной информации неотъемлемой частью клинической аргументации накладывает на Вас, будущих работников клинико-диагностических лабораторий, высокую ответственность за качество своей работы. Залогом аналитической надежности лабораторных результатов служат знания и умения специалистов. В данном пособии представлены все основные современные методы гематологических исследований.
Желаем удачи!
РАЗДЕЛ I
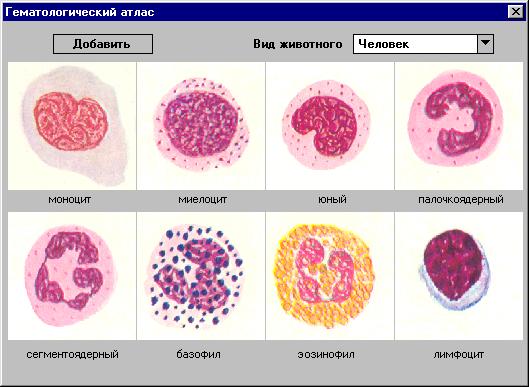
Схема кроветворения Кроветворение — гемопоэ з — это процесс развития клеточных элементов, который приводит к образованию зрелых клеток периферической крови. Процесс кроветворения можно изобразить в виде схемы, в которой клетки расположены в определенной последовательности, основанной на степени их созревания. Согласно современным представлениям о кроветворении все клетки крови происходят из одной, которая дает начало трем росткам кроветворения: лейкоцитарному, эритроцитарному и тромбоцитарному. В схеме кроветворения клетки крови разделены на 6 классов. Первые четыре класса составляют клетки-предшественники, пятый класс — созревающие клетки и шестой — зрелые. Класс I.- Класс полипотентных клеток - предшественников Представлен стволовыми клетками, количество которых в кроветворной ткани составляет доли процента. Эти клетки способны к неограниченному само поддержанию в течение длительного времени (больше, чем продолжительность жизни человека). Стволовые клетки полипотентные, т. е. из них развиваются все ростки кроветворения. Большая часть стволовых клеток находится в состоянии покоя и только около 10% из них делятся. При делении образуются два типа клеток — стволовые (само поддержание) и клетки, способные к дальнейшему развитию (дифференцировке). Последние составляют следующий класс. II.Класс частично детерминированных полипотентных клеток предшественников Представлен ограниченно полипотентными клетками, т. е. клетками, которые способны дать начало либо лимфопоэзу (образованию клеток лимфоидного ряда), либо миелопоэзу (образованию клеток миелоидного ряда). В отличие от стволовых клеток они способны лишь к частичному само поддержанию. Класс III. Класс унипотентных клеток - предшественников В процессе дальнейшей дифференцировки образуются клетки, называемые унипотентными предшественниками. Они дают начало одному строго определенному ряду клеток: лимфоцитам, моноцитам и гранулоцитам (лейкоцитам, имеющим в цитоплазме зернистость), эритроцитам и тромбоцитам. В костном мозге обнаруживается две категории клеток-предшественников лимфоцитов, из которых образуются. В - и Т-лимфоциты. В-лимфоциты созревают в костном мозге, а затем заносятся кровотоком в лимфоидные органы. Из предшественников В-лимфоцитов образуются плазмоциты. Часть лимфоцитов в эмбриональном периоде поступает через кровь в вилочковую железу (thymus) и обозначается как Т-лимфоциты. В дальнейшем они дифференцируются в лимфоциты. Клетки этого класса также не способны к длительному само поддержанию, но способные к размножению и дифференцировке. Все клетки трех классов морфологически не дифференцируемые клетки Класс IV.Морфологически распознаваемых пролиферирующих клеток Представлен.молодыми, способными к делению клетками, образующими отдельные ряды миело и лимфопоэза. Все элементы этого ряда имеют окончание «бласт»: плазмобласт, лимфобласт, монобласт, миелобласт, эритробласт, мегакариобласт. Из клеток этого класса в процессе деления образуются клетки следующего класса. Класс V.Класс созревающих клеток Представлен созревающими клетками, названия которых имеют общее окончание «цит». Все элементы этого класса расположены в схеме по вертикали и определенной последовательности, обусловленной стадией их развития. Названия клеток первой стадии начинаются приставкой «про» (перед): проплазмоцит, пролимфоцит, промоноцит, промиелоцит, пронормоцит, промегакариоцит. Элементы гранулоцитарного ряда проходят еще две стадии в процессе развития: миелоцит и метамиелоцит («мета» означает после). Метамиелоцит, находящийся на схеме ниже миелоцита, представляет переход от миелоцита к зрелым гранулоцитам. К клеткам этого класса относят также и палочкоядерные гранулоциты. Пронормоциты в процессе эритропоэза проходят стадии нормоцитов, которые, в зависимости от степени насыщения гемоглобином цитоплазмы, имеют добавочные определения: нормоцит базофильный, нормоцит полихроматофильный и нормоцит оксифильный. Из них образуются ретикулоциты — незрелые эритроциты с остатками ядерной субстанции. Класс VI. Класс зрелых клеток Представлен зрелыми клетками, неспособными к дальнейшей дифференцировке с ограниченным жизненным циклом. К ним относятся: плазмоцит, лимфоцит, моноцит, сегментоядерные гранулоциты (эозинофил, базофил, нейтрофил), эритроцит, тромбоцит. Зрелые клетки поступают из костного мозга в периферическую кровь. Показателем, характеризующим состояние костномозгового кроветворения, является миелограмма – количественное соотношение клеток разной степени зрелости всех ростков кроветворения РАЗДЕЛ II СОЭ Муж................................................................ 1-10 мм/ч Жен.................................................................. 2-15 мм/ч Тромбоциты.................................................. 180 - 320 *10 9/л Ретикулоциты............................................... 2 -12 % Время свёртывания крови: Венозная........................................................ 5 -10 мин. Капиллярная............................................... 30сек-2мин - 3-5 мин. Гематокрит................................................... 36-48%
Определение гемоглобина
2.3.1 Унифицированный метод определения количества гемоглобина на гемоглобинометре фотометрическом портативном МиниГЕМ Принцип метода: Основан на превращении гемоглобина в цианметгемоглобин при добавлении к крови реактива (р-р Драбкина). Под влиянием железисто - синеродистого калия гемоглобин окисляется до метгемоглобина (гемоглобина), который затем превращается при помощи калия в цианметгемоглобин (гемоглобинцианид). Реактивы: 1) Трансформирующий р-р Устройство: Гемоглобинометр МиниГЕМ 540 представляет собой специализированный фотометр, предназначенный для определения общего гемоглобина крови гемиглобинцианидным методом с фотометрированием на длине волны 540 нм. Диапазон измеряемой прибором оптической плотности составляет от 0 до 0,9. Б, что соответствует концентрации общего гемоглобина крови от 0 до 360 г/л. В приборе используется стандартная проб подготовка - 20 мкл крови, разведение 1:250. Суммарная погрешность определения гемоглобина (с учетом погрешностей дозаторов и погрешностей биохимического метода), полученная при сравнительных медицинских испытаниях, не превышает 2% (коэффициент вариации) во всем диапазоне измеряемых концентраций. При этом собственная погрешность гемоглобинометра как фотометра - не более 1%, а воспроизводимость, оцененная по коэффициенту вариации, - не более 0,25%. Два фактора обеспечивают это качество прибора: высокая воспризводимость характеристик раствора гемиглобинцианида, который сохраняет свои свойства при надлежащем хранении долгие годы, в т. ч. коэффициента пересчета оптической плотности в концентрацию гемоглобина (или фактора калибровки); конструкция гемоглобинометра МиниГЕМ 540 обеспечивает высокую надежность фотометрических параметров прибора. МиниГЕМ 540 снабжен функцией саморегулирования, он обладает многолетней стабильностью измерений. Другая отличительная особенность гемоглобинометра - полностью автоматизированная процедура фотометрирования. Для определения гемоглобина достаточно опустить кювету с фотометрической пробой в прибор, и через мгновенье на дисплее отобразится значение концентрации. Пересчет оптической плотности раствора в концентрацию производится автоматически. Перед измерением прибор не нужно включать, "прогревать", подстраивать или калибровать. Гемоглобинометр автоматически выключится при вынимании кюветы до следующего измерения. Третья особенность гемоглобинометра МиниГЕМ 540 - его портативность и низкое энергопотребление. Масса прибора без батарей не превышает 300 г. Питание от сети через адаптер или от встроенных батарей. Ресурс батарей - 1 000 000 измерений, или 4 года работы. Для контроля работоспособности гемоглобинометра используется контрольная стеклянная мера, паспортизованная для каждого прибора. Внутрилабораторный и внешний контроль качества может проводиться с помощью обычных контрольных материалов -контрольных растворов гемоглобина. Методика измерений: подготовить пробирки, поместив в каждую из них по 5 мл трансформирующего раствора (раствор Драбкина); во время взятия крови в каждую пробирку перенести по 20 мкл капиллярной крови(0,02 мл пипеткой Сали) и тщательно перемешать раствор; через 20 мин каждую пробирку перед измерением перемешать путем переворачивания пробирки вверх вниз (время лизирования) и провести серию измерений: Учет результата: перелить в оптическую кювету реакционную смесь из очередной пробирки; опустить оптическую кювету в фотометрическую ячейку прибора, при этом автоматически произойдет фотометрирование реакционной смеси, сопровождаемое звуковым сигналом, и на индикаторе появится число, соответствующее концентрации гемоглобина; записать результат измерения.
2.3.2 Унифицированный метод определения концентрации гемоглобина на мини -фотометре MF-1020 Введение: мини фотометры являются миниатюрными настольными приборами для измерения гемоглобина крови. Особенности прибора: цифровой индикатор, кювета открытого типа, относительная устойчивость к светорассеиванию, двухканальная оптическая схема. Прибор показывает концентрацию гемоглобина в г/л. Светопоглощение зеленого света с длиной волны(546 нм) раствором гемиглобинцианида напрямую переводятся в единицы измерения гемоглобина. Настройка и калибровка прибора осуществляется при помощи двух ручек - «ZERO» и «CAL». К прибору прилагается светофильтр (калибратор), назначение которого - убедиться в исправности оптических и электронных узлов и калибровки минифотометра. Масса прибора 1 кг 300 гр. Порядок измерения: 1.Включите прибор. 2.В течение 10 мин прогрейте. 3.Убедитесь в том, что прибор правильно откалиброван. 4.Установите кювету с холостой пробой реагента трансформирующего раствора. 5.С помощью ручки «ZERO» на цифровом индикаторе установите нулевое значение. 6.Приготовьте кровь, разбавив ее 1:251 с трансформирующим раствором и проведите измерение. Приготовление пробы: 1.Двадцать микрометров крови (0,02 мл) необходимо разбавить в 5,0 мл трансформирующего раствора р-ра Драбкина- 1:21 2.Хорошо перемешайте (встряхните). Прежде чем приступить к измерению, подождите 5-10 мин, особенно если реагент не содержит детергент. Калибровка минифотометра по стандартному р-ру гемиглобинцианида Вставьте кювету, содержащую трансформирующий реактив (р-р Драбкина) в кюветный отсек. При помощи ручки «ZERO» установите нулевое значение в цифровом табло. Вставьте кювету, содержащую стандартный р-р гемиглобинцианида, в кюветный отсек. При помощи ручки «CAL» установите данное значение стандартного калибровочного р-ра в цифровом табло (пример 150 г/л). Повторите процедуру калибровки от пункта 1 до пункта 4. Калибровка окончена, и Вы можете приступить к измерению
Калибровка минифотометра при помощи калибратора (по фактору) 1.Вставьте калибратор со светофильтром в кюветный отсек таким образом, чтобы была видна надпись «ZERO» с цифровым значением (например, 0.1.6) 2.При помощи ручки «ZERO» установите это значение (п.п.0.1.6) в цифровом табло. 3.Переверните калибратор и вставьте его в кюветный отсек таким образом, чтобы была видна надпись «CAL» с калибровочным значением (пример 159). 4.При помощи ручки «CAL» установите данное значение на цифровом табло. Повторите процедуру от пункта 1 до пункта 4. Калибровка окончена, и Вы можете приступать к измерениям. Требования к реактивам: 1.Любая модификация р-ра пригодна для применения. 2.Разбавление 10 мкл крови в 2,5 мл трансформирующего не пригодно для этой модели. 3.Можно приготавливать самим р-р-1 раз в месяц, хранится в посуде из темного стекла.
2.3.3 Унифицированный метод определения гемоглобина на фотоэлектроколориметре Принцип метода: Гемоглобин, взаимодействуя с ацетонциангидрином, в присутствии железосинеродистого калия K3[Fe(CN)6] образует гемиглобинцианид красного цвета, интенсивность окраски которого пропорциональна содержанию гемоглобина в пробе крови. Реактивы: 1) трансформирующий раствор (0,5 мл ацетонциангидрина, 0,2 г железосинеродистого калия, 1 г гидрокарбоната натрия NaHCb растворяют в 1 л дистиллированной воды; реактив стоек, хранится в посуде из темного стекла); 2) стандартный раствор гемиглобинцианида (раствор, выпускаемый фирмой «Ренал», содержит 59,75 мг% гемиглобинцианида; раствор фирмы «Иммуна» —64,23 мг%. Это соответствует концентрации гемоглобина в крови 150 и 154 г/л при разведении ее в 251 раз). Ход определения. К 5мл трансформирующего раствора добавляют 0,02 мл (капилляр Сали) крови. При этом кровь разводится в 251 раз. Оставляют пробирки на 20 мин при комнатной температуре. Фотометрируют при зеленом светофильтре (длина волны 540 нм) в кювете с толщиной слоя 10 мм (1 см) против дистиллированной воды. Стандартный раствор фотометрируют при тех же условиях, что и опытную пробу. Расчет. Содержание гемоглобина определяют по калибровочному графику, который строится по стандартному раствору гемиглобинцианида или по формуле:
С=Е о/ Е к х 120 Где С- концентрация гемоглобина в опытной пробе, г/л Ео - оптическая плотность опытной, ед. опт. Плотность Ек- оптическая плотность калибровочной пробы, ед.плот. 120-концекнтрация гемоглобина кВ калибровочном растворе, г/л.
Приготовленные разведения фотометрируют. против дистиллированной воды («холостая» проба). Подсчет эритроцитов
У мужчин: 4,0-5,0 х 10 12 У женщин: 3,7-4,7 х 10 12 Клинико-диагностическое значение: Снижение числа эритроцитов в крови является одним из основных лабораторных критериев анемии. Однако степень эритроцитопении широко варьирует при разных формах малокровия. Так, при наиболее распространенном заболевании — железодефицитной анемии на почве хронических кровопотерь — количество эритроцитов может быть нормальным или нерезко сниженным (3• 106 — 3,6-106 в 1 мкл, или 3-10'2/л — 3,6-10|2/л). При острой кровопотере, В |2 -дефицитной анемии (в стадии рецидива), гипопластической анемии, гемолитических анемиях (в период криза) число эритроцитов в крови может значительно снизиться и достигнуть I -106 в 1 мкл, или 1 • 10|2/л и менее. Повышение количества эритроцитов в крови — эритроцитоз — может быть обусловлен многими причинами. Значительный эритроцитоз (6,5-106—8,5-10е в 1 мкл, или 6,5-10|2/л — 8,5-10|2/л крови) является одним из важных лабораторных симптомов эритремии. Другие гемобластозы миелопролиферативной природы (сублейкемический миелоз или миелофиброз и хронический миелолейкоз) реже сопровождаются эритроцитозом и только в начальной стадии заболевания. Вторичный (симптоматический) эритроцитоз может сопутствовать широкому кругу различных заболеваний и бывает абсолютным (связанный с усилением нормального эритропоэза) и относительным (гемоконцентрационный). Абсолютные эритроцитозы сопутствуют хроническим обструктивным заболеваниям легких, врожденным порокам сердца, первичной легочной гипертензии, синдрому Пиквика, наследственным гемоглобинопатиям, гипернефроидному раку, гемангиобластоме мозжечка, гепатоме, гормонально-активным опухолям, заболеваниям, сопровождающимся стенозом почечных артерий, заболеваниям ЦНС и др. Вторичные относительные эритроцитозы связаны с нарушением гемо-концентрации и характеризуются нормальным объемом циркулирующих эритроцитов при снижении массы циркулирующей крови и массы циркулирующей плазме. Патологические формы эритроцитов Повышение числа эритроцитов — полицитемия, может быть истинной (опухолево-пролиферативный процесс) и симптоматической (реактивное раздражение эритропоэза, сгущение крови, нарушение нервной регуляции и перераспределения). Понижение числа эритроцитов — анемия (постгеморрагическая, гемолитическая, вследствие нарушения кроветворения). Качественные изменения эритроцитов. Анизоцитоз — изменение величины эритроцитов (эритроциты меньших размеров называются микроцитами; больших — макроцитами, эритроциты диаметром 12 мкм и более называются мегалоцитами). Пойкилоцитоз — изменение формы эритроцитов (грушевидные, серповидные — дрепаноциты, каплевидные, мишеневидные, с вытянутыми концами, шизоциты — обломки разрушенных эритроцитов, акантоциты — эритроциты зубчатой формы, стоматоциты — эритроциты с просветлением в центре в виде узкой линейной полоски как форма рта, эхиноциты — эритроциты с множественными выростами, анулоциты — эритроциты в виде пустых колец). Анизохромия — изменение интенсивности окраски эритроцитов в патологических случаях. Встречаются бледно окрашенные эритроциты — гипохромия, интенсивно окрашенные — гиперхромия. Эритроциты могут окрашиваться не только кислыми, но и основными красителями — полихромазия. Обнаруживаются при патологии в периферической крови ядросодержащие эритроциты: нормобласты, эритробласты и мегалобласты. Мегалоциты и мегалобласты характерны для анемии Аддисона-Бирмера. В эритроцитах можно иногда обнаружить остатки ядерной оболочки — так называемые кольца Кебота и ядерные остатки — тельца Жолли при мегалобластных анемиях, отравлении гемолитическими ядами и др. При свинцовом отравлении и у людей, принимающих препараты крови, наблюдается базофильная пунктуация эритроцитов (наличие точечной зернистости). Сидероциты — эритроциты с включениями не гемоглобинового железа (ферритин, гемосидерин) в виде мелких гранул синего цвета.
2.5 Подсчет лейкоцитов Вывод формулы подсчета № 2 1. Объем малого квадрата 1/4000 мм3. 2. Объем одного большого квадрата, содержащего 16 маленьких, 3. Объем 100 больших квадратов 100 • 4/1000 = 4/10 мм3. 4. Количество лейкоцитов в 1 мм3 камеры вычисляется из пропорции: Х= "1"хАх10 5. Количество лейкоцитов в 1 мкл периферической крови, т.е. с учетом Ах, 10•х20 = Ах50 Практически подсчитанное количество лейкоцитов (при разведении в 20 раз) умножают на 50. Клинико-диагностическое значение: Содержание лейкоцитов в норме в 1 мкл крови составляет 4000—9000 (4—9 • 103/мкл). По системе СИ число лейкоцитов выражают содержанием их в 1 литре (л) крови. Коэффициент пересчета с обычно употребляемых тысяч (тыс.) в 1 мм3, выраженных как «тыс. 103/мм3», в рекомендуемые по СИ «тыс. • 109/л» равен 106. Таким образом, 4000-9000 лейкоцитов в 1 мкл выражаются как 4—9 • 103/л. Увеличение числа лейкоцитов в крови (выше 9 • 109/л) называется лейкоцитозом, уменьшение (менее 4 • 109/л) — лейкопенией. Лейкоцитоз может быть: Перераспределительным, когда возникает в результате сосудистых реакций с освобождением кровяных депо при приеме пищи, мышечной работе, эмоциях, шоке. Реактивным, когда проявляется как временная реакция крови на инфекцию или интоксикацию (временная гиперплазия костного мозга); бластные клетки при этом в периферической крови никогда не появляются. Такой лейкоцитоз наблюдается при пневмониях, гнойных заболеваниях, инфаркте миокарда, отравлении угарным газом, грибами. При лейкозах, когда он достигает наибольших цифр (100 000— 800 000-1 000 000, т.е. 100 • 109- 800 • 109-1000 • 109/л) и обусловлен опухолевой гиперплазией самой кроветворной ткани, в крови могут появляться при этом бластные клетки. Лейкопения может возникать: При бактериальных и вирусных заболеваниях (брюшной тиф, грипп, корь, вирусный гепатит, сепсис). При агранулоцитозах: иммунных, когда к лейкоцитам начинают вырабатываться антитела — при системной красной волчанке, ревматоидном артрите, приеме лекарств (анальгин, сульфаниламиды и др.); токсических — при воздействии ионизирующего излучения, испорченных злаков. При лейкопенических формах лейкозов, т.е. протекающих с низким числом клеток в периферической крови независимо от их качественного состава. Так могут проявляться начальная стадия острого лейкоза или терминальная стадия хронического миелоза. При спленомегалиях с картиной гиперспленизма, или угнетения кроветворения, объясняемых функциональной гиперреактивностью селезенки в отношении ее влияния на кроветворение (депрессорный и гемолитический механизмы) при системных и изолированных спленомегалиях.
Приготовление мазков крови
2.8.1 Методика приготовления мазков крови
Способ № 1: Стерильным предметным стеклом прикасаются к капле крови на месте укола. Не следует прикасаться стеклом к коже пальца. Способ № 2: Кровь берут с индивидуального стерильного капилляра Панченкова на стекло Мазок делают шлифовальным стеклом, поставив его под углом в 45° к предметному стеклу впереди капли. Подведя стекло к этой капле, ждут, пока кровь расплывется вдоль его ребра, затем быстрым легким движением проводят шлифовальное стекло вперед, не отрывая от предметного раньше, чем иссякнет вся капля. Нельзя сильно прижимать на стекло, т.к. при этом травмируются форменные элементы крови. Правильно сделанный мазок имеет желтоватый цвет (тонкий), не достигает краев стекла 1-1,5 см и заканчивается в виде следа («усов», «метелочки»). Мазки высушивают на воздухе и маркируют простым карандашом (пишут фамилию). Окрашивание сухих мазков производят после предварительной фиксации. Требования к мазку 1.Вся капля крови должна быть использована для мазка 2.Мазок должен занимать примерно 3\4 предметного стекла 3.Хорошо должен быть выражен край мазка 4.Мазок должен быть полупрозрачен и иметь желтоватый тон Фиксирующие жидкости: 1. Метиловый спирт (3—5 мин) (унифицированный) 2.Смесь Никифорова из равных частей абсолютного этилового спирта и эфира (30 мин). 3. Краситель-фиксатор Мая - Грюнвальда (3 мин)- (унифицированный)
Клиническое значение фиксирующих жидкостей: Фиксация предохраняет эритроциты от гемолиза и закрепляет мазок на стекле. Основные гематологические краски: метиленовый синий и его производное — азур I (метиленовый азуровый) и азур II (смесь равных частей азура I и метиленового синего), к кислым — водорастворимый желтый эозин Окраски мазков Реактивы для окраски мазков по Нохту. 1. Основной раствор азура II: 1 г краски растворяют в 1000 мл дистиллированной воды. Оставляют в посуде из темного стекла на 12—14 дней при комнатной температуре, после чего используют. 2. Основной раствор эозина калия: 1 г краски растворяют в 1000 мл дистиллированной воды. Оставляют в посуде из темного стекла при комнатной температуре на 12— 14 дней, затем используют. 3. Фосфатный буфер (смесь Вейзе) рН 7,4—7,5: смешивают 0,49 г калия фосфата однозамещенного безводного (КН2Р04) и 0,909 г натрия фосфата двузамещенного безводного (Na2HPO,t) и дистиллированной воды 1000 мл. 4. Рабочий раствор азур-эозина: перед употреблением смешивают 25 мл основного раствора азура II, 20 мл основного раствора эозина калия и 55 мл буферного раствора (пропорции красителей могут варьировать, их устанавливают опытным путем при приготовлении свежих партий основных растворов). Реактивы для окраски мазков по Паппенгейму. 1. Раствор эозин-метиленового синего по Маю — Грюнвальду. При отсутствии готового раствора красителя его можно приготовить, растворив 1 г сухого красителя в 1000 мл метилового спирта. Раствор готов к употреблению через 4 дня. 2. Рабочий раствор азур-эозина по Нохту. Специальное оборудование. Кювета для фиксации и окраски мазков со штативом-контейнером (при отсутствии используют эмалированные лотки с установленными для стекол «рельсами» из пары стеклянных палочек, соединенных резиновыми трубками). Фиксация мазков. Фиксатор мазков наливают либо в кювету, либо в широкогорлую посуду с притертой пробкой. Высушенные на воздухе мазки помещают в контейнер, который опускают в кювету с фиксатором (или кладут по одному в посуду) на 5—10 мин. Вынимают контейнер со стеклами из кюветы (или вынимают пинцетом стекла и устанавливают в штативе), оставляют на воздухе до полного высыхания.
Окраска по Нохту. Высохшие фиксированные мазки, не вынимая из контейнера, помещают в кювету с рабочим раствором краски на строго определенное время, подобранное для каждой партии красителя (от 20 до 45 мин). При отсутствии кюветы с контейнером стекла помещают горизонтально на «рельсы» (мазком кверху) и наливают высокий слой (3—4 мл на мазок) рабочего раствора краски. Вынимают контейнер со стеклами из кюветы с красителем и помещают его в кювету с водопроводной водой (при отсутствии кюветы краску со стекол смывают, не снимая их с «рельсов», водопроводной водой). Высушивают мазки на воздухе.
Окраска по Романовскому — Г и м з е Производится так же, как и по Нохту: в качестве красителя используют готовый раствор Романовского—Гимзы, который перед употреблением разводят из расчета 1 капля краски на 1 мл дистиллированной воды(1:10). Время окраски устанавливают опытным путем для каждой новой партии красителя (25—40 мин) = 30 мин
Комбинированная окраска Мая—Грюнвальда—Романовского—Гимзе по Паппенгему. На нефиксированный мазок наливают пипеткой готовый краситель — фиксатор Мая—Грюнвальда, представляющий собой раствор эозин-метиленового синего в метиленовом спирте, на 3 мин. Через 3 мин к покрывающей раствор краске добавляют равное количество дистиллированной воды и продолжают окрашивание еще 1 мин. После этого краску смывают и мазок высушивают на воздухе. Затем высушенный мазок докрашивают свежеприготовленным водным раствором краски Романовского в течение 8—15 мин.(=10 мин).
2.9.Лейкоцитарная формула
2.9.1 Методика подсчета лейкоцитарной формулы Количество лейкоцитов в сосудистом русле зависит от выраженности процессов их образования, скорости их выхода (мобилизации) из костного мозга и перемещения в ткани (в особенности в очаги повреждения), от степени захвата легкими и селезенкой. В силу этих и других причин содержание лейкоцитов в крови здорового человека подвержено определенным колебаниям: оно повышается к концу дня, при физической наг
|
||||||||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 1868; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.214.244 (0.017 с.) |