Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электрические явления в ТКАНяхСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Открытие «животного электричества» В конце XVIII в. (1786 г.) профессор анатомии Болонского университета Луиджи Гальвани провел ряд опытов, положивших начало целенаправленным исследованиям биоэлектрических явлений. В первом опыте, подвешивая препарат обнаженных задних лапок лягушек с помощью медного крючка на железной решетке, Л.Гальвани обнаружил, что всякий раз при касании мышцами решетки они отчетливо сокращались. Л.Гальвани высказал предположение о том, что сокращение мышц является следствием воздействия на них электричества, источником которого выступают «животные ткани» — мышцы и нервы. Однако другой итальянский исследователь — физик и физиолог Вольта оспорил это заключение. По его мнению, причиной сокращения мышц был электрический ток, возникающий в области контакта двух разнородных металлов (медь и железо — гальваническая пара) с тканями лягушки. С целью проверки своей гипотезы Л.Гальвани поставил второй опыт, в котором нерв нервно-мышечного препарата набрасывался на мышцу стеклянным крючком так, чтобы он касался поврежденного и неповрежденного ее участков. В этом случае мышца также сокращалась. Второй опыт Л.Гальвани считается опытом, в котором были получены абсолютные доказательства существования «животного электричества». Регистрация биоэлектрических явлений впервые осуществлена с помощью гальванометра, одна из клемм которого присоединялась к поврежденному участку мышцы, другая — к неповрежденному [Маттеучи, 1838], при этом стрелка гальванометра отклонялась. Размыкание цепи гальванометра сопровождалось возвращением стрелки гальванометра в прежнее (нулевое) положение. В настоящее время существует много различных вариантов регистрации биоэлектрических явлений, но их можно объединить в две основные группы: по местоположению электродов (внутриклеточное и внеклеточное отведения) и по числу отводящих электродов (монополярное, биполярное, мультиполярное отведения). Электроды могут быть металлическими и стеклянными. В случае монополярного отведения один электрод активный, второй — индифферентный, его площадь в десятки раз больше активного электрода. При внутриклеточном отведении применяется стеклянный микроэлектрод, который представляет собой микропипетку с диаметром кончика 0,5—1 мкм. Микроэлектрод заполняется 3М КС1. В широкую часть микроэлектрода вставляется серебряная проволочка, соединяемая с регистрирующим устройством. Индифферентным внеклеточным электродом является хлорированная серебряная пластинка. При внутриклеточном отведении клетка способна функционировать в течение нескольких часов. Микроэлектродный способ регистрации биопотенциалов обеспечил изучение механизмов создания электрических зарядов клеткой, возникновения возбуждения в живых клетках. Однако еще задолго до появления микроэлектродной техники (конец XIX в.) стало ясно, что «животное электричество» обусловлено процессами, происходящими на клеточной мембране (Герман, Дюбуа-Реймон, Бернштейн). В настоящее время достаточно хорошо изучены механизмы формирования мембранного потенциала покоя (ПП) и потенциала действия (ПД), т.е. процесса возбуждения клетки. Сущность процесса возбуждения заключается в следующем. Все клетки организма имеют электрический заряд, обеспечиваемый неодинаковой концентрацией анионов и катионов внутри и вне клетки. Различная концентрация анионов и катионов внутри и вне клетки является следствием работы ионных насосов и неодинаковой проницаемости клеточной мембраны для разных ионов. Однако свойства мембран возбудимых клеток существенно отличаются от таковых невозбудимых клеток. При действии раздражителя на клетку возбудимой ткани изменяется проницаемость ее мембраны (обычно сначала для Na+ и быстро возвращается к норме, затем для К+ и быстро возвращается к норме), вследствие чего ионы быстро перемещаются согласно электрохимическому градиенту (совокупность концентрационного и электрического градиентов) — это и есть процесс возбуждения. Его основой является потенциал покоя (мембранный потенциал). Потенциал покоя (ПП) Потенциал покоя — относительно стабильная разность электрических потенциалов между наружной и внутренней сторонами клеточной мембраны. Его величина обычно варьирует в пределах 30—90 мВ (в волокнах скелетной мышцы — 60—90 мВ, в нервных клетках — 50—80 мВ, в гладких мышцах — 30— 70 мВ, в сердечной мышце — 80—90 мВ). При регистрации ПП луч осциллографа во время прокола мембраны клетки микроэлектродом скачком отклоняется и показывает отрицательный заряд внутри. ПП играет исключительно важную роль в жизнедеятельности самой клетки и организма в целом, поскольку является основой для возникновения возбуждения (потенциала действия), с помощью которого нервная система воспринимает и перерабатывает информацию, регулирует деятельность внутренних органов и опорно-двигательного аппарата посредством запуска процессов возбуждения и сокращения в мышце. Нарушение процессов возбуждения в кардиомиоцитах ведет к остановке сердца. Таблица 1. Внутри- и внеклеточные концентрации ионов (ммоль∙ л-1) в мышечных клетках гомойотермных животных (А- — высокомолекулярные внутриклеточные анионы)
Согласно мембранно-ионной теории [Бернштейн, Ходжкин, Хаксли, Катц, 1902— 1952], непосредственной причиной формирования ПП является неодинаковая концентрация анионов и катионов внутри и вне клетки (табл.1). В нервных и мышечных клетках концентрация К+ внутри клетки в 30—40 раз больше, чем вне клетки; концентрация Na+ вне клетки в 10—12 раз больше, нежели в клетке. Ионов Сl-вне клетки в 30—50 раз больше, чем внутри клетки. В клетке имеется небольшое количество ионов Mg2+. Кальций в свободном состоянии находится в основном вне клетки. Он содержится также в эндоплазматическом ретикулуме; в гиалоплазме его очень мало. Это обусловливается отчасти активным транспортом Са2+ наружу через клеточную мембрану, отчасти поглощением его эндоплазматическим ретикулумом (это резервуар для Са2+) и другими органеллами, например митохондриями, связыванием Са2+ цитратом, глутаматом. В клетке находятся также крупномолекулярные анионы; главным образом это отрицательно заряженные белковые молекулы, например глутамат, аспартат, а также органические фосфаты. Различные ионы распределены неравномерно по обе стороны клеточной мембраны, во-первых, вследствие неодинаковой проницаемости клеточной мембраны для различных ионов, во-вторых — в результате работы ионных насосов, транспортирующих ионы в клетку и из клетки вопреки концентрационному и электрическому градиентам. Роль проницаемости клеточной мембраны в формировании ПП. Проницаемость клеточной мембраны — это ее способность пропускать воду, незаряженные и заряженные частицы (ионы) согласно законам диффузии и фильтрации. Проницаемость клеточной мембраны определяется следующими факторами: 1) наличием в составе мембраны различных ионных каналов — управляемых (с воротным механизмом) и неуправляемых (каналов утечки); 2) размерами каналов и размерами частиц; 3) растворимостью частиц в мембране (клеточная мембрана проницаема для растворимых в ней липидов и непроницаема для пептидов). Термин «проводимость» следует использовать только лишь применительно к заряженным частицам. Следовательно, проводимость — это способность заряженных частиц (ионов) проходить через клеточную мембрану согласно электрохимическому градиенту. Ионы, подобно незаряженным частицам, переходят через мембрану из области с высокой концентрацией в область с низкой концентрацией. При большом градиенте концентрации и хорошей проницаемости мембраны, разделяющей соответствующие растворы, проводимость ионов может быть высокой, при этом наблюдается односторонний ток ионов. Если разность концентраций ионов по обе стороны мембраны снизится, то проводимость ионов также уменьшится, хотя проницаемость сохранится прежней — высокой. Кроме того, проводимость иона при неизменной проницаемости мембраны зависит и от заряда иона: одноименные заряды отталкиваются, разноименные — притягиваются. Возможна ситуация, когда при хорошей проницаемости мембраны проводимость ионов через мембрану оказывается низкой или нулевой в случае отсутствия движущей силы — концентрационного и(или) электрического градиентов (их совокупность называют электрохимическим градиентом). Таким образом, проводимость иона зависит от его электрохимического градиента и от проницаемости мембраны: чем они больше, тем лучше проводимость иона через мембрану. Перемещения ионов в клетку и из клетки, согласно концентрационному и электрическому градиентам в состоянии покоя клетки, осуществляются преимущественно через неуправляемые (без воротного механизма) каналы, их называют также каналами утечки. Неуправляемые каналы всегда открыты, они практически не меняют своей пропускной способности при электрическом воздействии на клеточную мембрану и ее возбуждении. Неуправляемые каналы подразделяются на ионоселективные каналы (например, калиевые медленные неуправляемые каналы) и иононеселективные каналы. Последние пропускают различные ионы — К+, Na+, Сl-. Роль проницаемости клеточной мембраны и различных ионов в формировании ПП. Na+ и К+ в покоящейся клетке перемещаются через мембрану согласно законам диффузии, при этом К+ из клетки выходит в значительно большем количестве, чем входит Na+ в клетку, поскольку проницаемость клеточной мембраны для К+ примерно в 25 раз больше проницаемости для Na+. Органические анионы из-за своих больших размеров не могут выходить из клетки, поэтому внутри клетки в состоянии покоя отрицательных ионов оказывается больше, чем положительных. По этой причине клетка изнутри имеет отрицательный заряд. Интересно, что во всех точках клетки отрицательный заряд практически одинаков. Об этом свидетельствует одинаковая величина ПП при введении микроэлектрода на разную глубину внутрь клетки, как это имело место в опытах Ходжкина, Хаксли и Катца. Гигантский аксон кальмара (его диаметр около 1 мм) в этом опыте находился в морской воде, один электрод вводился в аксон, другой помещали в морскую воду. Заряд внутри клетки является отрицательным как абсолютно (в гиалоплазме клетки содержится больше анионов, нежели катионов), так и относительно наружной поверхности клеточной мембраны. Однако превышение абсолютного числа анионов над числом катионов в клетке чрезвычайно мало. Но этого различия достаточно для создания разности электрических потенциалов внутри и вне клетки. Главным ионом, обеспечивающим формирование ПП, является ион К+. Об этом свидетельствуют результаты опыта с перфузией внутреннего содержимого гигантского аксона кальмара солевыми растворами. При уменьшении концентрации К+ в перфузате ПП уменьшается, при увеличении концентрации К+ ПП увеличивается. В покоящейся клетке устанавливается динамическое равновесие между числом выходящих из клетки и входящих в клетку ионов К+. Электрический и концентрационный градиенты противодействуют друг другу: согласно концентрационному градиенту К+ стремится выйти из клетки, отрицательный заряд внутри клетки и положительный заряд наружной поверхности клеточной мембраны препятствуют этому. Когда концентрационный и электрический градиенты уравновесятся, число выходящих из клетки ионов К+ сравнивается с числом входящих ионов К+ в клетку. В этом случае на клеточной мембране устанавливается так называемый равновесный калиевый потенциал. Равновесный потенциал для любого иона можно рассчитать по формуле Нернста. Концентрация положительно заряженного иона, находящегося снаружи, в формуле Нернста располагается в числителе, иона, находящегося внутри клетки, — в знаменателе. Для отрицательно заряженных ионов расположение противоположное.
где Eion — потенциал, создаваемый данным ионом; R — газовая постоянная (8,31 Дм); Т — абсолютная температура (273+37 °С); Z — валентность иона; F — постоянная Фарадея (9,65-1 04); [ion]i — концентрация иона внутри клетки inside; [ion]0 — концентрация иона во внешней среде клетки (outside). При температуре 37 °С равновесный потенциал для К+ с учетом соотношения концентрации его снаружи и изнутри (1/39) и валентности 1 равен —97 мВ. Однако реальный ПП миоцита теплокровного животного несколько меньше — около —90 мВ. Это объясняется тем, что в создании потенциала ПП принимают участие и другие ионы, хотя их роль менее значительна в сравнении с ролью иона К+. Равновесный потенциал для Na+ равен +55 мВ. В целом ПП — это производное равновесных потенциалов всех ионов, находящихся внутри и вне клетки и поверхностных зарядов клеточной мембраны. Вклад Na+ и Сl- в создание ПП. Проницаемость клеточной мембраны в покое для Na+ очень низкая — намного ниже, чем для К+, тем не менее она имеет место, поэтому ионы Na+, согласно концентрационному и электрическому градиентам, стремятся и в небольшом количестве проходят внутрь клетки. Это ведет к уменьшению ПП, так как на внешней поверхности клеточной мембраны суммарное число положительно заряженных ионов уменьшается, хотя и незначительно, а часть отрицательных ионов внутри клетки нейтрализуется входящими в клетку положительно заряженными ионами Na+. Вход Na+ внутрь клетки уменьшает ПП. Что касается Сl-, его влияние на величину ПП противоположно влиянию Na+ и зависит от проницаемости клеточной мембраны для Сl- (она в 2 раза ниже, чем для К+). Дело в том, что Сl-, согласно концентрационному градиенту, стремится и проходит в клетку. Концентрации ионов К+ и Сl- близки между собой. Но Сl- находится в основном вне клетки, а К+ — внутри клетки. Препятствует входу Сl- в клетку электрический градиент, поскольку заряд внутри клетки отрицательный, как и заряд Сl-. Наступает равновесие сил концентрационного градиента, способствующего входу Сl- в клетку, и электрического градиента, препятствующего входу Сl- в клетку. Поэтому внутриклеточная концентрация Сl- равна всего лишь 5—10 ммоль/л, а вне клетки — 120—130 ммоль/л. При поступлении Сl- внутрь клетки число отрицательных зарядов вне клетки несколько уменьшается, а внутри клетки увеличивается: Сl- добавляется к крупным белковой природы анионам, находящимся внутри клетки. Эти анионы из-за своих больших размеров не могут пройти через каналы клеточной мембраны наружу клетки — в интерстиций. Таким образом, Сl-, проникая внутрь клетки, увеличивает ПП. Частично, как и вне клетки, Na+ и Сl- внутри клетки нейтрализуют друг друга. Вследствие этого совместное поступление Na+ и Сl- внутрь клетки не сказывается существенно на величине ПП. Роль поверхностных зарядов клеточной мембраны и ионов Са2+ в формировании ПП. Наружная и внутренняя поверхности клеточной мембраны несут собственные электрические заряды, преимущественно с отрицательным знаком. Это полярные молекулы клеточной мембраны — гликолипиды, фосфолипиды, гликопротеиды. Фиксированные наружные отрицательные заряды, нейтрализуя положительные заряды внешней поверхности мембраны, уменьшают ПП. Фиксированные внутренние отрицательные заряды клеточной мембраны, напротив, суммируясь с анионами внутри клетки, увеличивают ПП. Роль ионов Са2+ в формировании ПП заключается в том, что они взаимодействуют с наружными отрицательными фиксированными зарядами мембраны клетки и отрицательными карбоксильными группами интерстиция и нейтрализуют их, что ведет к увеличению и стабилизации ПП. Таким образом, ПП — это алгебраическая сумма не только всех зарядов ионов вне и внутри клетки, но также алгебраическая сумма отрицательных внешних и внутренних поверхностных зарядов самой мембраны. Роль проницаемости клеточной мембраны в происхождении ПП иллюстрируется на модельном опыте (рис.1). Сосуд разделен полупроницаемой мембраной. Обе его половины заполнены раствора ми K2SO4 различной концентрации (С1 и С2), причем С1< С2. Мембрана проницаема для К+ и непроницаема для SO2-4. Ионы К+ перемещаются, согласно концентрационному градиенту, из раствора С2 в раствор С1. Поскольку ионы SO2-4 не могут пройти в раствор С1, где их концентрация тоже ниже, мембрана поляризуется и между двумя ее поверхностями возникает разность электрических потенциалов, соответствующая равновесному калиевому потенциалу (Ек). В растворе С2 остается больше отрицательных зарядов, в растворе С1 становится больше положительных зарядов. При проведении измерений потенциал окружающей клетку среды принимают за величину, равную нулю. Относительно нулевого потенциала внешней среды потенциал внутренней среды клетки, как отмечалось выше, составляет величину порядка —60—90 мВ. Повреждение клетки приводит к повышению проницаемости клеточных мембран, в результате чего различие проницаемости для К+ и Na+ уменьшается; ПП при этом снижается. Подобные изменения встречаются при ишемии ткани, например миокарда. У сильно поврежденных клеток ПП может снизиться до уровня доннановского равновесия, что нарушает электрическую активность клеток органа в целом или его части. Однако и в норме происходит перемещение ионов согласно электрохимическому градиенту.
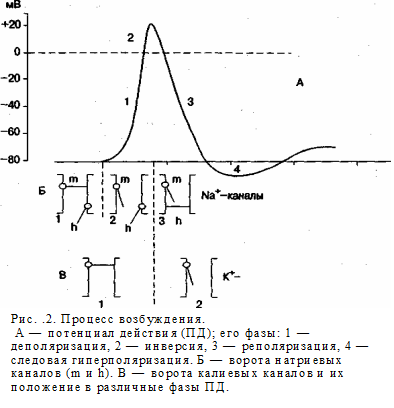
Нормальная величина ПП является необходимым условием возникновения процесса возбуждения клетки, т.е. возникновения и распространения потенциала действия, инициирующего специфическую деятельность клетки. Потенциал действия (ПД) ПД — это электрофизиологический процесс, выражающийся в быстром колебании мембранного потенциала покоя вследствие перемещения ионов в клетку и из клетки и способный распространяться без декремента (без затухания). ПД обеспечивает передачу сигналов между нервными клетками, нервными центрами и рабочими органами, в мышцах ПД обеспечивает процесс электромеханического сопряжения. Схематично ПД представлен на рис., А. Величина ПД колеблется в пределах 80— 130 мВ, длительность пика ПД нервного волокна — 0,5—1 мс, волокна скелетной мышцы — до 10 мс с учетом замедления ре-поляризации в конце ее. Длительность ПД сердечной мышцы —300—400 мс. Амплитуда ПД не зависит от силы раздражения — она всегда максимальна для данной клетки в конкретных условиях: ПД подчиняется закону «все или ничего», но не подчиняется закону силовых отношений — закону силы. ПД либо совсем не возникает при раздражении клетки, если оно мало, либо достигает максимальной величины, если раздражение является пороговым или сверхпороговым. Следует отметить, что слабое (подпороговое) раздражение может вызвать локальный потенциал. Он подчиняется закону силы: с увеличением силы стимула величина его возрастает. В составе ПД различают три фазы: 1 — деполяризацию, т.е. исчезновение заряда клетки — уменьшение мембранного потенциала до нуля; 2 — инверсию, т.е. изменение знака заряда клетки на обратный, когда внутренняя сторона мембраны клетки заряжается положительно, а внешняя — отрицательно (лат. inversio — переворачивание); 3 — реполяризацию, т.е. восстановление исходного заряда клетки, когда внутренняя поверхность клеточной мембраны снова заряжается отрицательно, а наружная — положительно.
Механизм возникновения ПД. Если действие раздражителя на клеточную мембрану приводит к началу развития ПД, далее сам процесс развития ПД вызывают фазовые изменения проницаемости клеточной мембраны, что обеспечивает быстрое движение Na+ в клетку, а К+ — из клетки. Это наиболее часто встречаемый вариант возникновения ПД. Величина мембранного потенциала при этом сначала уменьшается, а затем снова восстанавливается до исходного уровня. На экране осциллографа отмеченные изменения мембранного потенциала предстают в виде пикового потенциала — ПД. Он возникает вследствие накопленных и поддерживаемых ионными насосами градиентов концентраций ионов внутри и вне клетки, т.е. за счет потенциальной энергии в виде электрохимических градиентов ионов. Если заблокировать процесс выработки энергии, потенциалы действия некоторый период времени будут возникать. Но после исчезновения градиентов концентраций ионов (устранения потенциальной энергии) клетка генерировать ПД не будет. Рассмотрим фазы ПД. 1) фаза деполяризации — процесс исчезновения заряда клетки до нуля; 2) фаза инверсии — изменение знака заряда клетки на противоположный, т.е. весь период ПД, когда внутри клетки заряд положительный, а снаружи отрицательный; 3) фаза реполяризации — восстановление заряда клетки до исходной величины (возврат к потенциалу покоя). 1. Фаза деполяризации (см. рис.2, А-1). При действии деполяризующего раздражителя на клетку (медиатор, электрический ток) начальная частичная деполяризация клеточной мембраны происходит без изменения ее проницаемости для ионов. Поэтому, несмотря на наличие движущей силы (концентрационный и электрический градиенты), движение Na+ в клетку через быстрые потенциалчувствительные Na-каналы отсутствует. Напомним, что клетка внутри заряжена отрицательно (разноименные заряды притягиваются друг к другу), а концентрация Na+ вне клетки в 10—12 раз больше, чем внутри клетки. Условием же, обеспечивающим вход Na+ в клетку, является увеличение проницаемости клеточной мембраны, которая определяется состоянием воротного механизма Na-каналов (в некоторых клетках, например в кардиомиоцитах, в волокнах гладкой мышцы, важную роль в возникновении ПД играют управляемые каналы для Са2+). Длительность пребывания электроуправляемого канала в открытом состоянии зависит от величины мембранного потенциала. Суммарный ток ионов в любой момент определяется числом открытых каналов клеточной мембраны и наличием электрохимических градиентов ионов. Часть ионного канала, обращенная во внеклеточное пространство, отличается от части канала, обращенной внутрь клеточной среды (П.Г.Костюк). Воротный механизм Nа-каналов расположен на внешней и внутренней сторонах клеточной мембраны, воротный механизм К-каналов — на внутренней (К+ движется из клетки наружу). В каналах для Nа+ имеются активационные m-ворота, которые расположены с внешней стороны клеточной мембраны (Na+ движется внутрь клетки во время ее возбуждения), и инактивационные h-ворота, расположенные с внутренней стороны клеточной мембраны. В условиях покоя активационные m-ворота закрыты, инактивационные h-ворота преимущественно (около 80 %) открыты (см. рис. 2, Б-1); закрыты также калиевые активационные ворота (см. рис.2, В-1), инактивационных ворот для К+ нет. Некоторые авторы называют m-ворота быстрыми, h-ворота — медленными, поскольку они в процессе возбуждения клетки реагируют позже, нежели m-ворота. Однако более поздняя реакция h-ворот связана с изменением заряда клетки, как и m-ворот, которые открываются в процессе деполяризации клеточной мембраны. h-ворота закрываются в фазе инверсии, когда заряд внутри клетки становится положительным, что и является причиной их закрытия, при этом нарастание пика ПД прекращается. По существу m-ворота являются ранними, h-ворота — поздними. Когда деполяризация клетки достигает критической величины (Екр., критический уровень деполяризации — КУД), которая обычно составляет 50 мВ (возможны и другие величины), проницаемость мембраны для Na+ резко возрастает — открывается большое число потенциалзависимых m-ворот Na-каналов (см. рис.2, Б-2) и Na+ лавиной устремляется в клетку. Через один открытый Na-канал за 1 мс проходит до 6000 ионов. В результате интенсивного тока Na+ внутрь клетки процесс деполяризации проходит очень быстро. Развивающаяся деполяризация клеточной мембраны вызывает дополнительное увеличение ее проницаемости и, естественно, проводимости Na+ — открываются все новые и новые активационные m-ворота Na-каналов, что придает току Na+ в клетку характер регенеративного процесса. В итоге ПП исчезает, становится равным нулю. Фаза деполяризации на этом заканчивается. 2. Фаза инверсии. После исчезновения ПП вход Na+ в клетку продолжается (m-ворота Na-каналов еще открыты), поэтому число положительных ионов в клетке превосходит число отрицательных ионов, заряд внутри клетки становится положительным, снаружи — отрицательным. Процесс перезарядки мембраны представляет собой вторую фазу потенциала действия — фазу инверсии (см. рис.2, А-2). Теперь электрический градиент препятствует входу Na+ внутрь клетки (положительные заряды отталкиваются друг от друга), Na-проводимость снижается. Тем не менее, некоторый период времени (доли миллисекунды) Na+ продолжает входить в клетку — об этом свидетельствует продолжающееся нарастание ПД. Это означает, что концентрационный градиент, обеспечивающий движение Na+ в клетку, сильнее электрического, препятствующего входу Na+ в клетку. Во время деполяризации мембраны увеличивается проницаемость ее и для Са2+, он также идет в клетку, но в нервных волокнах, нейронах и клетках скелетной мускулатуры роль Са2+ в развитии ПД мала. В клетках гладкой мышцы и миокарда его роль существенна. Таким образом, вся восходящая часть пика ПД в большинстве случаев обеспечивается в основном входом Na+ в клетку. Примерно через 0,5—2 мс и более после начала деполяризации (это время зависит от вида клетки) рост ПД прекращается вследствие закрытия натриевых инактивационных h-ворот и прекращения поступления Na+ в клетку (см. рис.2, Б-3) и открытия ворот К-каналов, ведущего к резкому возрастанию выхода К+ из клетки (см. рис.2, В-2). Препятствуют также росту пика ПД электрический градиент (клетка внутри в этот момент заряжена положительно), а также выход К+ из клетки по каналам утечки. Поскольку К+ находится преимущественно внутри клетки, он, согласно концентрационному градиенту, быстро выходит из клетки после открытия ворот К+ каналов, вследствие чего уменьшается число положительно заряженных ионов в клетке. Заряд клетки снова начинает уменьшаться. В период нисходящей части фазы инверсии выходу К+ из клетки способствует также и электрический градиент. К+ выталкивается положительным зарядом из клетки и притягивается отрицательным зарядом снаружи клетки. Так продолжается до полного исчезновения положительного заряда внутри клетки (до конца нисходящей части фазы инверсии — см. рис.2, А-2, пунктирная линия). Калий выходит из клетки не только по управляемым каналам, ворота которых открыты, но и по неуправляемым — каналам утечки, что несколько замедляет ход восходящей части ПД и ускоряет ход нисходящей составляющей ПД. Таким образом, изменение мембранного потенциала покоя ведет к последовательному открытию или закрытию электроуправляемых ворот ионных каналов и движение ионов, согласно электрохимическому градиенту, — возникновению ПД. Все фазы являются регенеративными — необходимо только достичь критического уровня деполяризации, далее ПД развивается за счет потенциальной энергии клетки в виде электрохимических градиентов, т.е. вторично активно. Амплитуда ПД складывается из величины ПП и величины фазы инверсии, составляющей у разных клеток 10—50 мВ. Если мембранный потенциал покоящейся клетки мал, амплитуда ПД этой клетки небольшая. 3. Фаза реполяризации (см. рис.2, А-3) связана с тем, что проницаемость клеточной мембраны для К+ все еще высока (активационные ворота калиевых каналов открыты), К+ продолжает быстро выходить из клетки согласно концентрационному градиенту. Поскольку клетка теперь уже снова внутри имеет отрицательный заряд, а снаружи — положительный (см. рис. 2, А-3), электрический градиент препятствует выходу К+ из клетки, что снижает его проводимость, хотя он продолжает выходить. Это объясняется тем, что действие концентрационного градиента выражено значительно сильнее электрического градиента. Таким образом, вся нисходящая часть пика ПД обусловлена выходом К+ из клетки. Нередко в конце ПД наблюдается замедление реполяризации, что объясняется уменьшением проницаемости клеточной мембраны для К+ и замедлением выхода его из клетки из-за закрытия значительной части ворот К-каналов. Вторая причина замедления тока К+ из клетки связана с возрастанием положительного заряда наружной поверхности клетки и формированием противоположно направленного электрического градиента. При наличии определенного ПП, как следует из описанных механизмов, ПД не должен возникать, если клетку перенести в солевой раствор, не содержащий Na+, что и было продемонстрировано в экспериментах. Если аксон помещать в растворы с различной концентрацией Na+, величина ПД будет уменьшаться с уменьшением концентрации Na+ в окружающей нервное волокно среде. ПД также уменьшается, если частично заблокировать Na-каналы тетродотоксином. При их полной блокаде ПД вообще не возникает. Возможность временного нарушения работы Na-каналов широко используется в клинической практике. Так, с помощью местных анестетиков расстраивается механизм управления ворот Na-каналов. Это приводит к прекращению проведения возбуждения в соответствующем участке нерва, устранению болевых ощущений, например, при хирургических вмешательствах. Таким образом, главную роль в возникновении ПД играет Na+, входящий в клетку при повышении проницаемости клеточной мембраны и обеспечивающий всю восходящую часть пика ПД. При замене Na+ в среде на другой ион, например холин, ПД в нервной и мышечной клетках скелетной мускулатуры не возникает. Однако проницаемость мембраны для К+ тоже играет важную роль. Если повышение проницаемости для К+ предотвратить тетраэтиламмонием, мембрана после ее деполяризации реполяризуется гораздо медленнее, только за счет медленных неуправляемых каналов (каналов утечки ионов), через которые К+ будет выходить из клетки. Роль Са2+ в возникновений ПД в нервных и мышечных клетках скелетной мускулатуры незначительна. Однако Са2+ играет важную роль в возникновении ПД в сердечной и гладкой мышцах, в передаче импульсов от одного нейрона к другому, от нервного волокна к мышечному, в обеспечении мышечного сокращения. Снижение содержания Са2+ в крови на 50 %, что иногда встречается в клинической практике, может привести к судорожным сокращениям скелетных мышц. Это объясняется значительным повышением возбудимости нервных и мышечных клеток в результате снижение ПП из-за уменьшения степени нейтрализации отрицательных фиксированных зарядов на поверхности клеточной мембраны и отрицательно заряженных карбоксильных групп интерстиция. Вследствие этого повышается реактивность нейронов, так как ПП приближается к Екр, кроме того, начинается активация Na-каналов. В ответ на поступление самой незначительной импульсации нейроны начинают генерировать ПД в большом количестве, что проявляется в судорожных сокращениях скелетной мускулатуры. При этом нейроны ЦНС и нервные волокна могут разряжаться и спонтанно. Следовые явления в процессе возбуждения клетки. В конце ПД (например, в скелетной мышце) нередко наблюдается замедление реполяризации, что называют отрицательным следовым потенциалом. Затем может быть зарегистрирована гиперполяризация клеточной мембраны, что более характерно для нервных клеток. Это явление называют положительным следовым потенциалом. Вслед за ним может возникнуть частичная деполяризация клеточной мембраны, которую также называют отрицательным следовым потенциалом, как и в случае замедления фазы реполяризации. Во-первых, необходимо отметить, что имеет место терминологическая путаница (два разных по происхождению отрицательных следовых потенциала). Во-вторых, замедление фазы реполяризации вообще не является следовым процессом — это часть фазы реполяризации, которая задерживается вследствие уменьшения проницаемости клеточной мембраны для К+ и замедления выхода его из клетки. В-третьих, термин «потенциал» применяется в других случаях: ПП, ПД, локальный потенци
|
||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 954; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.185.250 (0.014 с.) |