
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изменения концентраций реагирующих веществ.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Для опыта удобно воспользоваться реакцией между хлорным железом FeCl3 и роданистым аммонием NH4CNS (соль роданисто-водородной кислоты HCNS). При сливании растворов указанных солей происходит следующая обратимая реакция, приводящая к состоянию равновесия: FeCl3 + 3NH4CNS ↔ Fe(CNS)3 + 3NH4Cl. Из веществ этой системы Fe(CNS)3 является интенсивно окрашенным в вишневый цвет. Поэтому всякое изменение его концентрации сказывается на интенсивности окраски раствора. Это дает возможность наблюдать, в каком направлении сдвигается равновесие при изменении концентраций реагирующих веществ. Порядок выполнения работы 1.В стаканчик отмерить по 10 мл 0,02 н растворов хлорного железа и роданистого аммония, приготовленных с таким расчетом, чтобы равные объемы их содержали как раз требуемые уравнением реакции количества веществ. Смешать отмеренные растворы. 2. Полученный окрашенный в бледно-красный цвет раствор разлить в четыре чистые пробирки примерно одинакового диаметра. 3. Написать выражение константы равновесия, ответить на вопрос, как должна измениться концентрация Fe(CNS)3 , если увеличить концентрацию FeCl3 или NH4CNS, т.е. увеличить один из сомножителей в знаменателе выражения для константы равновесия. 5. Решить, как повлияет на концентрацию Fe(CNS)3 увеличение концентрации NH4Cl (т.е. концентрации одного из сомножителей числителя в выражении константы равновесия). 6. Прибавить в одну из оставшихся пробирок со смесью растворов FeCl3 и NH4CNS 1 мл 3 М раствора NH4Cl. Сравнить окраску полученного раствора с окраской исходного раствора (в четвертой пробирке). О чем свидетельствует изменение окраски после прибавления NH4Cl? 7. На основании произведенных опытов указать, куда сдвинулось равновесие в первом случае при увеличении концентрации FeCl3 и NH4CNS (п.4) и куда во втором случае – при увеличении концентрации NH4Cl. 8. Результаты опытов записать в следующую табличку:
Глава IV РАСТВОРЫ Определение теплот растворения Учебник §78 При растворении твердого вещества происходит разрушение его кристаллической решетки и распределение частиц растворяемого вещества по всей массе растворителя, что связано с затратой энергии. Поэтому растворение твердых веществ в жидкостях большею частью сопровождается поглощением тепла, вследствие чего только что приготовленный раствор имеет более низкую температуру, чем взятая для растворения жидкость. Теплотой растворения данного вещества называется то количество тепла, которое поглощается при растворении одной грамм-молекулы его. При практическом определении теплоты растворения устанавливают сначала количество тепла, поглощающегося при растворении произвольно выбранной навески. Так как количество поглощенного тепла пропорционально количеству растворенного вещества, то в дальнейшем теплота растворения вычисляется из данных опыта. Определение производится в калориметре. Устанавливается количество воды в калориметре, температура ее до растворения и температура после растворения. Это дает возможность вычислить количество поглощенного или выделенного тепла. При точных измерениях принимается еще в расчет изменение температуры самого колориметра и теплоемкость образующегося раствора. В наших работах этими изменениями можно пренебречь. Расчет производится следующим образом. Обозначим количество воды до растворения в калориметре буквой А, температуру до растворения – буквой t2, навеску вещества буквой a, молекулярный вес растворяемого вещества буквой M, количество поглощенного тепла буквой q и теплоту растворения буквой Q, тогда: q= A (t2-t1) Q= РАБОТА №10 Определение теплоты растворения Азотнокислого аммония Для работы нужны: 1)калориметр; 2)термометр с делениями до 0,1⁰; 3)маленькая фарфоровая чашечка; 4) мензурка на 100 мл; 5) стеклянная палочка с резиновым наконечником; 6) азотнокислый аммоний. Порядок выполнения работы
|
||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 776; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.162.166 (0.011 с.) |

 ·M =
·M = 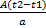 ·M.
·M.


