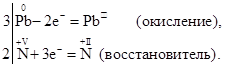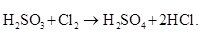Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительно-восстановительные реакцииСодержание книги
Поиск на нашем сайте
Учебник § 70 и 113 Окислительно-восстановительными называются реакции, сопровождающиеся изменением валентности элементов, входящих в состав реагирующих веществ. Изменение валентности происходит вследствие перехода электронов от одних атомов или ионов к другим. Окислением называется потеря электронов окисляющимся веществом. Так как потеря электронов атомом или ионом повышает его валентность, то окисление всегда сопровождается увеличением валентности окисляющегося элемента. Восстановлением называется присоединение электронов к атомам или ионам, сопровождающееся понижением валентности восстанавливающегося элемента. В процессе реакции электроны с окисляющегося элемента переходят на восстанавливающийся. Вещество, атомы или ионы которого отнимают электроны от другого вещества и, следовательно, окисляют его, называется окислителем. Вещество, отдающее электроны, называется восстановителем. Присоединяя к себе электроны, окислитель восстанавливается, а восстановитель, теряя электроны, окисляется. Так как теряемые одним веществом электроны присоединяются к другому веществу, то окисление всегда сопровождается восстановлением, а восстановление – окислением. Пример 1. Реакция вытеснения меди из ее соли железом:
Сущность реакции заключается в переходе от атома железа двух электронов к иону меди, что может быть выражено «электронными уравнениями»:
Железо теряет электроны, окисляется, валентность его увеличивается с 0 до +2. Медь (ион Сu++) присоединяет электроны, восстанавливается, ее валентность понижается с +2 до 0. Пример 2. Восстановление хлорного железа хлористым оловом:
При этой реакции от каждого иона олова два электрона переходят к двум ионам железа. Электронные уравнения
В разбираемой реакции окислителем является FeCl2 (ион Fe+++, а восстановителем – SnCl2 (ион Sn+++). Хлор в окислении-восстановлении участия не принимал, его валентность осталась неизменной (—1). Так как данная окислительно-восстановительная реакция происходит между двумя электролитами в водном растворе, то она может быть записана в ионной форме: 2Fe···+Fn··= 2Fe··+Sn···· Ионы Cl´, как не принимавшие участия в реакции, в ионном уравнении не указываются.
При составлении уравнений окислительно-восстановительной реакции подбор коэффициентов к формулам реагирующих веществ основывается на том, что число электроном, приобретаемых окислителем, равняется числу электронов, отдаваемых восстановителем. Таким образом, произведение из числа реагирующих атомов или молекул окислителя на число приобретаемых им электронов должно равняться аналогичному произведению для восстановителя. При подборе коэффициентов рекомендуется придерживаться следующего порядка: 1. Написать схему реакции, указав в ней вступающие в реакцию вещества и продукты окисления и восстановления. Например: Pb+HNO3 2. Разметить величину и знак валентности всех элементов с целью отыскания окислителя и восстановителя:
В этой реакции свинец – восстановитель, а азотная кислота (входящий в состав ее пятивалентный атом азота 3. Составить «электронные уравнения» с целью отыскания коэффициентов к восстановителю и окислителю и продуктам окисления и восстановления. Электронные уравнения:
Найти наименьшие числа, на которые надо умножить каждое уравнение, чтобы уравнять число теряемых и присоединяемых электронов. В нашем примере первое уравнение надо умножить на 3, а второе на 2. Эти числа (3 и 2) и являются коэффициентами к восстановителю и окислителю и к продуктам окисления и восстановления: 3Pb + 2HNO3 → 3Pb (NO3)2 + 2NO Сравнивая теперь число атомов азота в левой и правой частях уравнения, замечаем, что в правой части уравнения на 6 атомов азота больше, чем в левой. Произошло это вследствие того, что 2 молекулы HNO3 пошли только на окисление свинца (и восстановились до NO). Кроме того, нужно взять еще 6 молекул HNO3 для образования соли Pb (NO3)2. Таким образом, в реакции будут участвовать всего 8 молекул HNO3, из которых 2 молекулы идут на окисление свинца, а 6 – на солеобразование. Исправив коэффициент при HNO3, получим: 3Pb + 8HNO3 → 3Pb (NO3)2 + 2NO. 4. Установить, получаются ли при реакции, кроме указанных в схеме продуктов окисления-восстановления, еще какие-либо вещества и если получаются, то подобрать к ним коэффициенты. В данном случае в результате реакции, очевидно, еще образуется вода, так как в левой части схемы 8 атомов водорода (в составе молекул азотной кислоты), а в правой водорода совсем нет. Отсюда заключаем, что образовалось 4 молекулы воды. Приписав их к правой части схемы и заменив стрелку знаком равенства, получаем окончательное уравнение реакции:
3Pb + 8HNO3 = 3Pb (NO3)2 + 2NO + 4Н2О. 5. Проверить, правильно ли подобраны коэффициенты, подсчитав число атомов кислорода в обеих частях уравнения. В нашем случае: 8·3=24 и 3·2·3+2+4=24 Коэффициенты подобраны верно. Пример 2. Составление уравнения реакции окисления сернистой кислоты хлором. Схема реакции
Из схемы видно, что в результате реакции валентность серы повышается с +4 до +6, а валентность хлора понижается с 0 до —1. Составив электронные уравнения:
находим, что на окисление одной молекулы Н2SO3 идет одна молекула Cl2 и в результате окисления-восстановления получается одна молекула Н2SO4 и две молекулы HCl. Вводя в схему реакции коэффициент 2 при формуле HCl, получаем
Подсчитав число атомов водорода в обеих частях схемы, приходим к заключению, что в реакции должна еще участвовать одна молекула воды. Приписав ее к левой части схемы, заменяем стрелку знаком равенства и получаем уравнение реакции в окончательном виде:
РАБОТА № 23 Получение и свойства галогенов (тяга) 1. В природе галогены встречаются почти исключительно в виде солей галогеноводородных кислот. Из этих солей, а также из соответствующих им кислот обычно и получают галогены путем окисления их ионов различными окислителями. Для работы нужны: 1) стойка с пробирками; 2) пробирка со смесью йодистого калия и MnO2; 3) сухие соли – KMnO4 и KClO4; 4) конц. соляная кислота; 5) растворы брома и йода; 6) сероводородная вода; 7) хлорная вода; 8) растворы солей Hn2SO3, KBr и KJ; 9) бензол. Опыт 1. Получение хлора путем окисления соляной кислоты перманганатом калия KMnO4.
2KMnO4 + 16HCl — 2MnCl2 + 5Cl2 + 2KCl + 8H2O. Для прекращения реакции вылить реакционную смесь в стакан с водой.
Опыт 2. Получение хлора путем окисления соляной кислоты бертолетовой солью KClO3. Положить в пробирку несколько кристалликов KClO3 и прилить туда же немного концентрированной соляной кислоты. Слегка нагреть пробирку. Выделяющийся хлор узнается по желто-зеленому цвету и по запаху. Уравнение реакции:
Составить электронные уравнения для процесса окисления и процесса восстановления. Опыт 3. Получение йода из иодидов путем окисления их двуокисью марганца. 1. В сухую пробирку положить немного смеси, составленной из равных объемов растертых в порошок иодида калия или натрия и двуокиси марганца. 2. Смочить смесь несколькими каплями концентрированной серной кислоты. Слегка нагреть. Выделяющийся йод возгоняется. Пары его оседают в виде блестящих темно-серых кристаллов на стенках пробирки в верхней ее части. Реакция протекает по уравнению
3. Составить электронные уравнения для процесса окисления и процесса восстановления. Опыт 4. Окисление сероводорода бромом. 1. Налить в пробирку немного водного раствора брома и прибавить к нему сероводородной воды (раствор H2S) или пропускать через него некоторое время сероводород из прибора Кипа. Желтовато-бурая окраска жидкости исчезает и она становится мутной от выделяющейся серы.
2. Составить уравнение реакции и электронные уравнения для процесса окисления и процесса восстановления. Опыт 5. Окисление сульфита натрия Na2SO3 йодом. 1. К раствору йода прибавлять понемногу раствор сульфита натрия до обесцвечивания раствора. Происходит окисление сульфита в сульфат Na2SO4. Реакция протекает при участии воды и выражается уравнением.
2. Составить электронные уравнения для процесса окисления и процесса восстановления. Опыт 6. Сравнение окислительных свойств галогенов. 1. Налить в пробирку немного раствора KBr, прибавить к нему немного бензола и несколько капель хлорной воды. Энергично встряхнуть смесь. Хлор окисляет ионы Br до нейтральных атомов. Полученный бром извлекается бензолом и окрашивает его в буро-желтый цвет. 2. Проделать то же самое с раствором KJ. Бензол окрашивается в красно-фиолетовый цвет от выделившегося йода. 3. Налить в пробирку немного раствора KJ, прибавить бензола и несколько капель бромной воды. После энергичного встряхивания смеси бензол окрашивается в фиолетовый цвет, что свидетельствует об окислении ионов J´ бромом. 4. Составить молекулярные и ионные уравнения произведенных реакций и для каждой из них указать окислитель и восстановитель, изображая процессы окисления и восстановления электронными уравнениями.
РАБОТА № 24 Галогеноводороды
Хлористый, бромистый и йодистый водороды – газы, фтористый водород – легко летучая жидкость. Все галогеноводороды хорошо растворяются в воде, образуя кислоты. Галогеноводороды получаются или путем синтеза из элементов или из их соединений. Практически их большей частью получают из солей галогеноводородных кислот, действуя на эти соли нелетучими кислотами. Для работы нужны: 1) стойка с пробирками; 2) пробирка с пробкой и газоотводной трубкой; 3) полоска синей лакмусовой бумаги. Опыт 1. Получение соляной кислоты (тяга). 1. Составить прибор согласно рис. 21. 2. Насыпать в пробирку немного поваренной соли (толщина слоя около 1 см) и прилить через воронку столько 70%-ной серной кислоты, чтобы она полностью покрыла соль. Написать уравнение реакции получения хлористого водорода. 3. Закрыть пробирку пробкой с газоотводной трубкой и подставить под конец последней другую пробирку с небольшим количеством воды так, чтобы конец газоотводной трубки доходил до поверхности воды в пробирке, но не погружался в воду. Выделяющийся хлористый водород ввиду его хорошей растворимости и без того будет энергично поглощаться поверхностью воды. Если же конец трубки опустить в воду, то вследствие быстрого растворения хлористого водорода в пробирке может образоваться пониженное давление, и жидкость из пробирки с водой перетянет в пробирку с солью.
4. Слега нагревать реакционную смесь. Через 3-5 мин. прекратить нагревание. Испытать полученный раствор на лакмус. Опыт 2. Характерные реакции ионов Cl´, Br´ и J´. 1. Подействовать в отдельности на растворы NaCl, NaBr и KJ нитратом серебра. Образуются творожистые осадки: AgCl (белый), AgBr (желтоватый), AgJ (желтый). 2. Проделать то же с раствором, полученным в опыте 1. 3. Выразить реакции ионными уравнениями. После выполнения указанных опытов сделать в лабораторном журнале схематический рисунок применявшегося в опыте 1 прибора и дать краткое описание работы.
РАБОТА № 25
|
||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 190; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.97.254 (0.009 с.) |

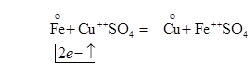 .
.



 Pb(NO3)2+NO.
Pb(NO3)2+NO.
 ) – окислитель.
) – окислитель.