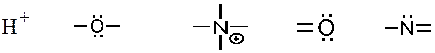Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Экзаменационный тестовый контроль по биоорганической химииСодержание книги
Поиск на нашем сайте
Экзаменационный тестовый контроль по биоорганической химии Для студентов 1 курса лечебного факультета КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ 1. Пиррол является соединением: - 1. ациклическим; - 2. карбоциклическим; + 3. гетероциклическим; + 4. ароматическим; - 5. насыщенным.
2. 2–Изопропил–5–метилциклогексанол по строению углеродного скелета является соединением: + 1. карбоциклическим; - 2. гетероциклическим; - 3. непредельным; - 4. ароматическим; - 5. ациклическим.
3. Пропантриол-1,2,3 является соединением: - 1. монофункциональным; - 2. ароматическим; - 3. непредельным; + 4. полифункциональным; - 5. гетерофункциональным.
4. По функциональным группам анестезин (этиловый эфир n-аминобензойной кислоты) является: - 1. амидом; + 2. сложным эфиром; - 3. кетоном; + 4. амином; - 5. простым эфиром.
5. По функциональным группам норадреналин (2-амино-1-[3', 4'-дигидроксифенил] этанол) является: - 1. нитрилом; + 2. спиртом; + 3. фенолом; - 4. амидом; + 5. амином.
6. По функциональным группам 4 - гидрокси - 3 - этоксибензальдегид является: + 1. фенолом; + 2. простым эфиром; - 3. сложным эфиром; + 4. альдегидом; - 5. спиртом.
7. В состав 2 - гидрокси - 4 - метилбензойной кислоты входит следующее количество функциональных групп: - 1. 1; + 2. 2; - 3. 3; - 4. 4; - 5. 5.
8. По заместительной номенклатуре соединение фенилэтилкетон называется: - 1. метиловый эфир бензойной кислоты; - 2. фенилэтилкетон; + 3. 1 – фенилпропанон-1; - 4. метилбензоат; - 5. бензилэтилкетон.
9. По заместительной номенклатуре соединение называется: + 1. 3 – гидрокси – 3 – карбоксипентандиовая кислота; - 2. 3 – гидрокси – 3 – формилпентандиовая кислота; - 3. лимонная кислота; - 4. 3 – оксопентандиовая – 1,5 – кислота; - 5. 3,5 – диоксопентановая кислота.
10. По заместительной номенклатуре соединение
называется: - 1. 2 - формилбутандикарбоновая кислота; - 2. 2 - оксоэтандиовая кислота; - 3. 2 - оксобутановая кислота; - 4.1,4 - дигидроксибутанон - 2; + 5. 2 - оксобутандиовая - 1,4 кислота.
ЭЛЕКТРОННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ 11. sp2 – Гибридных атомов нет в составе: + 1. глицерина; - 2. пропановой кислоты; + 3. бутана; + 4. этилового спирта; - 5. анилина.
12. Пиррольные гетероатомы входят в состав следующих соединений: + 1. анилин; - 2. этанол; + 3. фенол; - 4. бензальдегид; - 5. 3-метилбутанамин-1.
13. π-π – сопряжение есть в структуре: + 1. бензола; + 2. пентадиена – 1,3 - 3. пентадиена – 1,4 - 4. пропаналя; - 5. пропановой кислоты.
14. p-π – сопряжение есть в структуре: + 1. уксусной кислоты; + 2. 2-гидроксипропановой кислоты; - 3. этиленгликоля; - 4. пиридина; - 5. пропен-2-аля.
15. Ароматическими являются следующие соединения: - 1. циклогексан; - 2. циклооктатетраен; + 3. нафталин; + 4. пиррол; + 5. бензол
16. Ароматическими не являются следующие соединения: - 1. пиридин; + 2. циклогексен-1; - 3. антрацен; + 4. циклопентадиен-1,3 - 5. фуран.
17. У функциональной группы есть отрицательный мезомерный эффект в соединениях: - 1. этанол; - 2. глицерин; - 3. ацетон; + 4. бутен-2-аль-1; - 5. 4-метиланилин.
18. У функциональной группы есть только отрицательный индуктивный эффект в соединениях: - 1. фенол; + 2. этиленгликоль; + 3. уксусная кислота; - 4. этандиовая кислота; - 5. метилфенилкетон.
19. Все функциональные группы являются электроноакцепторными в соединениях: + 1. 2-аминоэтанол-1; - 2. 2-гидроксибензойная кислота; - 3. 4-аминобензолсульфоновая кислота. - 4. 4-гидрокси-3-метоксибензальдегид; + 5. 2,3-дигидроксипропаналь.
20. В соединении:
Электронодонорами являются следующие функциональные группы: - 1. аминогруппа; - 2. гидроксильная спиртовая группа; + 3. гидроксильные фенольные группы; - 4. бензольное кольцо и аминогруппа; - 5. все гидроксильные группы.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. 21. Проекционные формулы Ньюмена записывают, чтобы показать различия: - 1. в химическом строении соединений; + 2. в конформациях молекулы; - 3. структурных изомеров; - 4. в конфигурационном строении энантиомеров; - 5. в строении Е и Z π – диастереомеров.
22. Энергия пропанола–1 в анти-конформации меньше, чем в скошенной, т.к. в анти–конформации: - 1. меньше угловое напряжение; - 2. изменилась конфигурация; + 3. уменьшилось Ван-дер-Ваальсово отталкивание; - 4. стало меньше торсионное напряжение; - 5. изменилось химическое строение.
23. Энергия 2–хлорбутана в заслоненной конформации больше, чем в скошенной, т.к. в заслоненной конформации: - 1. у молекулы другая конфигурация; - 2. больше торсионное напряжение; - 3. у молекулы другое электронное строение; - 4. больше угловое напряжение; + 5. увеличивается Ван-дер-Ваальсово отталкивание.
24. Конформации 1–хлор–пропана с торсионным углом 60˚ и 300˚ являются вырожденными, т.к. в этих конформациях у молекулы: - 1. одинаковая конфигурация; - 2. одинаковое химическое строение; - 3. разное конформационное строение; + 4. одинаковые торсионное, Ван-дер-Ваальсовое и угловое напряжения; + 5. одинаковая энергия.
25. Молекула 1,2 – диметилциклогексана имеет максимальный запас энергии, если: - 1. оба метильных заместителя на экваториальных связях; + 2. оба метильных заместителя на аксиальных связях; - 3. один из двух заместителей на аксиальной связи; - 4. один из двух заместителей на экваториальной связи; - 5. один заместитель на аксиальной, второй на экваториальной связи.
26. Хиральными молекулами являются: - 1. глицин (2-аминоэтановая кислота); + 2. серин (2-амино-3-гидроксипропановая кислота); + 3. D-рибоза; - 4. бутанол-1; + 5. бутанол – 2.
27. Хиральными молекулами являются: + 1. D – глюкоза; + 2. аланин (2-аминопропановая кислота); - 3. 2 – аминоэтанол; + 4. ментол (ментанол – 3); - 5. фурфурол (фуран-2-карбальдегид).
28. Рацемат может иметь удельный угол вращения плоскости поляризованного света при 25˚С: - 1. +5,2˚; + 2. 0,0˚; - 3. –8,3˚; - 4. –5,2˚; - 5. +6,0˚.
29. 2-аминопропановая кислота имеет следующее количество стереоизомеров: - 1. 1; + 2. 2; - 3. 3; - 4. 4; - 5. 5
30. 2, 3, 4-тригидроксибутановой кислоте соответствует следующее количество стереоизомеров: - 1. 1; - 2. 2; - 3. 3; + 4. 4; - 5. стереоизомерия невозможна.
СОЕДИНЕНИЙ.
31. Кислотными реакционными центрами являются: -1. +2. +3. -4. +5.
32. Кислотный реакционный центр имеют функциональные группы: - 1. сложных эфиров; - 2. кетонов; + 3. сульфоновых кислот; + 4. аминов; - 5. простых эфиров.
33. Основными реакционными центрами являются:
-1. +2. -3. +4. +5.
34. Основный реакционный центр на атоме кислорода имеют функциональные группы: + 1. кетонов; + 2. амидов; - 3. нитрилов; - 4. галогенопроизводных углеводородов; + 5. ангидридов.
35. Электрофильными частицами являются: -1. -2. +3. +4. -5
36. Нуклеофилами являются:
-1. +2. +3. +4. -5.
37. Наиболее сильным основным центром молекулы никотина является: - 1. π–электронная система шестичленного цикла; + 2. sр3–гибридный атом азота; - 3. sр2–гибридный атом азота; - 4. атом азота с пиридиновым строением; + 5. атом азота в пирролидиновом цикле.
38. Наиболее сильным кислотным центром молекулы оксипролина (4-гидроксипирролидин-2-карбоновая кислота) является: + 1. гидроксильная группа с пиррольным строением кислорода; - 2. гидроксильная группа с sр3–гибридным кислородом; - 3. N–Н кислотный центр; - 4. ОН– группа, связанная с гетероциклом непосредственно; + 5. ОН– группа, в составе функциональной группы карбоновых кислот.
39. Наиболее сильно выражены кислотные свойства у соединения: - 1. уксусная кислота; - 2. пропановая кислота; - 3. 2-метилпропановая кислота; + 4. 2,2,2-трихлорэтановая кислота; - 5. 2-аминопропановая кислота.
40. Самой слабой кислотой является: + 1. этанамин; - 2. этанол; - 3. фенол; - 4. этановая кислота; - 5. этантиол.
41. Самым сильным основанием является: - 1. 2-аминоэтанол; - 2. этанамин; - 3. метиламин; + 4. диметиламин; - 5. пиридин.
И ИХ ТИОАНАЛОГИ. ПРОСТЫЕ ЭФИРЫ, СУЛЬФИДЫ. 65. Этиловый спирт (этанол) является: - 1. вторичным; + 2. одноатомным; - 3. многоатомным; + 4. предельным; - 5. непредельным.
66. Трет.-бутиловый спирт (2-метилпропанол-2) является: + 1. одноатомным; - 2. многоатомным; - 3. первичным; + 4. третичным; + 5. насыщенным.
67. Аллиловый спирт (пропен-2-ол-1) является: + 1. первичным; - 2. вторичным; + 3. одноатомным; - 4. многоатомным; + 5. ненасыщенным.
68. Глицерин является: - 1. одноатомным спиртом; - 2. двухатомным фенолом; + 3. многоатомным спиртом; + 4. вицинальным спиртом; - 5. геминальным спиртом.
69. Гидрохинону соответствует систематическое название: - 1. фенилметанол; - 2. циклогексанол; - 3. 2-изопропил-5-метилциклогексанол-1; - 4. 1,2-дигидроксибензол; + 5. 1,4-дигидроксибензол.
70. Диэтиловому эфиру соответствует систематическое название: - 1. этантиол; - 2. 2,3-димеркаптопропанол-1; + 3. этоксиэтан; - 4. 1,2,3-тригидроксибензол; - 5. этоксибензол.
71. Метилтиоэтану соответствует информация: + 1. является функциональным производным тиолов; + 2. относится к сульфидам; - 3. легко растворим в воде; + 4. легко окисляется по гетероатому; - 5. проявляет кислотные свойства.
72. Вторичными спиртами являются: + 1. пентанол-3; + 2. изопропиловый спирт; - 3. 2-метилбутанол-2; - 4. бензиловый спирт; + 5. циклогексанол.
73. Третичными спиртами являются: - 1. 1,2,3-тригидроксибензол; + 2. 3-метилпентанол-3; + 3. 2-метилпропанол-2; - 4. неогексиловый спирт; - 5. бензиловый спирт.
74. Первичными спиртами являются: - 1. метиловый спирт; + 2. бензиловый спирт; + 3. изобутиловый спирт; - 4. изопропиловый спирт; - 5. циклогексиловый спирт.
75. Атомы кислорода являются sp3-гибридными в составе: - 1. резорцина; + 2. 2,3-димеркаптопропанола-1; + 3. пропен-2-ола-1; - 4. винилового спирта; + 5. этиленгликоля.
76. Атом кислорода является sp2-гибридными в составе: + 1. β-нафтола; + 2. тимола; + 3. анизола; - 4. пропаргилового спирта; - 5. диэтилового эфира.
77. Только пиррольные атомы кислорода входят в состав: + 1. орто-крезола; - 2. пикриновой кислоты; - 3. ментала; - 4. этоксиэтана; + 5. фенетола.
78. В молекуле пропанола-1 присутствуют реакционные центры: + 1. ОН-кислотный; + 2. основный; + 3. СН-кислотный; + 4. электрофильный; + 5. нуклеофильный.
79. В молекуле β-нафтола присутствуют реакционные центры: + 1. ОН-кислотный; - 2. SH-кислотный; - 3. электрофильный; + 4. нуклеофильный; - 5. СН-кислотный.
80. В молекуле этантиола присутствуют реакционные центры: - 1. ОН-кислотный; + 2. SH-кислотный; - 3. электрофильный; + 4. нуклеофильный; - 5. СН-кислотный.
81. Нуклеофильные свойства гетероатомов возрастают в ряду соединений: + 1. 2-метилфенол → 2-метилпропанол-1 → метилтиометан; - 2. этоксипропан → 2-изопропил-5-метилфенол → тиофенол; - 3. метилтиобензол → метилэтилсульфид → 1,4-дигидроксибензол; - 4. диоксан-1,4 → циклогексанол → этоксибензол; + 5. пропанол-2 → пропантиол-1 → этилтиоэтан.
82. По нуклеофильному центру спиртов протекают реакции: - 1. с галогеноводородами; - 2. с основаниями; + 3. с функциональными производными карбоновых кислот; + 4. алкилирования в присутствии концентрированной H2SO4, to ~ 140оС; + 5. ацетализации в присутствии каталитических количеств кислоты.
83. Основные свойства наиболее сильно выражены у следующего из перечисленных соединений: - 1. ментол (2-изопропил-5-метилциклогесанол); - 2. тимол (2-изопропил-5-метилфенол); + 3. этилпропиловый эфир (этоксипропан); - 4. метилизобутилсульфид (1-метилтио-2-метилпропан); - 5. 2-метил-пентанол-2.
84. ОН-кислотные свойства возрастают слева направо в ряду: - 1. фенол → бензиловый спирт → этанол; - 2. глицерин → изопропиловый спирт → резорцин; - 3. пирогаллол → этиленгликоль → трет.-бутиловый спирт; + 4. метанол → глицерин → гидрохинон; - 5. этантиол → пропанол → резорцин.
85. По основному центру диэтилового эфира идут реакции: + 1. с кислотами; - 2. с основаниями; - 3. с электрофильными субстратами; - 4. восстановления; - 5. окисления.
86. Растворяют гидроксид меди (II) с образованием комплекса синего цвета спирты: - 1. этанол; - 2. бензиловый спирт; + 3. этиленгликоль; + 4. пропантриол-1,2,3; + 5. пропандиол-1,2.
87. Растворение осадка гидроксида меди (II) с образованием синего раствора комплексной соли является качественной реакцией на: - 1. непредельные углеводороды; - 2. галогенопроизводные углеводородов; - 3. одноатомные спирты; + 4. многоатомные вицинальные спирты; - 5. фенолы.
88. Фенолы растворяются в: - 1. воде; - 2. насыщенном растворе NaCl; - 3. кислотах; - 4. насыщенном растворе NaHCO3; + 5. щелочах.
89. По электрофильному центру спиртов протекают реакции: - 1. AN; + 2. SN1; - 3. AN-E; + 4. SN2; - 5. AE.
90. В реакциях нуклеофильного замещения (SN) молекула спирта может выступать в качестве: + 1. нуклеофильного реагента; - 2. электрофильного реагента; - 3. радикального реагента; + 4. субстрата с электрофильным центром; - 5. субстрата с нуклеофильным центром.
91. Реакция замещения бимолекулярного (SN2) наиболее характерна для спирта: - 1. гексанола-3; - 2. 2-метилциклогексанола-1; + 3. метанола; - 4. 2-метилпропанола-2; - 5. бензилового спирта.
92. Реакция замещения мономолекулярного (SN1) протекает с максимальной скоростью у спиртов: - 1. неогексилового; - 2. пропилового; - 3. трет.-бутилового; + 4. бензилового; - 5. изопропилового.
93. Стереоспецифичными являются реакции, протекающие при хиральных электрофильных центрах спиртов-субстратов по механизму: - 1. SN1; + 2. SN2; - 3. AN; - 4. AN-E; - 5. AE.
94. Кислотный катализ в реакциях SN, протекающих по электрофильному центру спиртов, приводит к: - 1. увеличению растворимости спиртов; + 2. образованию катионов алкилоксония; + 3. стабилизации нуклеофуга (уходящей группы); + 4. увеличению силы электрофильного центра; - 5. образованию карбоаниона.
95. Реакции элиминирования протекают с максимальной скоростью среди перечисленных у: - 1. неоамилового спирта; - 2. бутанола-1; - 3. бутанола-2; + 4. трет.-бутилового спирта; - 5. изопропилового спирта.
96. По правилу Зайцева протекает элиминирование (Е) у спиртов: - 1. пропанола-2; - 2. 2-метилпропанола-2; - 3. бутанола-1; + 4. бутанола-2; + 5. 2-метилбутанола-2.
97. С наиболее высокой скоростью протекает реакция SE в соединении: - 1. бензол; - 2. нафталин; + 3. фенол; - 4. хлорбензол; - 5. толуол.
98. Реакция О-ацетилирования фенола приводит к образованию: - 1. 2`-гидроксиацетофенона; - 2. 4`-гидроксиацетофенона; + 3. фенилацетата; - 4. 2`, 4`-дигидроксиацетофенона; - 5. пара-толилацетата.
АЛКАЛОИДЫ. 170. Пятичленные гетероциклические соединения названы в примерах: - 1. азин; + 2. диазол-1,3; - 3. диазепин-1,2; - 4. оксазин; + 5. тиазол-1,3.
171. Шестичленные гетероциклические соединения названы в примерах: + 1. азин; + 2. оксазин-1,2; - 3. оксазол-1,3; - 4. оксиран; - 5. 3Н-азепин.
172. Только азотсодержащие гетероциклические соединения названы в примерах: - 1. оксол; - 2. тиофен; + 3. азин; + 4. диазепин-1,3; + 5. диазол-1,2.
173. В составе гетероцикла есть и сера, и азот: - 1. диазол-1,3; + 2. тиазол-1,3; - 3. диазин-1,3; + 4. фенотиазин; - 5. феноксазин.
174. Пирролу соответствует систематическое название: - 1. диазол-1,3; - 2. азин; - 3. диазин-1,3; + 4. азол; - 5. тиазол.
175. Пиримидину соответствует систематическое название: - 1. диазол-1,3; + 2. диазин-1,3; - 3. диазепин-1,4; - 4. азин; - 5. азол. 176. Имидазолу соответствует систематическое название: + 1. диазол-1,3; - 2. азин; - 3. диазин-1,3; - 4. азол; - 5. тиазол.
177. К алкалоидам группы пиридина следует отнести: - 1. хинин; + 2. никотин; - 3. морфин; - 4. кокаин; - 5. анабазин.
178. К алкалоидам группы хинолина следует отнести: + 1. хинин; - 2. кофеин; - 3. папаверин; - 4. кодеин; - 5. атропин.
179. К алкалоидам группы тропана следует отнести: + 1. кокаин; - 2. теофиллин; + 3. атропин; - 4. анабазин; - 5. кодеин.
180. N-H кислотный реакционный центр имеют молекулы: - 1. фурана; + 2. пиррола; + 3. имидазола; - 4. пиримидина; - 5. хинолина.
181. Кислотные свойства гетероциклических соединений проявляются в их реакциях с: - 1. галогенпроизводными углеводородов; + 2. основаниями; - 3. кислотами; - 4. ацилгалогенидами. - 5. спиртами.
182. Кислотные свойства имидазола (1,3-диазол) выражены больше, чем у: - 1. барбитуровая кислота; - 2. 2,4-дигидроксипиримидин; - 3. серная кислота; + 4. пиррол; - 5. мочевая кислота.
183. В реакциях образования солей с основаниями мочевая кислота (2,6,8-тригидроксипурин) ведет себя как: - 1. одноосновная кислота; + 2. двухосновная кислота; - 3. трехосновная кислота; - 4. невозможно образование солей с основаниями; - 5. субстрат в реакции SN.
184. В реакциях с основаниями при обычных условиях мочевая кислота (2,6,8-тригидроксипурин) образует соли: - 1. соли аммония; - 2. барбитураты; - 3. соли азотистых оснований; + 4. кислые и средние ураты; - 5. соли пирилия.
185. Основные свойства гетероциклических соединений проявляются в их реакциях: - 1. с основаниями; + 2. с кислотами; - 3. с гидрокарбонатами; - 4. с галогенопроизводными углеводородов; - 5. ацилгалогенидами.
186. Не образуют устойчивых солей с кислотами: - 1. хинолин; + 2. фуран; + 3. пиррол; - 4. имидазол; - 5. пиридин.
187. Являются основаниями и образуют соли в реакциях с кислотами: - 1. нафталин; - 2. фуран; + 3. хинолин; + 4. хинин; + 5. алкалоиды.
188. Основные свойства максимально выражены в ряду предложенных соединений у: - 1. пиррол; + 2. имидазол (диазол-1,3); - 3. пиридин; - 4. пиримидин (диазин-1,3); - 5. оксазол-1,3.
189. Ацидофобными называют ароматические гетероциклические соединения, которые при действии на них: - 1. сильных кислот образуют устойчивые соли; - 2. не взаимодействуют ни кислотами, ни с основаниями; - 3. сильных оснований образуют соли; + 4. сильных кислот «осмоляются», т.к. происходит нарушение их ароматического строения; - 5. ацилгалогенидов подвергаются реакциям SE.
190. Ацидофобными гетероциклическими соединениями являются: - 1. тиофен; + 2. пиррол; + 3. фуран; - 4. тетрагидрофуран; - 5. имидазол (диазол-1,3).
191. Таутомерия возможна для гетероциклических соединений, в молекулах которых присутствуют одновременно реакционные центры: - 1. два кислотных; + 2. кислотный и основный; - 3. два основных; - 4. основный и электрофильный; - 5. электрофильный и нуклеофильный.
192. Таутомерные превращения возможны для следующих гетероциклических соединений: - 1. фуран; - 2. пиридин; - 3. пиррол; + 4. имидазол (диазол-1,3); + 5. барбитуровая кислота.
193. Лактим-лактамная таутомерия характерна для гетероциклических соединений: - 1. изохинолин; + 2. цитозин; + 3. тимин; + 4. мочевая кислота (2,6,8-тригидроксипурин); - 5. имидазол (диазол-1,3).
194. Ароматическое строение молекулы пиррола обеспечено тем, что: + 1. σ-скелет имеет плоское циклическое строение; + 2. сопряженная π-система замкнута; + 3. неподеленная электронная пара атома азота участвует в образовании сопряженной системы; + 4. число π-электронов равно 6 = 4n + 2; - 5. число π-электронов равно 4 = 4n + 2.
195. Для ароматического строения молекулы пиридина характерно то, что: + 1. σ-скелет имеет плоское циклическое строение; - 2. неподеленная электронная пара атома азота участвует в образовании циклической сопряженной π-электронной системы; + 3. число π-электронов равно 6 = 4n + 2; + 4. неподеленная электронная пара атома азота не участвует в сопряжении и расположена на гибридной орбитали в плоскости цикла; - 5. число π-электронов равно 8 = 4n + 2.
196. π-Избыточную электронную систему имеют гетероциклические соединения: - 1. насыщенные пятичленные с одним гетероатомом в цикле; + 2. ароматические пятичленные с одним гетероатомом в цикле; - 3. насыщенные шестичленные с одним гетероатомом в цикле; - 4. ароматические шестичленные с одним гетероатомом в цикле; - 5. ароматические шестичленные с двумя гетероатомами в цикле.
197. π-Избыточную электронную систему имеют гетероциклические соединения: + 1. пиррол; - 2. пиридин; + 3. тиофен; + 4. фуран; - 5. пиримидин.
198. π-Недостаточность электронной системы выражена максимально у: - 1. пиридина; - 2. пиррола; - 3. тиофена; + 4. пиримидина (диазин-1,3); - 5. имидазола (диазол-1,3).
199. Реакции электрофильного замещения (SE) протекают с максимальной скоростью и в наиболее мягких условиях у соединений: - 1. бензол и его гомологи; + 2. π-избыточные ароматические гетероциклы; - 3. алканы и циклоалканы; - 4. π-недостаточные ароматические гетероциклы; - 5. алкены и циклоалкены.
200. Реакции электрофильного замещения (SE) протекают с минимальной скоростью у: - 1. толуола (метилбензол); + 2. пиримидина (диазин-1,3); - 3. пиридина; - 4. фурана; - 5. пиразола (диазол-1,2).
201. Скорость реакций электрофильного замещения (SE) уменьшается в ряду соединений слева направо: - 1. пиридин, пиррол, бензол; - 2. бензол, пиррол, пиридин; - 3. бензол, пиридин, пиррол; - 4. пиридин, бензол, пиррол; + 5. пиррол, бензол, пиридин.
202. Реакции сульфирования пиррола соответствует информация: - 1. протекает в жестких условиях, при нагревании в присутствии Н2SO4 конц. или олеума; + 2. в смеси продуктов преобладает пирролсульфокислота-2; + 3. протекает в мягких условиях при комнатной температуре, в присутствии пиридинсульфотриоксида; + 4. протекает по механизму SE; - 5. характерен SN механизм.
203. Реакция алкилирования пиррола протекает с образованием продуктов: - 1. N-алкилпиррола; + 2. 2-алкилпиррола; + 3. 2,5-диалкилпиррола; - 4. N,N-диалкилпиррола; - 5. реакция невозможна.
204. Реакции ацилирования имидазола соотвествует информация: + 1. протекает по механизму SN; - 2. протекает по механизму SE; + 3. образуется продукт реакции N-ацилимидазол; - 4. образуется продукт реакции N,N-диацилимидазол; - 5. реакция невозможна.
205. По механизму SE протекают реакции пиридина со следующими реагентами: - 1. CH3I; + 2. KNO3, H2SO4 (конц.), to; + 3. H2SO4 (SO3), to; - 4. (CH3CO)2O; + 5. Br2 (кат.).
206. По механизму SN протекают реакции пиридина со следующими реагентами: + 1. KOH, to, сплавл.; + 2. KNH2 (NH3 жидк.); - 3. H2SO4, to; - 4. KNO3, H2SO4, to; - 5. HCl.
207. Никотиновая кислота (пиридин-3-карбоновая кислота) может быть получена при: - 1. восстановлении пиридина; - 2. окислении 4-метилпиридина; - 3. ацилировании пиридина; + 4. окислении 3-метилпиридина; + 5. окислении 3-этилпиридина.
208. Возможность протекания реакций нуклеофильного замещения (SN) максимальна в ряду ароматических соединений, для которых характерно: - 1. электронное строение бензола; + 2. π-недостаточное электронное строение; - 3. электронное строение фурана; - 4. π-избыточное электронной строение; - 5. электронное строение пиразола (диазол-1,2).
209. Возможность протекания реакций нуклеофильного замещения (SN) уменьшается в ряду соединений слева направо: - 1. пиридин, пиримидин, пиридазин; - 2. пиррол, оксазол, бензол; - 3. пиридин, бензол, пиримидин; - 4. бензол, пиридин, пиридазин; +5. пиридазин, пиридин, бензол.
210. Общие алкалоидные реакции характерны для: - 1. пиррола; - 2. барбитуровой кислоты; + 3. атропина; + 4. папаверина; + 5. никотина. УГЛЕВОДЫ. МОНОСАХАРИДЫ. 211. Углеводы классифицируют на: + 1. моносахариды; + 2. олигосахариды; + 3. полисахариды; - 4. полинуклеотиды; - 5. олигопептиды.
212. D-глюкоза может быть классифицирована как: + 1. моносахарид; - 2. олигосахарид; - 3. альдопентоза; + 4. альдогексоза; - 5. кетогексоза.
213. D-рибоза может быть классифицирована как: - 1. олигосахарид; + 2. моносахарид; + 3. альдпентоза; - 4. альдогексоза; - 5. кетопентоза.
214. D-фруктоза может быть классифицирована как: + 1. моносахарид; - 2. полисахарид; - 3. альдогексоза; - 4. альдопентоза; + 5. кетогексоза.
215. D-глюкоза имеет R-конфигурацию у атомов углерода с порядковым номером в составе молекулы: - 1. первый; + 2. второй; - 3. третий; + 4. четвертый; + 5. пятый.
216. D-галактоза имеет R-конфигурацию у атомов углерода с порядковым номером в составе молекулы: - 1. первый; + 2. второй; - 3. третий; - 4. четвертый; + 5. пятый.
217. D-фруктоза имеет R-конфигурацию у атомов углерода с порядковым номером в составе молекулы: - 1. первый; - 2. второй; - 3. третий; + 4. четвертый; + 5. пятый.
218. Структуре D-глюкозы соответствует количество конфигурационных стереоизомеров: - 1. четыре; - 2. восемь; + 3. шестнадцать; - 4. тридцать два; - 5. шестьдесят четыре.
219. D-глюкозы и L-глюкоза относятся друг к другу как: + 1. энантиомеры; - 2. диастереомеры; - 3. эпимеры; - 4. аномеры; - 5. структурные изомеры.
220. D-глюкоза и D-галактоза относятся друг к другу как: - 1. энантиомеры; + 2. диастереомеры; + 3. эпимеры; - 4. аномеры; - 5. структурные изомеры.
221. D-глюкоза и D-фруктоза относятся друг к другу как: - 1. энантиомеры; - 2. диастереомеры; - 3. эпимеры; - 4. аномеры; + 5. структурные изомеры.
222. Таутомерное равновесие в растворе D-глюкозы образуют ее таутомерные формы: - 1. открытая и две пиранозные; - 2. открытая и две фуранозные; - 3. две пиранозные и две фуранозные; + 4. открытая, две пиранозные и две фуранозные; - 5. одна пиранозная, открытая и одна фуранозная.
223. Открытая форма D-глюкозы по химической природе является: - 1. только альдегидом; - 2. только многоатомные спиртом; + 3. альдегидом и многоатомным спиртом; - 4. полуацеталем и многоатомным спиртом; - 5. карбоновой кислотой.
224. Пиранозная и/или фуранозная формы D-глюкозы по химической природе являются: - 1. только альдегидом; - 2. только кетоном; - 3. только многоатомным спиртом; + 4. многоатомным спиртом и циклическим полуацеталем; - 5. сложным эфиром.
225. Аномерами среди перечисленных таутомерных форм моносахаридов являются: + 1. a-D-фруктофураноза; - 2. a-D-фруктопираноза; + 3. β-D-фруктофураноза; - 4. a-D-галактопираноза; - 5. β-D-галактофураноза.
226. Конфигурация аномерного атома углерода у a-аномера одинакова с конфигурацией: - 1. второго атома углерода в молекуле моносахарида; + 2. последнего хирального центра, определяющего принадлежность моносахарида к D- или L-ряду. - 3. предпоследнего хирального центра в молекуле моносахарида; - 4. любого хирального центра; - 5. аномерного атома в молекуле β-аномера. 227. Только гликозид образуется в результате реакции моносахарида с: - 1. С2Н5-Cl/NaOH; + 2. С2Н5-OH/HCl (сухой); - 3. С2Н5СOCl; + 4. C2H5NH2/HCl (сухой); + 5. С2Н5SH/HCl (сухой).
228. Продукт реакции моносахарида со спиртом в безводной кислой среде следует классифицировать как: - 1. простой эфир; - 2. сложный эфир; + 3. О-гликозид; - 4. полуацеталь и многоатомный спирт; + 5. ацеталь и многоатомный спирт.
229. Строению гликозида соответствует следующая информация: - 1. способны к цикло-оксо таутомерии; + 2. имеют только циклическое строение; + 3. легко гидролизуются в водных растворах кислот; - 4. легко гидролизуются в слабощелочной среде; + 5. проявляют устойчивость к гидролизу в слабощелочной среде.
230. Продукт реакции D-глюкозы с уксусным ангидридом следует классифицировать как: - 1. простой эфир; + 2. сложный эфир; - 3. ацеталь; - 4. полуацеталь и простой эфир; - 5. гликозид.
231. Продукт реакции D-галактозы с этилхлоридом следует отнести к классу: - 1. только простого эфира; - 2. сложного эфира; + 3. О-гликозида и простого эфира; + 4. ацеталя и простого эфира; - 5. только гликозида.
232. Хелатный комплекс синего цвета образуется в реакции D-глюкозы с реактивом: - 1. C2H5Cl/NaOH; to; - 2. C2H5OH/HÅ, to; + 3. Cu(OH)2/NaOH (комн.температура); - 4. Cu(OH)2/NaOH, to; - 5. Ag(NH3)OH, to.
233. При восстановлении D-ксилозы образуется: - 1. сорбит; + 2. ксилит; - 3. ксиларовая кислота; - 4. ксилоновая кислота; - 5. сложный эфир.
234. Под действием мягких окислителей в нейтральной среде (бромная вода) моносахариды образуют: + 1. гликоновые кислоты; - 2. гликаровые кислоты; - 3. гликуроновые кислоты; - 4. многоатомные (сахарные) спирты; - 5. гликозиды.
235. При действии сильных окислителей в кислой среде (разбавленная азотная кислота) моносахариды образуют: - 1. гликоновые кислоты; + 2. гликаровые кислоты; - 3. гликуроновые кислоты; - 4. многоатомные (сахарные) спирты; - 5. гликозиды.
236. D-галактоза окисляется в D-галактоновую кислоту в условиях: - 1. [Ag(NH3)2]OH, to; - 2. Cu(OH)2/NaOH, to; + 3. Br2/H2O; - 4. HNO3 разб.; - 5. H2/Pd.
237. D-манноза окисляется в D-маннаровую кислоту в условиях: - 1. Ag(NH3)OH, to; - 2. Cu(OH)2/NaOH, to; - 3. Br2/H2O; + 4. HNO3 разб.; - 5. H2/Pd.
238. D-маннуроновая кислота образуется в результате окисления в молекуле D-маннозы: - 1. альдегидной группы; - 2. альдегидной и первичноспиртовой групп; - 3. всех спиртовых групп; + 4. концевой первичноспиртовой группы с предварительной защитой альдегидной группы; - 5. гидроксильной группы у второго атома углерода.
239. D-глюкоза дает реакцию “серебряного зеркала» в условиях: - 1. Br2/H2O; - 2. HNO3 (разб.); - 3. Cu(OH)2/NaOH, to; + 4. Ag(NH3)2OH, to; + 5. реактив Толленса, to.
240. D-галактоза окисляется и дает красный осадок оксида меди (I) в условиях: - 1. Br2/H2O; + 2. реактив Фелинга, to; + 3. реактив Бенедикта, to; - 4. реактив Толленса, to; - 5. Ag(NH3)2OH, to.
241. Аминосахарами являются: + 1. D-глюкозамин; - 2. D-глюкоза; + 3. D-маннозымин; - 4. 6-дезокси-L-галактоза; - 5. этиламин.
242. Дезоксисахарами являются: - 1. D-глюкозамин; - 2. D-рибоза; + 3. 2-дезокси-D-рибоза; + 4. 6-дезокси-L-галактоза; - 5. D-галактуроновая кислота.
ПРИРОДНЫЕ a-АМИНОКИСЛОТЫ. 273. Строение (2 S)-2-амино-3-метилбутановой кислоты имеет природная a-аминокислота: - 1. лейцин; - 2. изолейцин; + 3. валин; - 4. тирозин; - 5. лизин.
274. Строение (2 S)-2-амино-3-гидроксибутановой кислоты имеет природная a-аминокислота: + 1. треонин; - 2. валин; - 3. фенилаланин; - 4. триптофан; - 5. серин.
275. Строение (2 S)-2-амино-4-метилпентановой кислоты имеет природная a-аминокислота: - 1. изолейцин; - 2. глутамин; - 3. цистеин; + 4. лейцин; - 5. метионин.
276. Строение (2 S)-2-амино-3-(1Н-индолил-3) пропановой кислоты имеет природная a-аминокислота: - 1. гистидин; - 2. пролин; + 3. триптофан; - 4. аспарагиновая кислота; - 5. фенилаланин.
277. К числу незаменимых природных a-аминокислот относятся: - 1. асн (Asn); + 2. мет (Met); + 3. фен (Phe); + 4. лиз (Lys); - 5. ала (Ala).
279. Практически все природные a-аминокислоты; + 1. имеют
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 903; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.208.236 (0.014 с.) |