Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Типи зв’язків у білкових молекулахСодержание книги
Поиск на нашем сайте
1.Пептидні зв’язки – (- СО – NH -) виникають внаслідок взаємодії карбоксильних та 2.Дисульфідні зв’язки (- S – S -) – утворюються між залишками молекул цистеїну, що входять до одного або різних пептидних ланцюгів. 2.Нековалентні зв’язки та слабкі взаємодії – фізико – хімічні зв’язки, що беруть участь у взаємодії як певних частин одного пептидного ланцюга, так і різних, близько розташованих ланцюгів, утворюючи вищі рівні конформації білкових молекул. 1.Водневі зв’язки – виникають між двома електронегативними атомами за рахунок атома Гідрогену, ковалентно зв’язаного з одним із електронегативних атомів. Вони найчастіше утворюються між Гідрогеном, що входить до складу груп = NH, - OH, - SH та сусіднім атомом Оксигену, наприклад: = N – H … O = C =
3. Дипольні зв’язки – електростатичні взаємодії постійних чи індукованих диполів, які можуть виникати між радикалами полярних амінокислот (серину, цистеїну, тирозину тощо), що входять до складу білкових молекул. 4.Гідрофобні взаємодії – слабкі взаємодії. Що виникають між бічними радикалами таких амінокислот, як валін, лейцин, ізолейцин тощо за рахунок їх „виштовхування” з полярної (звичайно, водної) фази. Первинна структура білків Під первинною структурою білків розуміють послідовність сполучення залишків амінокислот у поліпептидному ланцюгу. У поняття первинної структури білка або пептиду входять його якісний та кількісний склад та порядок чергування окремих амінокислотних залишків. Порядок хімічного сполучення амінокислотних ланок – найбільш істотна причина різноманітності білків. Наприклад, для білка, в кому міститься лише 10 залишків різних амінокислот, можливе існування 3 628 800 ізомерів, які відрізняються порядком сполучення амінокислотних ланок.
Мал. 25. Параметри структурних елементів поліпептидного ланцюга (розміри подано в ангстремах; 1 Вторинна структура білків – це ряд конформацій, утворення яких зумовлено, головним чином, водневими зв’язками між окремими ділянками пептидного ланцюга або різними поліпептидними ланцюгами. Розрізняють два основних типи впорядкованої вторинної структури білкових молекул: Мал. 26. Модель вторинної структури поліпептидного ланцюга у вигляді
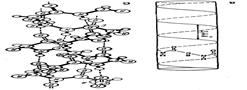
Третинна структура білків являє собою спосіб укладання в тримірному просторі поліпептидного ланцюга з певною вторинною структурою. Залежно від форми та особливостей тримірної просторової організації розрізняють глобулярні та фібрилярні білки. Глобулярні білки – білки, що мають округлу (кулеподібну або еліпсоподібну) форму. Це альбумін сироватки крові, міоглобін м’язів, гемоглобін, більшість ферментних білків. Глобулярні білки побудовані з одного або з декількох зв’язаних дисульфід ними містками поліпептидних ланцюгів, що згорнуті в щільні кулеподібні форми. Фібрилярні білки – білки, структурною особливістю яких є витягнута форма молекул. Вони схильні до утворення мультимолекулярних ниткоподібних комплексів – фібрил, що складаються з декількох паралельних поліпептидних ланцюгів. Фібрилярні білки є структурними компонентами сполучної та інших опорних тканин організму. Прикладами структурних фібрилярних білків є колаген – найбільш розповсюджений білок організму людини, що становить до 30% загальної кількості тканинних білків, еластин сполучної тканини, Четвертинна структура білків утворюється при об’єднанні (агрегації) декількох поліпептидних ланцюгів або протомерів, кожен з яких має свою характерну впорядковану конформацію.
Мал. 27. Четвертинна структура молекули гемоглобіну Білки з четвертинною структурою можуть включати як однакові протомери (гемоглобін), так і різні. У складі багатьох білків – ферментів містяться різні протомери, що виконують різні біохімічні функції (зокрема каталітичну та регуляторну). Методичні рекомендації 1.При розгляді першого питання звернути увагу на типи зв’язків у білкових молекулах. 2.Ознайомлюючись із матеріалом другого питання, замалювати структури білка. Запитання для самоперевірки: 1.Що таке поліпептидний ланцюг? Яка його будова? 2.Які різновиди вторинної структури вам відомі? 3.Як поділяються білки за своєю третинною структурою? 4.Як утворюється четвертинна структура білкової молекули?
Тести для самоконтролю І рівень 1.Вказати пептидний (амідний) тип зв’язку: а)- С – О – О – R; в) - S – S -; б) – C – N –; г) - N = N -. II I O H 2.Яка із структур є вторинною: а)глобула; в) б)фібрила; г) поліпептид. 3.Вказати найбільш розповсюджений білок людського організму: а)гемоглобін; в)еластин; б)кератин; г)колаген. ІІ рівень 4. Який зв’язок належить до ковалентних: а)дисульфідний; в)дипольний; б)водневий; г)йонний. 5.Поліпептидний зв’язок утворюється між С = О та NH – групами, які віддалені одна від одної на: а)3,6 амінокислотних залишки; в)3 амінокислотних залишки; б)2 амінокислотних залишки; г) 6 амінокислотних залишки. ІІІ рівень 6.Скласти формулу тетрапептиду, який побудований із залишків аланіну.
|
||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 1451; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.200.7 (0.007 с.) |

 - аміногруп амінокислот, що утворюють пептидний ланцюг.
- аміногруп амінокислот, що утворюють пептидний ланцюг.
 = 0,1 нм)
= 0,1 нм)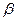 - структуру. (Мал. 15.)
- структуру. (Мал. 15.)