Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Мал. 4. Типова хроматограма. Мал. 5. Хроматограма розділенняСодержание книги
Поиск на нашем сайте
Двокомпонентної суміші Величину Rf використовують для ідентифікації речовин. Ідентичність визначають одночасним хроматографуванням на одному аркуші паперу досліджуваного і автентичного зразка тієї самої речовини. Якщо зразки ідентичні, відповідні їм плями на хроматограмах мають однаковий вигляд і ті самі значення Rf(мал. 5). Кількісне визначення полягає у тому, що пляму вирізають і після подрібнення паперу екстрагують досліджувану речовину відповідним розчинником. Вміст речовини визначають будь-яким методом, придатним для визначення малих кількостей (спектрофотометрія, полярографія тощо). Тонкошарова хроматографія (ТШХ). У цьому методі роль носія виконує тонкий шар порошкоподібного сорбенту, нанесений на скляну або металеву пластинку. Як сорбенти застосовують силікагель, алюміній оксид, магній силікат тощо. Аналіз цим методом в цілому мало чим відрізняється від паперової хроматографії. У той же час ТШХ має перед нею ряд переваг: висока швидкість процесу хроматографування, можливість використання як нерухомої фази більшого асортименту сорбентів, застосування кислих та лужних рухомих фаз та обробка хроматограм за підвищених температур. ПХ та ТШХ займають одне з провідних місць серед методів розділення та аналізу органічних та біоорганічних сполук. Ними можна визначити речовини масою 10-20 мкг, тривалість розділення становить кілька хвилин, тому їх часто застосовують як експрес-методи. Методичні рекомендації
Запитання для самоперевірки:
Тести для самоконтролю І рівень 1. Вказати метод хроматографії, який належить до рідинної: а) паперова; б) афінна; в) тонкошарова; г) газова. 2. За формою проведення процесу розрізняють... а) колонкову; б) капілярну; в) паперову; г) хемосорбційну хроматографію. 3. Паперову хроматографію поділяють на: а)афінну; б) розподільну; в) адсорбційну; г) капілярну. ІІ рівень 4.Як експрес – методи використовують: а) молекулярно – ситову; б) паперову; в) осадову; г) тонкошарову хроматографії. 5. Хроматографічний метод базується на дослідженні сумішей за допомогою: а) сорбційних процесів; б) осмотичного тиску; в) різниці потенціалів; г) різниці температур. ІІІ рівень
а) газову колонку; б) скляну пластинку; в) хроматографічний папір; г) металеву пластинку.
а) виділення і очищення полімерів; б) визначення молекулярної маси білка; в) визначення рівня холестерину в крові. Позааудиторна самостійна робота № 14 Тема: Проведення електрофорезу в дослідницькій та клініко – Діагностичній лабораторії. Електрофореграми План
Час виконання: 2 години Мета роботи: ознайомитися із застосуванням електрофорезу з дослідницькою та діагностичною метою Електрокінетичними називають явища, які грунтуються на взаємозв'язку між електричними та кінетичними властивостями дисперсних систем. Вони полягають у тому, що складові дисперсної системи (дисперсна фаза або дисперсійне середовище) рухаються в електричному полі, або, навпаки, виникає різниця потенціалів під час переміщення частинок або рідини. Усі електрокінетичні явища пов'язані з існуванням на межі поділу фаз подвійного електричного шару. Їх класифікують таким чином. 1. Електрокінетичні явища першого роду, які пов'язані з переміщенням в електричному полі складових дисперсної системи (дисперсної фази або дисперсійного середовища).До них належать: а) електрофорез;б) електроосмос. 2. Електрокінетичні явища другого роду, які пов'язані з виникненням різниці потенціалів під час переміщення частинок твердої фази (потенціал седиментації або осідання) або рідкого дисперсійного середовища (потенціал течії або перебігу). Це процеси, обернені до електрофорезу та електроосмосу. Швидкість руху частинок в електричному полі залежить від величини їх заряду. Тому наведені вище електрокінетичні явища дають змогу виміряти величину Наявність електричного заряду у частинок дисперсних систем і електрокінетичні явища були вперше виявлені професором Московського університету Ф. Рейссом 1808 року. Електрофорез - це спрямоване переміщення частинок дисперсної фази у постійному електричному полі відносно нерухомого дисперсійного середовища. Вивчаючи електроліз води, Ф. Рейсс пропускав постійний електричний струм у приладі, який складався з двох скляних трубок, заповнених водою, занурених у шар вологої глини (мал. 6 а).
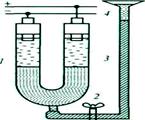
а б Мал. 6.Схема досліду Рейсса з електрофорезу (а) і рух частинок під час електрофорезу (б) При цьому він спостерігав помутніння рідини в трубці з позитивним електродом, очевидно за рахунок переміщення негативно заряджених частинок дисперсної фази (глини) до анода. Таке явище було назване електрофорезом. Рухливість частинок в електричному полі зумовлена тим, що за умови накладання зовнішньої різниці потенціалів розривається ПЕШ на межі "ковзання", в результаті чого частинка набуває певного заряду і рухається до електрода, знак заряду якого протилежний до заряду частинки. При цьому протиіони дифузного шару переміщуються до протилежно зарядженого електрода (мал. 6, б). Швидкість руху частинок дисперсної фази пропорційна величині їх електрокінетичного потенціалу. Тому, спостерігаючи електрофоретичний рух частинок, можна визначити знак заряду частинок дисперсної фази і величину потенціалу. Методика проведення електрофорезу. Експериментально електрофорез проводять у приладі, який є U-подібною градуйованою трубкою з боковим відростком (мал. 7.).
Мал. 7. Схема приладу для проведення електрофорезу: 1 -U-подібна трубка; 2 - кран; 3 - гумовий шланг; 4 скляна лійка Спочатку в посудину 1 наливають ультрафільтрат допоміжного золю (проміжну рідину) (приблизно 1/3 посудини). Закривають кран 2 і у лійку 4 наливають досліджуваний золь. Обережно відкриваючи кран, випускають забарвлений золь, який займає нижню частину приладу, витісняючи проміжну рідину вверх. Після занурення електродів у рідину кран закривають, вмикають струм і слідкують за переміщенням границі золю S(S =h2 –h1) за певний проміжок часу. Залежно від заряду колоїдних частинок межа золю піднімається до катода чи анода. Обчислюють величину Застосування електрофорезу у медичних дослідженнях. Клітини організму мають різний за величиною заряд, причому кожен тип клітин звичайно характеризується певним, досить стабільним значенням потенціалу. Жива протоплазматична поверхня та всі біологічні поверхні мають негативний заряд. Зокрема, у різних ссавців при рН = 7,4 величина Низьке значення ізоелектричної точки еритроцитів (рНіет = 1,7), а також їх постійний негативний заряд можна пояснити йонізацією кислотних груп фосфоліпідів на поверхні еритроцитів. Лейкоцити, як і еритроцити, рухаються до анода; їх негативний заряд зумовлений дисоціацією йоногенних груп білків сироватки крові, які адсорбуються на поверхні лейкоцитів. За електрофоретичною рухливістю клітини крові можна розмістити у такій послідовності: гранулоцити 0,6 ·10-12 м2/ (с·В); лімфоцити 0,8 ·10-12 м2/(с·В); еритроцити 1·10-12 м2/(с·В). Впровадження електрофорезу у біохімічні дослідження дало змогу розділити складні суміші біологічних рідин і дослідити їх індивідуальні характеристики, зокрема склад білків сироватки крові та шлункового соку. Серед біологічних рідин найкраще досліджена і викликає найбільший інтерес кров (таблиця 3).
|
||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 759; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.184.36 (0.011 с.) |

 -потенціалу.
-потенціалу.