
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Позааудиторна самостійна робота № 1Содержание книги
Поиск на нашем сайте І семестр
Тематичний план позааудиторної самостійної роботи студентів
Позааудиторна самостійна робота № 1 Тема: Хімічні властивості s - елементів План 1.Поняття про активність металів. 2.Взаємодія лужних та лужноземельних металів з простими та складними речовинами. Час виконання: 2 години Мета роботи: узагальнити знання про хімічні властивості s – елементів. Хімічні властивості металів зумовлені здатністю їх атомів легко віддавати електрони з зовнішнього енергетичного рівня, перетворюючись на позитивно заряджені йони. Таким чином в хімічних реакціях метали проявляють себе енергійними відновниками. Це є їх головною загальною хімічною властивістю. Здатність віддавати електрони в атомів окремих металічних елементів є різною. Чим легше метал віддає свої електрони, тим він активніший, і тим енергійніше реагує з іншими речовинами. На основі досліджень всі метали були розташовані в ряд по зменшенню їх активності. Цей ряд вперше запропонував видатний вчений М. М. Бекетов. Такий ряд активності металів називають ще витискувальним рядом металів або електрохімічним рядом напруг металів. Він має наступний вигляд: Li, K, Ва, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Рt, Au За допомогою цього ряду можна виявити який метал є активнішим за інший. У цьому ряді присутній водень, який не є металом. Його відновні властивості прийняті для порівняння за своєрідний нуль. Як бачимо, найактивнішими металами є метали головних підгруп І та ІІ груп, тобто s – елементи. До цих елементів належать лужні метали (І група) та лужноземельні (Магній, Кальцій, Стронцій та Барій). Маючи властивості відновників, метали реагують з різними окисниками, насамперед з неметалами. З киснем метали реагують за нормальних умов або при нагріванні з утворенням оксидів, наприклад: 2Mg0 + O02 = 2Mg+2O-2 Активно відбуваються реакції s - елементів з галогенами, наприклад, згоряння кальцію у хлорі: Ca0 + Cl02 = Ca+2Cl-2 Реакції з сіркою: 2Na0 + S0 = Na2+S-2 Активні метали, що знаходяться в ряду активності металів до Mg, реагують з водою з утворенням лугів та водню: 2Na0 + 2H+2O → 2Na+OH + H02 Лужні та лужноземельні метали витісняють (відновлюють) водень із розведених кислот: Mg0 + 2H+Cl → Mg+2Cl2 + H0 Атоми металів у цих реакціях є відновниками, а йони Гідрогену — окисниками. Розглянемо відношення лужних металів до кислот-окисників на прикладі натрію: 8Na + 10HNO3 (розв) = 8NaNO3 + NH4NO3 + 3H2O, 3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2O, 8 Na + 5H2SO4 (конц) = 4Na2SO4 + H2S + 4H2O. Як видно з рівнянь реакцій натрій відновлює Нітроген (+5) у конценрованій HNO3 до ступеня окиснення +2, а в розведеній - аж до -3. Сульфур (+6) в концентрованій H2SO4 теж відновлювається максимально - до найнижчого ступеня окиснення -2. Відношення до солей. Лужні метали, які розміщуються на самому початку ряду напруг, належать до найбільш активних відновників, тому при внесенні їх у водні розчини солей малоактивних металів вступають у взаємодію не з самою сіллю, а з водою, що міститься у розчині, наприклад: 2K + 2H2O = 2KOH + H2. Отже, метали здатні реагувати з неметалами, водою, кислотами. У всіх цих випадках метали окиснюються і є відновниками. Для прогнозування перебігу хімічних реакцій за участю металів слід використовувати витискувальний ряд металів. Методичні рекомендації 1.При вивченні першого питання скласти опорний конспект і звернути увагу на положення s - елементів у витискувальному ряду. 2. Розглядаючи друге питання, скласти рівняння реакцій, які характеризують хімічні властивості лужних та лужноземельних металів на прикладі калію та кальцію. Завдання для самоконтролю:
Тести для самоконтролю: Рівень І 1.Вказати металічний елемент, який належить до s – елементів: а) Ферум; б) Купрум; в) Гідроген; г) Цезій. 2.Вказати продукти реакції, які утворюються при взаємодії натрію з водою: а) натрій гідроксид і вода; б) натрій гідроксид і водень; в) натрій оксид і вода; г) натрій оксид і водень. 3. Вказати властивості, які у хімічних реакціях проявляють оксиди s – елементів: а) основні оксиди; б) кислотні оксиди; в) кислотні оксиди; г) несолетворні оксиди. Рівень ІІ 4.Хімічній елемент з конфігурацією енергетичного рівня 1s22s22p63s23p64s2 належить до: а) s – елементів; б) р- елементів; в) d – елементів; г) f – елементів. 5. У скільки разів маса атома Барію більша за масу атома Натрію: а) у 3 рази 6. Розташувати метали К, Са, Na, Mg у порядку збільшення їх хімічної активності: a) K,Ca, Na, Mg; б) Na, Mg, Na, K; в) Mg, Na, Ca, K; г) Ca, Na,Mg, K. Рівень ІІІ 7. Дописати рівняння практично здійснюваних реакцій: Ca + H2O → MgO + HNO3 → BaO + Na2O → KOH + H3PO4 → 8. Яка маса солі утвориться при взаємодії сульфатної кислоти з 400 г 2% - го розчину натрій гідроксиду? Методичні рекомендації 1.При вивченні першого питання скласти опорний конспект. 2. Розглядаючи друге питання, виписати всі можливі для атома Карбону ступені окиснення і спрогнозувати, у яких ступенях окиснення атом Карбону проявляє лише окислювальні і лише відновлювальні властивості. 3. При вивченні третього питання звернути увагу на токсичні неорганічні сполуки Карбону. 4. При опрацюванні четвертого питання скласти опорний конспект, у якому зазначити біологічну роль сполук Карбону. Запитання для самоконтролю: 1. Чому атом Карбону утворює таку велику кількість хімічних сполук? 2. Які типи гібридизації характерні для нього? 3. Навести приклади неорганічних сполук Карбону, у яких він виявляє ступінь окиснення +4. 4. Чим пояснюють те, що карбон (ІІ) оксид і ціаніди є сильними отрутами? На яких властивостях ґрунтується їх дія на організм? Тести для самоконтролю: Рівень І 1.У періодичній системі хімічних елементів Д. І. Менделєєва Карбон розташований у... а) 1 періоді; б) 2 періоді; в) 3 періоді; г) 4 періоді. 2. Серед наведених сполук вказати солі карбонатної кислоти: а) КНСО3; б) СН3СООН; в) СаСО3; г)НСООК. 3. Ціанідна кислота та її солі виділяються з організму у вигляді йону SCN- з: а) калом; б) сечею; в) через шкіру; г) повітрям. Рівень ІІ 4.Серед наведених сполук Карбону вказати несолетвірний оксид: а) СО; б) СО2; в) СаС2; г) CS2. 5. Ціанід – йони використовуються організмом в мікрокількостях для: а) побудови кісткової тканини; б) побудови вітаміну В12; в) утворення карбоксигемоглобіну; г) інша відповідь. 7. Вказати вірну формулу магній ціаніду: а) MgCN; б) MgSCN; в) Mg(CN)2; г) Mg(CN)3. Рівень ІІІ 8.У яких випадках карбон (IV) оксид буде вступати у взаємодію: а) СО2 + Н2О = б) СО2 + NaOH = в) CO2 + P2O5 = 9.. Який об’єм вуглекислого газу (н. у.) міститься у 100 м3повітря? Методичні рекомендації 1. При вивченні першого питання звернути увагу на поділ сполук Феруму, що міститься у біосистемах. 2. Розглядаючи друге питання, звернути увагу на біологічну роль Цинку та Купруму. 3. При опрацюванні третього питання скласти опорний конспект, у якому зазначити біологічну роль та патологічні стани, що виникають при надлишку та недостачі Мангану та Кобальту. 4. При вивченні четвертого питання звернути увагу на синергізм та антагонізм біоелементів. 5.Опрацювати теоретичний матеріал, що висвітлює п’яте питання і заповнити таблицю:
Запитання для самоперевірки: 1. Які наслідки зниження рівня Феруму в крові людини? Яким чином можна цьому запобігти? 2. Описати біологічну роль Купруму, вказати біокомплекси, що містять цей елемент і зазначити, які захворювання виникають за дефіциту і надлишку в організмі цього мікроелемента. 3. На якій підставі до біогенних елементів відносять Манган, Молібден, Хром? Які добові потреби цих елементів? 4. До складу яких важливих ферментів входить Цинк і яку функцію він виконує? 5. З якими процесами в організмі пов’язана біологічна роль Кобальту? Як він впливає на засвоєння організмом Феруму та у вигляді яких сполук застосовується в медицині? 6. Як змінюється вміст Хрому в крові при старінні і виснаженні організму та рівень Ніколу при інфаркті міокарда? Тести для самоконтролю: І рівень 1. Вказати d – елемент, який міститься у VIII групі періодичної системи: а) Кобальт; б) Хром; в) Ванадій; г) Купрум. 2. При недостачі якого з елементів розвиваються анемії: а) Цинку; б) Феруму; в) Молібдену; г) Кадмію. 3. Які з мікроелементів беруть участь у формуванні кісткової тканини: а) Манган; б) Титан; в) Ферум; г) Цинк. ІІ рівень 1. Які з пар d – елементів є антагоністами? а) Cr – Mn; б) Cu – Fe; в) Mo – Cu; г) Zn – V. 5.Підвищений рівень яких елементів може викликати виникнення злоякісних пухлин? а) Цинку; б) Кадмію; в) Титану; г) Феруму. 6. Які з пар елементів є синергістами? а) V – Fe; б) Cu – Fe; в) Zn – Mo; г) Со – Мо. ІІІ рівень 7. Дія якого мікроелемента спричинює порушення фосфорно – кальцієвого обміну? а) Молібдену; б) Магнію; в) Феруму; г) Ванадію. І рівень 1. Які види ізомерії характерні для комплексних сполук: а) просторова; б) таутомерія; в) оптична; г) гідратна. 2.Суфікс -ат до назви комплексоутворювача додається у: а) катіонній КС; б) аніонній КС; в) електронейтральній КС. 3.Координаційному числу 6 відповідає суфікс: а) тетра-; б) три -; в) гекса -; г) окта-. ІІ рівень
а) координаційну ізомерію; б) оптичну ізомерію; в) просторову ізомерію. 4.Назві тетраамінцинк сульфат відповідає формула КС: а)K2[Zn(OH)4]; б)[Zn(NH3)4]SO4; в)[Zn(NH3)2(H2O)2] ІІІ рівень 5.Вказати формулу катіонної КС: а) K4[Fe(CN)6]; б) [Mo6Cl8]Cl4; в) K[PtCl3(C2H4)] 6. Ступінь окиснення центрального атома у КС [Cr(NH3)5Br]SO4 дорівнює: а) +3; б) +2; в) +6. План 1.Поняття про окисно – відновні реакції та ступінь окиснення. 2. Окиснення і відновлення – дві сторони єдиного окисно – відновного процесу. 3. Класифікація окисно – відновних реакцій. 4. Зрівнювання рівнянь ОВР методом електронного балансу. Час виконання: 2 години. Мета роботи: вміти класифікувати ОВР та урівнювати рівняння ОВР методом електронного балансу.
Окисно – відновні реакції (ОВР) відносять до найпоширеніших хімічних процесів у природі. Це згоряння різноманітних видів палива, корозія металів, добування металів із руд, електроліз тощо. Вони лежать в основі колообігу хімічних елементів у природі, багатьох виробничих процесів, наприклад: добування амоніаку, лугів, мінеральних кислот, пластмас, лікарських засобів тощо. Окисно – відновні процеси є основою життєдіяльності, оскільки з ними пов’язані обмін речовин і дихання, гниття та бродіння органічних сполук, засвоєння вуглекислого газу зеленими листками (фотосинтез). Процеси окиснення – відновлення – це джерело енергії в ланцюзі дихання, за рахунок чого організм отримує майже 99% усієї енергії. Вони лежать в основі синтезу життєво необхідних органічних сполук – незамінних амінокислот, вуглеводів, жирних кислот, гормонів. Розглянемо основні положення теорії ОВР, оскільки вони є дуже важливими для вивчення хімії біогенних елементів, певних розділів фізичної та колоїдної хімії. Значний внесок у розвиток теорії процесів окиснення – відновлення зробив французький хімік Л. Лавуазьє. Встановивши склад повітря. Він уперше пояснив процеси горіння і дихання організмів взаємодією речовин з киснем. Сучасна теорія ОВР ґрунтується на електронних уявленнях. Її розробляли такі українські й російські вчені, як Л. Писаржевський, М. Шилов, С. Даїн, Я. Михайленко та ін. Вони сформулювали теорію, за якою окисно – відновними реакціями вважають процеси, пов’язані з перенесенням електронів від одних атомів до інших. Реакції, які відбуваються зі зміною ступеня окиснення атомів, що входять до складу молекул реагуючих речовин, називають окисно – відновними, наприклад: 3Cu+2O + 2N-3H3 = 3Cu0 + N02 + 3H2O Cu+2 N-3 Ступінь окиснення (с. о.) – це умовний заряд атома в сполуці, обчислений на основі припущення, що ця сполука складається з йонів. Ступінь окиснення елементів у простих речовинах дорівнює нулю: С0, Н20, Са0. Атоми гідрогену у більшості сполук, крім гідридів складу МеН, мають с. о. +1. Оксиген має ступінь окиснення -2, за винятком пероксидів (Н2О2, Na2O2) та його сполуки з Флором OF2. однієї сполуки, наприклад: 2КСІ+5О-23 = 2КСІ- + 3О02 СІ+5 +6е О-2 - 2е в)диспропорціонування (самоокислення – самовідновлення), в яких атоми того самого елемента у складі однієї молекули виступають як в ролі окисника, так і в ролі відновника: 3S0 + 6KOH = 2K2S-2 + K2S+4O3 + 3H2O S0 - 4e S0 + 2e Щоб урівняти рівняння ОВР методом електронного балансу, необхідно дотримуватись такого алгоритму:
N-3H+3 + O20 Відновник окисник В цій реакції змінюють ступені окиснення Нітроген і Оксиген. До реакції нітроген у складі амоніаку мав с.о. -3, а після реакції с.о. підвищився до +2. Атоми Оксигену у складі кисню в лівій частині були електронейтральні (с. о. 0), а після реакції с. о. Оксигену знизився до -2. 2. Складаємо для Нітрогену і Оксигену схеми електронних переходів: N-3 -5e 200 + 4e 3. Складаємо електронний баланс: N-3 -5e 200 + 4e Для цього між кількістю електронів, що їх віддав відновник (5), і кількістю електронів, що їх приєднав окисник (4), відшукаємо найменше спільне кратне. Воно дорівнюватиме 20. Поділимо 20 на 5 і одержимо коефіцієнт в електронному балансі для Нітрогену (4). Поділимо 20 на 4 і одержимо коефіцієнт в електронному балансі для Оксигену (5). Підсумовуючи ліву та праву частини рівняння з урахуванням множників, отримаємо: 4N-3 + 5O20 = 4N+2 + 10O-2 Отримані за електронним балансом коефіцієнти переносимо у схему реакції: 4NH3 + 5O2 = 4NO + 6H20 Методичні рекомендації 1. При опрацюванні першого питання звернути увагу на визначення окисника та відновника та записати їх. 2. Розглядаючи друге питання, уяснити суть окисно – відновного процесу. 3. При розгляді третього питання скласти опорний конспект. 3. Розглядаючи четверте питання, вивчити алгоритм зрівнювання рівнянь ОВР методом електронного балансу. Скористатися пам’яткою 3. Запитання для самоперевірки:
K + H2O = KOH + H2 MgO + HCl = MgCl2 + H2O Al + N2 = AlN C + HNO3 = CO2 + NO2 + H2O 3. Що таке ступінь окиснення і як його визначають? 4. Як класифікують окисно – відновні реакції? План 1. Поняття про масову, мольну та об’ємну частку розчиненої речовини. 2.Молярна, моляльна концентрації. 3.Молярна концентрація еквівалента. Фактор еквівалентності та його обчислення. 4.Поняття про титр розчину. 5.Розрахункові формули для переходу від одного способу вираження складу розчину до іншого. 6.Виконання тренувальних вправ і задач. Час виконання: 3 години Мета роботи: ознайомитися із способами вираження складу розчинів; навчитися розв’язувати розрахункові задачі по даній темі.
Важливою характеристикою розчину є його кількісний склад, тобто вміст розчиненої речовини у певній кількості розчину або розчинника. Склад розчину можна виразити як часткою розчиненої речовини так і концентрацією розчиненої речовини. Концентрацією розчиненої речовини (не розчину!) називають відношення кількості або маси розчиненої речовини до об’єму розчину. Концентрація – це відношення неоднотипних фізико – хімічних величин. Способи вираження концентрації залежать від одиниць виміру кількості розчину, розчиненої речовини (В) і розчинника (А). 1.Масова частка розчиненої речовини В (ω) – це відношення маси розчиненої речовини m(В) до загальної маси розчину m р-ну:
2. Мольна частка розчиненої речовини (NB) – це відношення кількості речовини компонента В (νB) до загальної кількості всіх компонентів розчину: NB =
3. Об’ємна частка розчиненої речовини (φB) – це відношення об’єму розчиненої речовини () до суми об’ємів всіх компонентів розчину: φB =
4. Молярна концентрація (СМ) – це відношення кількості розчиненої речовини νВ до об’єму розчину Vр-ну, вираженого у кубічних дециметрах (літрах): CM = 5. Моляльна концентрація (Сm) – це відношення кількості розчиненої речовини νB до маси розчинника mА, вираженої у кілограмах: Cm = 6.Молярна концентрація еквівалента (Секв) – це відношення кількості речовини еквівалентів розчиненої речовини νекв до об’єму розчину Vр-ну , вираженого у кубічних дециметрах (літрах): Секв = Молярна маса еквівалента Мекв речовини В дорівнює добутку її молярної маси МВ (г/моль) на фактор еквівалентності fекв. Фактор еквівалентності показує, яка частка моля речовини реагує (еквівалентна) з одним молем атомів Гідрогену в певній кислотно – основній реакції або одному електрону в цій або відповідній окисно – відновній реакції. Молярна маса еквівалента кислоти дорівнює її молярній масі, поділеній на основність, тобто на число атомів Гідрогену в молекулі кислоти. Наприклад, молярна маса еквівалента сульфатної кислоти дорівнює Мекв (H2SO4) = 98г/моль: 2= 49 г/моль.
Розчини однакової молярної концентрації еквівалента реагують між собою в однакових об’ємних співвідношеннях. Між об’ємом розчину та його молярною концентрацією еквівалента існує обернено пропорційна залежність:
7. Титр розчину (Т) виражають масою розчиненої речовини В (у грамах). Що міститься в 1 мл розчину (1 см3): Т = Між титром і молярною концентрацією еквівалента є залежність: Т = Часто доводиться виконувати перерахунок концентрації розчинів з одних одиниць в інші. Це можна швидко зробити, використовуючи наведені нижче формули. Рівняння для перерахунку масової частки компонента в молярну концентрацію або молярну концентрацію еквівалента мають такий вигляд: СМ(В) = Секв(В) = Для переходу від молярної концентрації до молярної концентрації еквівалента і навпаки користуються формулами: СМ = Секв Секв = СМ Приклад 1. У воді розчинили 8 г натрій гідроксиду. Об’єм розчину довели до 500 мл. Знайти молярну концентрацію NaOH у розчині. Дано: m(NaOH) = 8 г; Яка молярна концентрація NaOH? V(р –ну) = 500 мл. CM = Знайти: СМ(NaOH) -? Відповідь: розчин 0,4 М Приклад 2. Знайти молярну концентрацію сульфатної кислоти в розчині масою 150 г, з масовою часткою H2SO4 20% і густиною 1,139 г/мл Дано: m(р –ну) = 150 г; 1.Скільки грамів H2SO4 міститься у розчині? W(H2SO4) = 20%; mp.p. =
Знайти: V = СМ(H2SO4) -? 3. Яка молярна концентрація розчину? M(H2SO4) = 98 г/моль CM = Відповідь: СМ розчину дорівнює 2,325 М. Приклад 3. Обчислити молярну концентрацію еквівалента 500 г 10 % розчину натрій карбонату. Густина розчину 1,115 г/мл. Дано: m(р –ну) = 500 г; 1. Знаходимо молярну масу еквіваленту Na2CO3: W(Na2CO3) = 10%; Мекв =
Знайти: mp.p.= Секв(Na2CO3) -? 3. Який об’єм займе розчин? V = 4.Яка молярна концентрація еквівалента розчину? Секв = Відповідь: Секв(Na2CO3) = 2,1 н. Методичні рекомендації 1.При розгляді першого питання записати визначення способів вираження концентрації. 2. При розгляді другого питання, скласти опорний конспект, у якому зазначити формули, які використовують для розрахунку молярної та моляльної концентрацій. 3.Вивчаючи третє питання, звернути увагу на обчислення фактору еквівалентності для кислот, основ та солей. 4. При опрацюванні четвертого питання, записати означення титру розчину та формули, які використовуються при його обчисленні. 5. При розгляді п’ятого питання записати розрахункові формули, які використовуються при розв’язуванні задач. 6.При вивченні шостого питання розглянути приклади розв’язування типових розрахункових задач по темі. Скористатися пам’яткою 4. Завдання для самоконтролю: 1. Якими способами виражають кількісний склад розчинів? 2. Що таке концентрація розчину і якими способами її виражають? Тести для самоконтролю: Рівень І 1.Кількість розчиненої речовини (моль), що міститься в 1000 г розчинника, виражають: а) молярністю; б) полярністю; в) масовою часткою; г) об’ємною часткою. 2.Встановити відповідність між масою води і калій гідроксиду у розчинах а –г та масовою часткою КОН у них: а) 45 г води та 5 г КОН; 1) 2% б) 98 г води та 2 г КОН; 2) 25% в) 85 г води та 15 г КОН; 3) 15% г) 15 г води та 5 г КОН; 4) 10% 5) 4% Рівень ІІ 3.Визначити співвідношення мас солі та води для утворення розчину з масовою часткою розчиненої речовини 10%: а) 10 г солі у 100 г води; б) 10 г солі у 110 г води; в) 5 г солі у 50 г води; г) 10 г солі у 200 г води; д) 10 г солі у 90 г води;
4. Вказати масову частку розчиненої речовини в 400 г розчину, що містить 40 г розчиненої речовини: а) 40%; б) 10%; в) 20%; г) 30%; д) 25%. Рівень ІІІ 5.У шлунковому соку міститься 9 г HCl у 1 л розчину. Яка масова частка хлоридної кислоти (%) у цьому розчині та його молярна концентрація, якщо густина цього розчину становить 1,003 г/мл? Відповідь підтвердити розрахунками. а) 0,9%; 0,25; б) 9%; 0,5; в) 0,45%; 0,24; г) 0,09%; 0,25. План 1. Поняття про електроліти, їх роль у життєдіяльності організму. 2. Класифікація електролітів за їх ступенем дисоціації. 3. Поняття про активність йонів та константу дисоціації. Час виконання: 2 години Мета роботи: на основі теорії електролітичної дисоціації ознайомитися з сильними та слабкими електролітами.
Усі хімічні сполуки за їх здатністю проводити електричний струм поділяють на електроліти і неелектроліти. Електроліти – це речовини, які проводять електричний струм як у розплавленому стані, так і в розчинах. До них належать деякі основи та солі, які в твердому стані складаються з йонів, наприклад КСІ, СаСІ2, КОН, NaOH, LiF та ін., і речовини, що утворюють йони при розчиненні їх у воді (амоніак, хлороводень, органічні кислоти тощо). У воді електроліти дисоціюють на йони, які взаємодіють як з водою, так і між собою. Електроліти відіграють дуже велику роль у життєдіяльності організму, тому що всі фізіологічні рідини (шлунковий сік, плазма крові, позаклітинна, внутрішньоклітинна, спинномозкова рідини, секрети залоз) є розчинами електролітів. З наявністю цих сполук пов’язане певне значення осмотичного тиску та рН середовища біорідин. Електроліти здатні утримувати воду у вигляді гідратів, протидіючи зневодненню організму. Концентрація електролітів і фізіологічних рідинах впливає на розчинність білків, амінокислот та низькомолекулярних сполук. Отже, для розуміння багатьох біологічних явищ необхідно знати закономірності, яким підлягають розчини електролітів. Для будь – якої оборотної хімічної реакції можна записати математичний вираз її константи рівноваги в загальному вигляді: aA + bB Kp = Електролітичною дисоціацією називають розщеплення сполуки на йони внаслідок її взаємодії з розчинником. Кількісною характеристикою процесу електролітичної дисоціації є ступінь дисоціації Ступенем дисоціації електроліту називають відношення числа молекул, що про дисоціювали, до загального числа молекул електроліту:
Методичні рекомендації 1. При вивчені першого питання звернути увагу на значення електролітів для життєдіяльності організмів. 2. При пригляді другого питання скласти схему класифікації електролітів за ступенем дисоціації. 3. Опрацьовуючи третє питання, скласти опорний конспект і виписати означення. Запитання для самоперевірки: 1. Які речовини належать до електролітів? 2. За яким критерієм класифікують електроліти? 3. Що таке активність йонів, ізотонічний коефіцієнт? Яка математична залежність між цими величинами? Тести для самоконтролю І рівень 1. Серед наведених речовин вказати електроліти: а) С6Н12О6; б) НСl; в) КОН; г) С2Н5ОН. 2. Яка з речовин належить до сильних електролітів: а) HBr; б)H3PO4; в) CaCO3 ; г) H2CO3. 3. Серед наведених речовин вказати кислоту: а) HNO3; б) LiOH; в) K2HPO4; г) Fe(OH)3. ІІ рівень 4. Які з рівнянь електролітичної дисоціації є вірними: а) HCl | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| Поделиться: |

 . Cu0
. Cu0 · 100%
· 100%
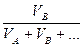
 =
= 
 =
= 
 =
= 
 =
= 
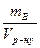





 =
=  = 0,4 моль/л
= 0,4 моль/л =
=  = 30 г
= 30 г = 1,139 г/мл 2. Який об’єм займе розчин?
= 1,139 г/мл 2. Який об’єм займе розчин? =
=  = 131,7 мл = 0,1317 л.
= 131,7 мл = 0,1317 л. = 2,325 моль/л
= 2,325 моль/л =53 г/моль
=53 г/моль = 50 г
= 50 г = 448 мл = 0,448 л
= 448 мл = 0,448 л = 2,1 г/л
= 2,1 г/л cC + dD
cC + dD
 та константа дисоціації Кд.
та константа дисоціації Кд.


