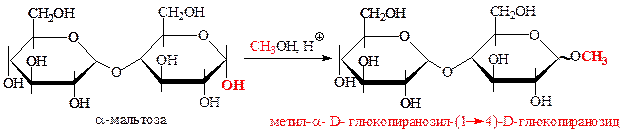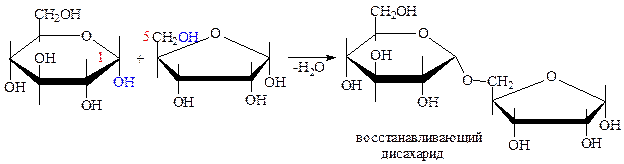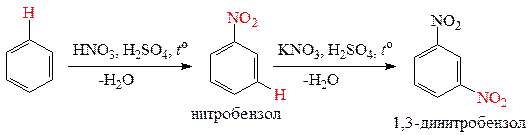Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические свойства дисахаридовСодержание книги
Поиск на нашем сайте
Для дисахаридов характерны реакции с участием: - карбонильной группы; - спиртовых гидроксилов; - только полуацетального (гликозидного) гидроксила. Реакции восстанавливающих дисахаридов Восстанавливающие дисахариды содержат в молекуле полуацетальный (гликозидный) гидроксил OH, который позволяет циклической молекуле раскрываться с образованием альдегидной группы:
По альдегидной группе дисахаридов, как и для моносахаридов характерны следующие реакции: а) восстанавливление меди и серебра из их оксидов:
б) явление мутаротации:
в) с азотсодержащими нуклеофилами:
г) в реакциях алкилирования под действием спиртов (слабое алкилирующее средство) участвует только гликозидный гидроксил:
В реакциях алкилирования под действием галогеналканов (сильное алкилирующее средство) участвуют все гидроксилы:
д) реакции ацилирования:
е) гидролиз до моносахаридов:
Реакции невосстанавливающих дисахаридов Невосстанавливающие дисахариды не содержат в молекуле полуацетальный (гликозидный) гидроксил OH, поэтому не способны превращаться в оксо-форму с образованием альдегидной группы. Следовательно, для таких дисахаридов не характерны реакции по карбонильной группе: восстанавливление меди и серебра из их оксидов; явление мутаротации; реакции с азотсодержащими нуклеофилами. Такие углеводы реагируют по спиртовым группам OH с образованием простых и сложных эфиров:
Решение 1. Из двух моносахаридов, указанных в колонках А и Б (табл.), построим восстанавливающий и невосстанавливающий дисахариды.
2. Приведем уравнения реакций: – для невосстанавливающего дисахарида с (СH3)2CHI, Ag2O;
– для восстанавливающего дисахарида с Cu(OH)2, t, °С.
Пример решения задачи 33 Приведите уравнение реакции получения бензилнитрометана из соответствующего углеводорода или галогенопроизводного углеводорода, укажите условия ее протекания. Напишите уравнения реакций данного соединения с реагентами: NaOH, H2O; HNO2, назовите полученные продукты. Нитросоединения Нитросоединения - производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на нитрогруппу. Способы получения нитросоединений 1) Нитрование алканов в условиях реакции Коновалова преимущественно идет по третичному или вторичному атому углерода с образованием продуктов мононитрования:
2) Нитрование аренов требует кислотного катализа:
3) Нуклеофильное замещение галогена в галогенопроизводных углеводородов на нитрогруппу действием нитритов натрия или калия (алкилирование нитритов):
Химические свойства 1) Восстановление нитрогруппы Восстановление нитрогруппы в алифатических нитросоединениях приводит к образованию соответствующих аминов. В качестве восстановителей применяют гидриды металлов (LiAlH4, NaBH4).
Восстановление нитрогруппы в ароматических нитросоединениях приводит к образованию ароматических аминов. В качестве восстановителей применяют каталитическое гидрировование водородом над катализаторами: H2, Ni(Pd, Pt); сульфид аммония (NH4)2S.
2) Реакции по α-углеродному атому а) Реакции с основаниями. Первичные и вторичные алифатические нитросоединения характеризуются подвижностью водорода при α-углеродном атоме, связанном с нитро-групой. Такая C-H кислотность обусловлена высокой электроотрицательностью атома азота нитрогруппы. Под действием оснований происходит отщепление водорода и образование аци -нитроформы. Нитро- и аци -нитроформа являются изомерами - таутомерами, находящимися в состоянии динамического равновесия. Таким образом, первичные и вторичные нитросоединения медленно растворяются в щелочах с образованием солей аци -нитроформы.
б) Реакции с азотистой кислотой - реакции нитрозирования. Первичные и вторичные алифатические нитросоединения регируют с азотисой кислотой с образованием нитроловых кислот и псевдонитролов, соответственно. В реакциях нитрозирования водород при α-углеродном атоме замещается на нитрозо-группу. Третичные нитросоединения в таких реакциях не участвуют, так как не содержат Н-атом у α-углеродного атома.
3) Реакции нитросоединений по ароматическому кольцу (реакции электрофильного замещения). Нитроарены в реакциях электрофильного замещения взаимодействуют только с сильными электрофильными реагентами и при повышенных температурах. Нитро-группа в аренах является заместителем II-рода, обладает электроноакцепторными свойствами и направляет замещение водорода на электрофил в мета -положение. Приведем реакции нитрования и сульфирования нитробензола.
Решение Приведем уравнение реакции получения бензилнитрометана из соответствующего галогенопроизводного углеводорода, укажем условия ее протекания и назовем исходное соединение.
Напишем уравнения реакций данного соединения с реагентами: NaOH, H2O; HNO2, назовем полученные продукты.
Пример решения задачи 34 Дайте определение понятию «основность» органического соединения. Расположите вещества N,N -диметиланилин, пропан-2-амин и 2-хлоранилин в порядке возрастания их основных свойств. Дайте необходимые пояснения. Приведите формулы и классификацию представленных в задании аминов (например, вторичный алифатическо-ароматический амин). Для наиболее слабого основания напишите уравнение солеобразования с H2SO4. Основания с точки зрения протолитической теории Бренстеда-Лоури - это соединения способные присоединять протон (Н+), то есть акцепторы протона. Основность аминов обусловлена наличием у атома азота неподеленной электронной пары. Чем выше электронная плотность на N-атоме, тем легче идет присоединение протона, тем выше основность. Электронодонорные (ЭД) группы, связанные с N-атомом, повышают на нем электронную плотность и тем самым повышают основность амина. Электроноакцепторные (ЭА) группы - наоборот понижают основность амина. Из этого следует, что алифатические амины являются более сильными основаниями, чем аммиак, так как содержат электронодонорные алкильные группы. Чем больше алкильных групп связано с N-атомом, тем выше основаниями, чем аммиак. Это связано с тем, что в следствие +М эффекта неподеленная электронная пара N-атома втянута в бензольное кольцо. Ряд основности аминов:
Благодаря основным свойствам амины образуют соли с кислотами. Чем ниже основность амина, тем с более сильной кислотой он способен образовать соль. Амины с высокой основностью образуют соли даже с низшими монокарбоновыми кислотами.
формиат диалкиламмония Алифатические амины в силу высокой основности способны присоединять протон молекулы воды. Поэтому водные растворы таких аминов имеют рН > 7. Это качественная проба на алифатические амины.
Решение N,N -диметиланилин пропан-2-амин 2-хлоранилин
Расположим предложенные амины в порядке возрастания их основности:
Для наиболее слабого основания приведем реакцию солеобразования с серной кислотой:
Пример решения задачи 35
|
||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 378; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.108.24 (0.008 с.) |