
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 2. Строение атома. Периодическая система и периодический закон Д. И. Менделеева в свете современных представлений о строении атома. Химическая связь. Комплексные соединенияСодержание книги
Поиск на нашем сайте
Строение атома Атом имеет сложное строение, он состоит из ядра и движущихся вокруг ядра электронов (масса ~ 0, заряд -1); атом электронейтрален, вся масса атома сосредоточена в ядре. Ядро состоит из нуклонов: протонов – р+ (масса 1, заряд +1, их число (Nр+) равно номеру элемента в периодической системе Д.И. Менделеева) и нейтронов – n0 (масса 1, заряд 0, их число равно Nn0 = Ar – Nр+, где Ar относительнаяатомная масса элемента). Например, у атома меди 2964 Сu число протонов Nр+ = 29, число электронов Nē = 29, число нейтронов Nn0 = Ar(Сu) – Nр+ = 64 – 29 = 35. Изотопы – разновидности атомов одного и того же химического элемента, которые имеют разные массовые числа. Свойства атомов химического элемента зависят не от их масс, а от зарядов их атомных ядер (числа р+). Каждый химический элемент встречается в природе в виде смеси изотопов. Например, Ar(К) = 39,102, т.к. в природе встречаются два вида изотопов калия: 39К с массовым числом 39 и 40К с массовым числом 40. Изотопы водорода 11Н – протий, 21Н – дейтерий, 31Н – тритий. Изобары – атомы различных элементов, имеющие одинаковые массовые числа 4018Ar, 4019K, 4020Ca. Совокупность электронов, окружающих атомное ядро, называется электронной оболочкой. В электронной оболочке различают слои, на которых расположены электроны с различным запасом энергии, поэтому их называют энергетическими уровнями. Число уровней в атоме химического элемента равно соответствующему ему номеру периода в таблице Менделеева (у атома Р, элемента III периода, три уровня, а у атома Ва, элемента VI периода, шесть уровней). Энергетические уровни, содержащие максимальное число электронов – завершенные. Часть атомного пространства, в которой вероятность нахождения данного электрона наибольшая (≈ 90 %), называется атомной орбиталью. Виды атомных орбиталей: s-орбиталь ( имеет форму шара, может разместить не более 2 ē), р-орбиталь (имеет форму объемной восьмерки, на р-подуровне может находиться не более 6 ē), d-орбиталь (имеет форму объемной восьмерки, на d-подуровне может находиться не более 10 ē), f-орбиталь (на f-подуровне может находиться не более 14 ē). Современная теория строения электронных оболочек атома базируется на следующих экспериментальных и теоретических данных: 1. Гипотеза Планка о дискретности, квантовании энергии. Согласно Планку, энергия излучается и поглощается порциями – квантами: ∆Е=hν, где ∆Е – поглощенная или излученная энергия, h – постоянная Планка, равная 6,63·10-34 Дж·сек, ν – частота излучения. 2. Опыты Резерфорда по облучению тонкой золотой фольги α-частицами, на основании которых Резерфорд впервые смог оценить размер атома. Эта величина была равной ~10-8см, при этом оказалось, что практически вся масса атома сосредоточена в области ~10-13см (ядро). 3. Гипотеза де Бройля о волновых свойствах любой микрочастицы: любой вид движения носит одновременно и волновой и корпускулярный характер. Математическое выражение этой гипотезы имеет вид:
4. Волновое уравнение Шредингера. В нем Шредингер исходил из предположения, что устойчивому состоянию электрона в атоме соответствует стоячая волна. Состояние электрона в атоме описывает волновая функция (ψ-функция), являющаяся решением уравнения Шредингера. Эта функция (точнее квадрат ее модуля |ψ|2) дает вероятность нахождения электрона на данном расстоянии от центра атома. Поскольку ψ-функция связана с вероятностью, то вводят понятие орбиталь. Под орбиталью понимают часть атомного пространства, в которой вероятность нахождения данного электрона наибольшая (равна ≈ 90 %), т.е. Непосредственно из уравнения Шредингера вытекают три числа, получившие названия квантовых чисел, описывающих состояние электрона в атоме (n, l, m). Однако скоро выяснилось, что их недостаточно для полного описания состояния электрона в атоме. Это связано с тем, что электрон имеет собственный момент количества движения, так называемый спин. Для учета этого факта в волновую функцию было введено четвертое, спиновое квантовое число (m s), модифицировав волновую функцию, которая в настоящее время описывается четырьмя квантовыми числами, т.е. ψ=f (n, l, m, ms). Квантовые числа. Набор квантовых чисел определяет энергетическое состояние электрона в атоме. Когда говорят о смысле квантовых чисел, выделяют физический (энергетический) смысл и геометрический (форма и взаимное расположение орбиталей в пространстве атома). 1. Первое квантовое число называется главное квантовое число иобозначается n. Принимает целочисленные значения от l до ∞, т.е.[l…∞]. С главным квантовым числом связан основной запас энергии электрона в атоме. С увеличением значения n энергия электрона в атоме увеличивается. Главное квантовое число определяет энергетический уровень, на котором находится электрон. В этом случае уровни принято обозначать заглавными латинскими буквами, начиная с К, т.е.: Значения n: 1 2 3 4 5 6 7 Уровень: K L M N O P Q. Количество электронов на данном уровне (емкость уровня) можно определить по формуле N = 2n2, где n – значение главного квантового числа. 2. Второе квантовое число называется орбитальное квантовое число и обозначается l. Оно зависит от главного квантового числа n и при данном значении его принимает целочисленные значения от 0 до (n- 1), т.е. [0, n- 1]. Орбитальное квантовое число связано с моментом количества движения электрона в атоме. С ростом l энергия электрона в атоме растет, n и l определяют весь запас энергии электрона в атоме. Значения орбитального квантового числа определяют подуровень данного уровня, тип и форму орбитали. При этомдля орбиталей используются условные обозначения: Значение l: 0 1 2 3 4 5 Тип орбитали: s p d f g h 3. Третье квантовое число называется магнитное квантовое число и обозначается m или ml. Оно зависит от орбитального и при данном значении его принимает целочисленные значения от –l до +l, через единицу, включая 0, всего 2l+1 значений. Магнитное квантовое число связано с энергией магнитного взаимодействия электрона с внешним магнитным полем. Число значений магнитного квантового числа (2l +1) дает число орбиталей данного типа. Сами значения m определяют пространственное расположение орбиталей данного типа относительно друг друга. В отсутствии внешнего магнитного поля все орбитали данного типа имеют одинаковую энергию.
4. Четвертое квантовое число называется спиновое квантовое число и обозначается ms или s. Оно определяется внутренними свойствами электрона и может принимать два условных значения +1/2 и – 1/2.Спиновое квантовое число определяет собственный момент количества движения электрона. Считается, что когда ms = +1/2 (графическое изображение – ↑), то электрон вращается относительно оси, совпадающей с направлением движения по часовой стрелке, когда – 1/2 (графическое изображение – ↓), то – против часовой стрелки. В атоме все электроны физически неразличимы, поэтомумы можем определить только набор квантовых чисел последнего по энергии состояния, которое занимает какой-то электрон. Заполнение электронных состояний в атоме. Набор квантовых чисел определяет энергетическое состояние электрона в атоме. В атоме число электронов равно порядковому номеру элемента или, точнее, заряду ядра атома. При заполнении электронных состояний атома в первую очередь заполняется то, которое имеет меньшую энергию. При заполнении электронных состояний атома последовательно реализуются следующие принципы: 1. Минимум энергии:электроны занимают наиболее энергетически выгодную орбиталь, на которой имеется хотя бы одно свободное место. 2. Принцип запрета Паули:в атоме не может быть двух и более электронов, обладающих одинаковым набором всех четырех квантовых чисел (следовательно, на одной орбитали не может располагаться более двух электронов, они должны различаться спиновым квантовым числом). 3. Правило Гунда (Хунда): электроны располагаются по орбиталям таким образом, чтобы их суммарный спин был максимальным (ms), т. е. на подуровне должно быть максимальное число неспаренных электронов. 4. Правила Клечковского: 1-ое правило: при увеличении заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел (n+l) к орбиталям с большим значением этой суммы. 2-ое правило: при одинаковых значениях суммы n+l заполнение орбиталей происходит в порядке возрастания значений главного квантового числа n.
Последовательность заполнения электронных состояний в атоме: 1s2 2s22p6 3s23p6 4s23d104p6 5s24d105p6 6s25d14f145d96p6 7s26d15f146d97p6 Отметим, что в 6-ом и 7-ом периодах сначала один электрон занимает d-состояние, затем происходит полное заполнение f-подуровня, и лишь после этого протекает заполнение d-подуровня до 10 электронов. Следует отметить, что после полного заполнения d- и f-подуровней они «проваливаются» по энергии, и соотношение по энергии имеет вид: Ens>E(n-1)d>E(n-2)f.
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 503; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.33 (0.006 с.) |

 , где λ – длина волны собственных волновых колебаний частицы, h –постоянная Планка, v – скорость и m –масса частицы.
, где λ – длина волны собственных волновых колебаний частицы, h –постоянная Планка, v – скорость и m –масса частицы.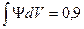 . Орбиталь имеет какую-то ограниченную поверхность, поэтому говорят о типе (виде) орбитали, ее форме и т.п.
. Орбиталь имеет какую-то ограниченную поверхность, поэтому говорят о типе (виде) орбитали, ее форме и т.п.


