
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взаимодействие тел. Первый закон Ньютона. Инерциальные системы отсчета.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Билет № 1 Взаимодействие тел. Первый закон Ньютона. Инерциальные системы отсчета.
Билет № 2 Сила. Масса. Второй закон Ньютона. Простые наблюдения и опыты, например с тележками (рис. 3), приводят к следующим качественным заключениям: а) тело, на которое другие тела не действуют, сохраняет свою скорость неизменной; б) ускорение тела возникает под действием других тел, но зависит и от самого тела; в) действия тел друг на друга всегда носят характер взаимодействия. Эти выводы подтверждаются при наблюдении явлений в природе, технике, космическом пространстве только в инерциальных системах отсчета. Взаимодействия отличаются друг от друга и количественно, и качественно. Например, ясно, что чем больше деформируется пружина, тем больше взаимодействие ее витков. Или, чем ближе два разноименных заряда, тем сильнее они будут притягиваться. В простейших случаях взаимодействия количественной характеристикой является сила. Сила — причина ускорения тел по отношению к инерциальной системе отсчета или их деформации. Сила — это векторная физическая величина, являющаяся мерой ускорения, приобретаемого телами при взаимодействии. Сила характеризуется: а) модулем; б) точкой приложения; в) направлением. Единица измерения силы — ньютон. 1 ньютон — это сила, которая телу массой 1 кг сообщает ускорение 1 м/с² в направлении действия этой силы, если другие тела на него не действуют. Равнодействующей нескольких сил называют силу, действие которой эквивалентно действию тех сил, которые она заменяет. Равнодействующая является векторной суммой всех сил, приложенных к телу. FР=F1+F2+...+Fn,. (вектора!)
Масса тела – мера его инертности. Свойство инертности присуще всем телам, состоит в том, что для изменения скорости тела требуется некоторое время (из двух взаимодействующих тел то тело более инертно, которое медленнее изменяет свою скорость, следовательно его масса будет больше) Для двух тел: отношение модулей ускорений равно обратному отношению их масс Билет № 3 Билет № 4 Третий закон Ньютона. Принцип относительности Галилея.
Билет № 5 Билет № 6 Билет № 7 Взаимодействие точечных зарядов. Закон Кулона.
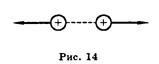
Законы взаимодействия неподвижных электрических зарядов изучает электростатика. Основной закон электростатики был экспериментально установлен французским физиком Шарлем Кулоном и читается так. Модуль силы взаимодействия двух точечных неподвижных электрических зарядов в вакууме прямо пропорционален произведению величин этих зарядов и обратно пропорционален квадрату расстояния между ними. F = k • q1q2/r2, где q1 и q2 — модули зарядов, r — расстояние между ними, k — коэффициент пропорциональности, зависящий от выбора системы единиц, в СИ k = 9 • 109 Н • м2/Кл2. Величина, показывающая во сколько раз сила взаимодействия зарядов в вакууме больше, чем в среде, называется диэлектрической проницаемостью среды ε. Для среды с диэлектрической проницаемостью ε закон Кулона записывается следующим образом: F= k • q1q2/(ε•r2) Вместо коэффициента k часто используется коэффициент, называемый электрической постоянной ε0. Электрическая постоянная связана с коэффициентом k следующим образом k = 1/4π ε0 и численно равна ε0 =8,85 • 10-12 Кл/Н • м2. С использованием электрической постоянной закон Кулона имеет вид:F=(1/4π ε0 )• (q1q2 /r2) Взаимодействие неподвижных электрических зарядов называют электростатическим, или кулоновским, взаимодействием. Кулоновские силы можно изобразить графически (рис. 14, 15).
Кулоновская сила направлена вдоль прямой, соединяющей заряженные тела. Она является силой притяжения при разных знаках зарядов и силой отталкивания при одинаковых знаках. Билет № 8 Билет № 10 Билет № 11 Билет № 12 Билет № 14 1. Квантовые постулаты Бора. Излучение и поглощение света атомом. Это означает, что электрон (например, в атоме водорода) может находиться на нескольких вполне определенных орбитах. Каждой орбите электрона соответствует вполне определенная энергия. Второй постулат: при переходе из одного стационарного состояния в другое испускается или поглощается квант электромагнитного излучения. Энергия фотона равна разности энергий атома в двух состояниях: hv = Еm – Εn; h = 6,62 • 10-34 Дж • с, где h — постоянная Планка. При переходе электрона с ближней орбиты на более удаленную, атомная система поглощает квант энергии. При переходе с более удаленной орбиты электрона на ближнюю орбиту по отношению к ядру атомная система излучает квант энергии. Теория Бора позволила объяснить существование линейчатых спектров. Спектр излучения (или поглощения) — это набор волн определенных частот, которые излучает (или поглощает) атом данного вещества. Спектры бывают сплошные, линейчатые и полосатые. Сплошные спектры излучают все вещества, находящиеся в твердом или жидком состоянии. Сплошной спектр содержит волны всех частот видимого света и поэтому выглядит как цветная полоса с плавным переходом от одного цвета к другому в таком порядке: Красный, Оранжевый, Желтый, Зеленый, Синий и Фиолетовый (Каждый Охотник Желает Знать, где Сидит Фазан). Линейчатые спектры излучают все вещества в атомарном состоянии. Атомы всех веществ излучают свойственные только им наборы волн вполне определенных частот. Как у каждого человека свои личные отпечатки пальцев, так и у атома данного вещества свой, характерный только ему спектр. Линейчатые спектры излучения выглядят как цветные линии, разделенные промежутками. Природа линейчатых спектров объясняется тем, что у атомов конкретного вещества существуют только ему свойственные стационарные состояния со своей характерной энергией, а следовательно, и свой набор пар энергетических уровней, которые может менять атом, т. е. электрон в атоме может переходить только с одних определенных орбит на другие, вполне определенные орбиты для данного химического вещества. Полосатые спектры излучаются молекулами. Выглядят полосатые спектры подобно линейчатым, только вместо отдельных линий наблюдаются отдельные серии линий, воспринимаемые как отдельные полосы. Характерным является то, что какой спектр излучается данными атомами, такой же и поглощается, т. е. спектры излучения по набору излучаемых частот совпадают со спектрами поглощения. Поскольку атомам разных веществ соответствуют свойственные только им спектры, то существует способ определения химического состава вещества методом изучения его спектров. Этот способ называется спектральным анализом. Спектральный анализ применяется для определения химического состава ископаемых руд при добыче полезных ископаемых, для определения химического состава звезд, атмосфер, планет; является основным методом контроля состава вещества в металлургии и машиностроении.
Билет № 15 1. Электрический ток в газах. Самостоятельный и несамостоятельный разряды. Плазма. Плазма - это четвертое агрегатное состояние вещества с высокой степенью ионизации за счет столкновения молекул на большой скорости при высокой температуре; встречается в природе: ионосфера - слабо ионизированная плазма, Солнце - полностью ионизированная плазма; искусственная плазма - в газоразрядных лампах.
Плазма бывает: Низкотемпературная - при температурах меньше 100 000К; высокотемпературная - при температурах больше 100 000К. Основные свойства плазмы: - высокая электропроводность - сильное взаимодействие с внешними электрическими и магнитными полями. При температуре любое вещество находится в состоянии плазмы. Интересно, что 99% вещества во Вселенной - плазма. Билет № 16 1. Идеальный газ. Изотермический, изобарный и изохорный процессы в идеальном газе. Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа. Идеальным принято считать газ, если: а) между молекулами отсутствуют силы притяжения, т. е. молекулы ведут себя как абсолютно упругие тела; б) газ очень разряжен, т. е. расстояние между молекулами намного больше размеров самих молекул; в) тепловое равновесие по всему объему достигается мгновенно. Условия, необходимые для того, чтобы реальный газ обрел свойства идеального, осуществляются при соответствующем разряжении реального газа. Некоторые газы даже при комнатной температуре и атмосферном давлении слабо отличаются от идеальных. Основными параметрами идеального газа являются давление, объем и температура.Состояние данной массы полностью определено, если известны давление, температура и объем газа. Эти величины называют параметрами состояния газа. Уравнение, связывающее параметры состояния, называют уравнением состояния. Для произвольной массы газа единичное состояние газа описывается уравнением Менделеева— Клапейрона: pV = mRT/M, где р — давление, V — объем, т — масса, М — молярная масса, R — универсальная газовая постоянная. Физический смысл универсальной газовой постоянной в том, что она показывает, какую работу совершает один моль идеального газа при изобарном расширении при нагревании на 1 К (R = 8,31 Дж/моль • К). Уравнение Менделеева—Клапейрона показывает, что возможно одновременно изменение пяти параметров, характеризующих состояние идеального газа. Однако многие процессы в газах, происходящие в природе и осуществляемые в технике, можно рассматривать приближенно как процессы, в которых изменяются лишь два параметра из пяти. Особую роль в физике и технике играют три процесса: изотермический, изохорический и изобарный. Изопроцессом называют процесс, происходящий с данной массой газа при одном постоянном параметре — температуре, давлении или объеме. Из уравнения состояния как частные случаи получаются законы для изопроцессов. Изотермическим называют процесс, протекающий при постоянной температуре. Т = const. Он описывается законом Бойля-Мариотта. pV = const. Изохорным называют процесс, протекающий при постоянном объеме. Для него справедлив закон Шарля. V = const. p/T = const.
рис.11
Реальные газы удовлетворяют уравнению состояния идеального газа при не слишком высоких давлениях (пока собственный объем молекул пренебрежительно мал по сравнению с объемом сосуда, в котором находится газ) и при не слишком низких температурах (пока потенциальной энергией межмолекулярного взаимодействия можно пренебречь по сравнению с кинетической энергией теплового движения молекул), т. е. для реального газа это уравнение и его следствия являются хорошим приближением. Билет № 17
Билет № 18 1. Внутренняя энергия. Количество теплоты. Работа в термодинамике. Первый закон термодинамики. Внутренняя энергия тела может изменяться только в результате его взаимодействия с другими телами. Существуют два способа изменения внутренней энергии: теплопередача и совершение механической работы (например, нагревание при трении или при сжатии, охлаждение при расширении). Теплопередача — это изменение внутренней энергии без совершения работы: энергия передается от более нагретых тел к менее нагретым. Теплопередача бывает трех видов: теплопроводность (непосредственный обмен энергией между хаотически движущимися частицами взаимодействующих тел или частей одного и того же тела); конвекция (перенос энергии потоками жидкости или газа) и излучение (перенос энергии электромагнитными волнами). Мерой переданной энергии при теплопередаче является количество теплоты (Q). Эти способы количественно объединены в закон сохранения энергии, который для тепловых процессов читается так. Изменение внутренней энергии замкнутой системы равно сумме количества теплоты, переданной системе, и работы, внешних сил, совершенной над системой. U= Q + А, где U— изменение внутренней энергии, Q — количество теплоты, переданной системе, А — работа внешних сил. Если система сама совершает работу, то ее условно обозначают А'. Тогда закон сохранения энергии для тепловых процессов, который называется первым законом термодинамики, можно записать так: Q = Α' + U, т. е. количество теплоты, переданное системе, идет на совершение системой работы и изменение ее внутренней энергии. При изобарном нагревании газ совершает работу над внешними силами Α' = p(V1-V2) = pΔV, где V1, и V2 — начальный и конечный объем газа. Если процесс не является изобарным, величина работы может быть определена площадью фигуры, заключенной между линией, выражающей зависимость p(V) и начальным и конечным объемом газа (рис. 13). Рассмотрим применение первого закона термодинамики к изопроцессам, происходящим с идеальным газом.
В изотермическом процессе температура постоянная, следовательно, внутренняя энергия не меняется. Тогда уравнение первого закона термодинамики примет вид: Q = А', т. е. количество теплоты, переданное системе, идет на совершение работы при изотермическом расширении, именно поэтому температура не изменяется. В изобарном процессе газ расширяется и количество теплоты, переданное газу, идет на увеличение его внутренней энергии и на совершение им работы: Q = U + А'. При изохорном процессе газ не меняет своего объема, следовательно, работа им не совершается, т. е., А = О, и уравнение первого закона имеет вид: Q = U, т. е. переданное количество теплоты идет на увеличение внутренней энергии газа. Адиабатным называют процесс, протекающий без теплообмена с окружающей средой. Q = 0, следовательно, газ при расширении совершает работу за счет уменьшения его внутренней энергии, следовательно, газ охлаждается, Α' = U. Кривая, изображающая адиабатный процесс, называется адиабатой.
Билет № 19 1. Фотоэлектрический эффект. Экспериментальные законы внешнего фотоэффекта. Уравнение Эйнштейна для фотоэлектрического эффекта. В 1900 г. немецкий физик Макс Планк высказал гипотезу: свет излучается и поглощается отдельными порциями — квантами (или фотонами). Энергия каждого фотона определяется формулой Е = h ν, где h — постоянная Планка, равная 6,63 • 10-34 Дж • с, ν — частота света. Гипотеза Планка объяснила многие явления: в частности, явление фотоэффекта, открытого в 1887 г. немецким ученым Генрихом Герцем и изученного экспериментально русским ученым А. Г. Столетовым. Фотоэффект — это явление испускания электронов веществом под действием света. В результате исследований были установлены три закона фотоэффекта. 1. Сила тока насыщения прямо пропорциональна интенсивности светового излучения, падающего на поверхность тела. 2. Максимальная кинетическая энергия фотоэлектронов линейно возрастает с частотой света и зависит от его интенсивности. 3. Если частота света меньше некоторой определенной для данного вещества минимальной частоты, то фотоэффект не происходит.
Зависимость фототока от напряжения показана на рисунке 36. Теорию фотоэффекта создал немецкий ученый А. Эйнштейн в 1905 г. В основе теории Эйнштейна лежит понятие работы выхода электронов из металла и понятие о квантовом излучении света. По теории Эйнштейна фотоэффект имеет следующее объяснение: поглощая квант света, электрон приобретает энергию hv. При вылете из металла энергия каждого электрона уменьшается на определенную величину, которую называют работой выхода (Авых). Работа выхода — это работа, которую необходимо затратить, чтобы удалить электрон из металла. Максимальная энергия электронов после вылета (если нет других потерь) имеет вид: mv2/2 = hv — Авых, Это уравнение носит название уравнения Эйнштейна. Если hν < Авых то фотоэффект не происходит. Значит, красная граница фотоэффекта равна νmin = Авых/h Приборы, в основе принципа действия которых лежит явление фотоэффекта, называют фотоэлементами. Простейшим таким прибором является вакуумный фотоэлемент. Недостатками такого фотоэлемента являются: слабый ток, малая чувствительность к длинноволновому излучению, сложность в изготовлении, невозможность использования в цепях переменного тока. Применяется в фотометрии для измерения силы света, яркости, освещенности, в кино для воспроизведения звука, в фототелеграфах и фототелефонах, в управлении производственными процессами. Существуют полупроводниковые фотоэлементы, в которых под действием света происходит изменение концентрации носителей тока.Они используются при автоматическом управлении электрическими цепями (например, в турникетах метро), в цепях переменного тока, в качестве невозобновляемых источников тока в часах, микрокалькуляторах, проходят испытания первые солнечные автомобили, используются в солнечных батареях на искусственных спутниках Земли, межпланетных и орбитальных автоматических станциях. С явлением фотоэффекта связаны фотохимические процессы, протекающие под действием света в фотографических материалах.
Билет № 20 1. Принцип действия тепловых машин. Тепловые двигатели. Коэффициент полезного действия тепловых двигателей.
Это площадь фигуры под графиком в системе координат (р,V). За один замкнутый цикл полезная работа будет численно равна площади фигуры, ограничивающей заданный цикл. Чем больше будет площадь этой фигуры, тем больше будет полезная работа. Что же затрачивается в этом случае? Это количество теплоты, полученное газом от нагревателя Qн. Тогда коэффициент полезного действия будет равен:
Для реальных тепловых двигателей коэффициент полезного действия равен из-за разного рода энергетических потерь приблизительно равен 40%, Максимальный КПД - около 44%-имеет двигатели внутреннего сгорания. Можно ли повысить коэффициент полезного действия? Из-за того, что часть теплоты при работе тепловых двигателей неизбежно передается холодильнику, КПД не может равняться единице. Чему же может быть равен максимально возможный КПД теплового двигателя с температурой нагревателя Т1 и температурой холодильника Т2? Ответ на этот вопрос дал французский инженер и ученый Сади Карно. (презентация о С. Карно). Им была предложена тепловая машина, в которой осуществляется замкнутый цикл, состоящий из двух изотерм и двух адиабат, проводимый с идеальным газом. Сначала газ расширяется изотермически при температуре Т1, получая при этом от нагревателя количество теплоты Q1. Затем он расширяется адиабатно и не обменивается теплотой с окружающими телами. Далее следует изотермическое сжатие газа при температуре Т2. Газ отдает при этом процессе холодильнику количество теплоты Q2. Далее газ сжимается адиабатно и возвращается в исходное состояние. Работа, совершаемая газом, численно равна площади фигуры, ограниченной кривой цикла. Коэффициент полезного действия идеальной тепловой машины:
Эта формула дает теоретический предел для максимального значения коэффициента полезного действия тепловых двигателей. Она показывает, что тепловой двигатель тем эффективнее, чем выше температура нагревателя и ниже температура холодильника. Лишь при температуре холодильника, равной абсолютному нулю, КПД будет равен 1. Температура холодильника практически не может быть намного ниже температуры окружающего воздуха. Повышение температуры нагревателя ограничивается теплостойкостью и жаропрочностью материалов, из которых изготавливают цилиндры и поршни двигателей. Пути повышения КПД инженеры видят в уменьшении трения в частях двигателей и потерь топлива вследствие его неполного сгорания. Непрерывное развитие энергетики, автомобильного и других видов транспорта, возрастание потребления угля, нефти и газа в промышленности и на бытовые нужды увеличивает возможности удовлетворения жизненных потребностей человека. Однако в настоящее время количество ежегодно сжигаемого в различных тепловых машинах химического топлива настолько велико, что все более сложной проблемой становится охрана окружающей среды от вредного влияния продуктов сгорания. Основные проблемы, связанные с использованием тепловых машин:
Проблемы, связанные с использованием тепловых двигателей, являются глобальными для всей планеты. Для их решения необходимо проводить ряд мероприятий по охране окружающей среды. Необходимо повышать эффективность сооружений, препятствующих выбросу в атмосферу вредных веществ; добиваться более полного сгорания топлива в автомобильных двигателях. Уже сейчас не допускаются к эксплуатации автомобили с повышенным содержанием СО в отработанных газах. Осуществляется перевод автомобилей на сжиженный газ в качестве топлива, а для бензиновых двигателей разрабатывается переход на топливо стандарта «Евро 4» и «Евро 5». Обсуждается возможность использования в качестве топлива водорода, в результате сгорания которого образуется вода. В настоящее время практически все мировые автопроизводители разработали машины с электрическими двигателями, которые возможно в будущем заменят тепловые двигатели.
Билет № 21 1. Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа. Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа. Идеальным принято считать газ, если: а) между молекулами отсутствуют силы притяжения, т. е. молекулы ведут себя как абсолютно упругие тела; б) газ очень разряжен, т. е. расстояние между молекулами намного больше размеров самих молекул; в) тепловое равновесие по всему объему достигается мгновенно. Условия, необходимые для того, чтобы реальный газ обрел свойства идеального, осуществляются при соответствующем разряжении реального газа. Некоторые газы даже при комнатной температуре и атмосферном давлении слабо отличаются от идеальных. Основными параметрами идеального газа являются давление, объем и температура.
Одним из первых и важных успехов МКТ было качественное и количественное объяснение давления газа на стенки сосуда. Качественное объяснение заключается в том, что молекулы газа при столкновениях со стенками сосуда взаимодействуют с ними по законам механики как упругие тела и передают свои импульсы стенкам сосуда. На основании использования основных положений молекулярно-кинетической теории было получено основное уравнение МКТ идеального газа, которое выглядит так: р = 1/3 т0пv2. Здесь р — давление идеального газа, m0 — масса молекулы, п — концентрация молекул, v 2 — средний квадрат скорости молекул. Обозначив среднее значение кинетической энергии поступательного движения молекул идеального газа Еk получим основное уравнение МКТ идеального газа в виде: р = 2/3nЕk. Однако, измерив только давление газа, невозможно узнать ни среднее значение кинетической энергии молекул в отдельности, ни их концентрацию. Следовательно, для нахождения микроскопических параметров газа нужно измерение какой-то еще физической величины, связанной со средней кинетической энергией молекул. Такой величиной в физике является температура. Температура — скалярная физическая величина, описывающая состояние термодинамического равновесия (состояния, при котором не происходит изменения микроскопических параметров). Как термодинамическая величина температура характеризует тепловое состояние системы и измеряется степенью его отклонения от принятого за нулевое, как молекулярно-кинетическая величина характеризует интенсивность хаотического движения молекул и измеряется их средней кинетической энергией.
Ek = 3/2 kT, где k = 1,38 • 10-23 Дж/К и называется постоянной Больцмана. Температура всех частей изолированной системы, находящейся в равновесии, одинакова. Измеряется температура термометрами в градусах различных температурных шкал. Существует абсолютная термодинамическая шкала (шкала Кельвина) и различные эмпирические шкалы, которые отличаются начальными точками. До введения абсолютной шкалы температур в практике широкое распространение получила шкала Цельсия (за О °С принята точка замерзания воды, за 100 °С принята точка кипения воды при нормальном атмосферном давлении). Единица температуры по абсолютной шкале называется Кельвином и выбрана равной одному градусу по шкале Цельсия 1 К = 1 °С. В шкале Кельвина за ноль принят абсолютный ноль температур, т. е. температура, при которой давление идеального газа при постоянном объеме равно нулю. Вычисления дают результат, что абсолютный ноль температуры равен -273 °С. Таким образом, между абсолютной шкалой температур и шкалой Цельсия существует связь Т = t °С + 273. Абсолютный ноль температур недостижим, так как любое охлаждение основано на испарении молекул с поверхности, а при приближении к абсолютному нулю скорость поступательного движения молекул настолько замедляется, что испарение практически прекращается. Теоретически при абсолютном нуле скорость поступательного движения молекул равна нулю, т. е. прекращается тепловое движение молекул. Билет № 22 1. Радиоактивность. Закон радиоактивного распада. Состав радиоактивного излучения был изучен Резерфордом и супругами Кюри с помощью установки, показанной на рис. 38а. Кусочек радия Р помещали на дно узкого канала в свинцовом цилиндре С. Выходивший из канала радиоактивный луч проходил через сильное магнитное поле с индукцией Исследования показали, что α-лучи – это поток ядер гелия, β-лучи – поток электронов, а γ-лучи – электромагнитное излучение с очень малой длиной волны λ < 10–10 м. Их этих трёх видов излучения наибольшей проникающей способностью обладают γ-лучи, интенсивность которых ослабляется всего лишь в два раза при прохождении через слой свинца толщиной в 1 см. β-лучи обладают меньшей проникающей способностью, и их можно задержать алюминиевой пластинкой толщиной в 5-10 мм. Самой маленькой проникающей способностью обладают α-лучи, не проникающие даже через лист бумаги. Распад ядра X, в результате которого оно превращается в ядро Y, испуская при этом α-частицу, называют α-распадом. Уравнение a-распада, следующее из законов сохранения электрического заряда и общего числа нуклонов, имеет вид:
Из (38.1) следует, что при α-распаде образуется ядро химического элемента, порядковый номер которого меньше на две единицы. Это утверждение называют правилом смещения для α-распада. Распад ядра X, при котором оно, превращаясь в ядро Y, испускает электрон (b-частицу), а один из нейтронов, входящих в состав ядра, превращается в протон, называют b-распадом. Уравнение b-распада, следующее из законов сохранения заряда и общего числа нуклонов, имеет вид:
Из (38.2) следует, что при b-распаде образуется ядро химического элемента, порядковый номер которого больше на единицу. Это утверждение называют правилом смещения для b-распада.
где N0 – число радиоактивных ядер в момент t = 0. Зависимость (38.3) изображена на рис. 38б.
Рис. 38. (а) – схема установки для обнаружения a-, b- и g-лучей в радиоактивном излучении; (б) – закон радиоактивного распада Билет № 23 1. Электрический ток в электролитах. Законы электролиза. Билет № 24 Билет № 25 1. Ядерные реакции. Цепные ядерные реакции. Ядерный реактор. Ядерными реакциями называют превращения атомных ядер при взаимодействии их между собой, с элементарными частицами (например, протонами, нейтронами или электронами) и квантами g-излучения. Для ядерной реакции необходимо, чтобы участвующие в ней ядра или частицы подошли друг к другу на расстояние, сравнимое с размером ядра (10-15 м). Нейтроны, даже не обладая большой скоростью, могут подойти к самому ядру, т.к. они электронейтральны. Наоборот, положительно заряженные частицы должны изначально обладать большой кинетической энергией, чтобы оказаться так близко к положительно заряженному ядру. Источниками таких высокоэнергетичных частиц могут быть радиоактивные препараты и ускорители заряженных частиц. В лабораторных условиях ядерная реакция впервые была проведена Резерфордом, когда он бомбардировал ядра азота a-частицами, в результате чего эти ядра превращались в ядра кислорода, что можно записать в виде:
Ядерные реакции могут происходить как с поглощением, так и с выделением энергии. Энергию, освобождающуюся или поглощаемую при ядерной реакции, называют энергетическим выходом ядерной реакции. Согласно закону сохранения энергии и теории относительности, устанавливающей связь между массой покоящегося ядра и его энергией, энергетический выход DЕ ядерной реакции равен: DЕ = Dmc2, (39.1) где Dm – разность между суммарной массой частиц и ядер, вступающих в реакцию и продуктов реакции. Если Dm >0, то ядерная реакция проходит с выделением энергии, а если Dm <0, то - с поглощением. Примером ядерной реакции, идущей с выделением энергии, является деление ядер изотопа урана
|
||||
|
Последнее изменение этой страницы: 2016-06-22; просмотров: 472; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.144.50 (0.019 с.) |




 Второй закон Ньютона: Ускорение, с которым движется тело, прямо пропорционально равнодействующей всех сил, действующих на тело, обратно пропорционально его массе и направлено так же, как и равнодействующая сила: а = F/m.
Второй закон Ньютона: Ускорение, с которым движется тело, прямо пропорционально равнодействующей всех сил, действующих на тело, обратно пропорционально его массе и направлено так же, как и равнодействующая сила: а = F/m.








 Изобарным называют процесс, протекающий при постоянном давлении. Уравнение этого процесса имеет вид V/T == const при р = const и называется законом Гей-Люссака. Все процессы можно изобразить графически (рис. 11).
Изобарным называют процесс, протекающий при постоянном давлении. Уравнение этого процесса имеет вид V/T == const при р = const и называется законом Гей-Люссака. Все процессы можно изобразить графически (рис. 11).







 ;
;  .
.

 , перпендикулярной этому лучу, а потом падал на фотопластинку Ф. В магнитном поле излучение распадалось на три луча, которые приводили к появлению трёх пятен на фотопластинке, причём положение среднего пятна совпадало с тем, которое наблюдали в отсутствии магнитного поля (рис. 38а). Расщепление излучения означало, что оно является потоком разноимённо заряженных частиц, на которые сила Лоренца действует в разные стороны. Поток положительно заряженных частиц был назван a-лучами, а поток отрицательных – b-лучами. Излучение, не отклоняющееся в магнитном поле, было названо g-лучами.
, перпендикулярной этому лучу, а потом падал на фотопластинку Ф. В магнитном поле излучение распадалось на три луча, которые приводили к появлению трёх пятен на фотопластинке, причём положение среднего пятна совпадало с тем, которое наблюдали в отсутствии магнитного поля (рис. 38а). Расщепление излучения означало, что оно является потоком разноимённо заряженных частиц, на которые сила Лоренца действует в разные стороны. Поток положительно заряженных частиц был назван a-лучами, а поток отрицательных – b-лучами. Излучение, не отклоняющееся в магнитном поле, было названо g-лучами.

 Радиоактивный распад отдельного ядра является совершенно случайным событием. Однако для каждого изотопа радиоактивного элемента существует определённый интервал времени T, в течение которого число радиоактивных ядер в среднем уменьшается вдвое. Этот интервал времени называют периодом полураспада, T. Например, период полураспада для α-распада
Радиоактивный распад отдельного ядра является совершенно случайным событием. Однако для каждого изотопа радиоактивного элемента существует определённый интервал времени T, в течение которого число радиоактивных ядер в среднем уменьшается вдвое. Этот интервал времени называют периодом полураспада, T. Например, период полураспада для α-распада  равен 4,5×109 лет, а для b-распада
равен 4,5×109 лет, а для b-распада  – 5700 лет. Закон, по которому убывает со временем t число N радиоактивных ядер данного изотопа, называют законом радиоактивного распада. Этот закон, который легко вывести, имеет следующий вид:
– 5700 лет. Закон, по которому убывает со временем t число N радиоактивных ядер данного изотопа, называют законом радиоактивного распада. Этот закон, который легко вывести, имеет следующий вид:


 .
. при облучении их «медленными» нейтронами, т.е. с кинетической энергией порядка 0,1 МэВ. Такую ядерную реакцию с образованием
при облучении их «медленными» нейтронами, т.е. с кинетической энергией порядка 0,1 МэВ. Такую ядерную реакцию с образованием 


