
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные технологические понятия: производительность, интенсивность, расходные коэффициенты, конверсия, селективность, выход. Химический процесс. Технологический режим.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Вопрос №1 Содержание, особенности и тенденции развития химической технологии. Химико-технологические системы (ХТС). Иерархия химического производства. Технология – наука, изучающая способы и процессы переработки сырья в предметы потребления и средства производства. Способ переработки – это совокупность всех операц ий, которые проходит сырье до получения из него продукта. Химическая технология изучает процессы, сопровождающиеся изменением энергии, химического состава и внутренней структуры вещества. Пример: синтез аммиака из азота и водорода. Химическая технология изучает совокупность физических и химических процессов, пути их осуществления в промышленном производстве, их экономическую целесообразность. Все процессы хим. тех. можно свести к пяти основным процессам: гидродинамические, тепловые, массообменные, механические, химические. Особенности: 1.Массовый характер производства, многостадийность и неразрывность технологических процессов. 2. Вредное воздействие химического комплекса на окр. среду. 3. Быстрые темпы развития. Главные тенденции технического прогресса химической промышленности на ближайшие годы: 1) Продолжение перехода на агрегаты более крупной единичной мощности там, где не достигнут оптимум. 2) Реконструкция и модернизация химических производств с внедрением энергосберегающих, ресурсосберегающих и более экологически чистых технологий. 3)Повышение селективности процессов. 4)Концентрация, специализация и комбинирование производства. 5) Экономия сырья и его комплексное использование. 6) Повышение качества химической продукции. 7) Внедрение технологических операций, интенсифицирующих процесс или экономящих энергию. Система – сложный объект, состоящий из взаимосвязанных и взаимодействующих между собой и с внешней средой элементов или подсистем. Элемент – самостоятельная и условно неделимая единица. В ХТ это чаще всего аппарат, в котором протекает какой-либо типовой процесс. Подсистема – группа элементов (агрегат),обладающая определенной целостностью и целенаправленностью. Это самостоятельно функционирующая часть системы. Химико-технологическая система – это совокупность физико-химических процессов, происходящих в системе и средств для их реализации. ХТС включает в себя: химический процесс, протекающий в системе; аппараты, в которых этот процесс протекает; средства контроля и управления процессом; связи между элементами системы. Любое химическое производство представляет последовательность 4 основных стадий: подготовка сырья, собственно хим превращение, выделение целевого продукта, его очистка. Эти операции реализуются в виде единой сложной ХТС. ХТС, соответствующие хим производствам, обладают характерными признаками: 1- существование общей цели функционирования – выпуск продукции 2- большие размеры системы – велико число элементов, входящих в систему, число связей между ними 3- большое число параметров, характеризующих работу системы 4- сложность поведения системы – изменение режима в одном аппарате может влиять на работу всего производства 5- высокая степень автоматизации процессов управления производством 6- необходимость создания потоков осведомительной и управляющей информации между элементами ХТС и управляющими устройствами. Иерархия химического производства см. рис.
I. Типовой химико-технологический процесс – это отдельная единица 1ой ступени иерархической структуры химического производства, т.е. низшая ступень этой структуры. К типовым процессам хим. технологии относятся: гидродинамические, тепловые, диффузионные, химические, биохимические, механические, а так же локальные системы управления ими, в основном САР. II. На второй ступени испол. систем автоматизированного управления для решения задач оптимальной координации работы аппаратов и оптимального распределения потоков между ними (АСУТП). III. Третья ступень иерархии включает химические производства, состоящие из нескольких цехов, где получают целевые продукты, а так же АСУ технологического и организационного функционирования производства. IV. Химии. предприятие в целом и АСУП. Между уровнями сущ. отношения соподчиненности. Вопрос №2 Вопрос №3 Проблема выбора. Проблема выбора сырьевой базы Тяжелого Органического Синтеза в целом на долговременную перспективу чрезвычайно актуальна. Потенциальные источники орг сырья: нефть, прир и попутный нефтяной газ, уголь и горючие сланцы, биомасса растительного происхождения. Основополагающими критериями выбора сырья являются ресурсы сырья данного вида, обеспечивающие надежные поставки для ТОС, потребности промышленности в данном виде сырья и его стоимость. + мировые тенденции в эволюции сырьевой базы и существующих технологий, количества и ассортимента продукции ТОС, а также экологические проблемы. Выбор сырья должен базироваться на системном подходе, обеспечивающем взаимосвязанное решение целого комплекса задач. Вопрос №4 Энергопотребление в химической технологии. Энергосберегающие технологии в химическом производстве. Вторичные энергетические ресурсы (ВЭР). Коэффициент использования энергии. Тепловой КПД процесса. Энерготехнологические схемы. Химическая промышленность – крупный потребитель различных видов энергии. Структура потребления энергии в хим промышленности в РФ характеризуется след данными, в %: - электрическая, 33,4 -тепловая(пар и горячая вода),52,9 -топливо прямого использования,13,7. В структуре себестоимости некоторых видов хим продукции энергозатраты имеют сущечственный удельный вес, в %: -в производстве аммиака, 53 -в производстве метанола,31 -в производстве этилена из бензина,44. Основные принципы энергосберегающей технологии в химических производствах можно сгруппировать в три позиции: 1. Совершенствование технологий: а) выбор оптимального сырья становится существенным элементом энергосберегающей технологии; б) использование энергосберегающих катализаторов. 2. Улучшение использования энергии. Сюда относится как повышение КПД технологических печей, пароперегревателей, парогенераторов, так и использование на химических и нефтехимических предприятиях других теплоносителей. 3.Организация энергосберегающей политики. ВЭР – это энергетический потенциал продукции, отходов, побочных и промежуточных продуктов, образующихся в технологической установке, который может быть частично или полностью использован для энергоснабжения других потребителей. ВЭР подразделяют на три вида: горючие, тепловые и механические. Критерием экономического использования служит коэффициент использования энергии nэ - это отношение количества энергии, которое теоретически требуется затратить на получение массовой единицы продукта Wt, к количеству практически затраченной энергии Wпр: Наиболее перспективным направлением в деле экономии энергии и повышении КПД ее использования в отрасли является создание энерго-технологических установок, способных выдавать тепловую энергию в виде пара на сторону. Это дает значительный экономический эффект. Организация энергосберегающей политики подразумевает: -создание энерго-технологических схем -учет всех видов энергии на установке -поддержание эффективности работы оборудования(чистота, герметичность,исправность) -Уменьшение до минимума коэффициента избытка воздуха в печах и количества газов, сбрасываемых на факел -поддержание оптимального режима работы.
Вопрос №5 Роль воды в химической технологии. Временная и постоянная жесткость. Подготовка воды. Вода широко используется в химической промышленности. В одних случаях она служит сырьём и реагентом, непосредственно участвующим в химических реакциях, в других – применяется как растворитель, теплоноситель, охлаждающий агент, в третьих – для целого ряда других физических операций – промывка твердых материалов и т.п. Жесткость – это свойство воды, обусловленное присутствием в ней солей кальция и магния. Различают временную и постоянную жесткость. Временная жесткость вызывается присутствием в воде растворимых бикарбонатов кальция и магния Ca(HCO3)2 и Mg(HCO3)2. При кипячении воды эти соли разлагаются, и из раствора выпадает осадок – карбонат кальция или магния. Ca(HCO3)2 = CaCO3+ H2O + CO2. Постоянная жесткость вызывается присутствием в воде хлоридов, сульфатов и нитратов кальция или магния. При кипячении воды эти соли не удаляются. Подготовка воды. В зависимости от предъявляемых требований к промышленным водам проводится процесс водоподготовки, состоящий из нескольких операций. 1. Осветление воды. От взвешенных примесей воду очищают отстаиванием или фильтрацией – обычно через слой песка, гравия и т.п. Для осаждения коллоидных примесей в отстойники вводят коагулянты. 2. Обеззараживание воды. Удаление из неё микроорганизмов и бактерий путем хлорирования или озонирования. Происходит это за счет образующегося атомарного кислорода, обладающим сильными окислительными свойствами, позволяющими убить микроорганизмы. 3. Умягчение воды. Состоит в полном или частичном удалении из неё солей магния и кальция. Это основной процесс подготовки воды. Способы умягчения воды бывают: физические и физико-химические. 4. Дегазация – удаление из воды растворенных в ней вредных газов (сероводорода, диоксидов серы и углерода и т.п.), способных вызвать коррозию аппаратуры.
Вопрос №6 Вопрос №7 Вопрос №8 Подготовка сырья для производства водорода парокислородовоздушной конверсией легких углеводородов: «сухие» методы очистки от сернистых соединений. Стадией подготовки сырья для производства водорода и азотоводородной смеси является обессеривание сырья – удаление газообразных сернистых соединений, поскольку они являются сильными каталитическими ядами. Обычно газ, поступающий на установки по производству водорода,до этого проходит предварительную очистку и не содержит большого количества серы. Однако для проведения ряда послед процессов кол-во серы в прир газе не должно превышать 0,5 мг/м3. Очистка оксидом цинка. Большинство современных установок паровой конверсии природного газа снабжены системой очистки поглотителями на основе оксида цинка, способного реагировать помимо сероводорода со многими сернистыми соединениями: H2S + ZnO = ZnS + H2O; CS2 + 2ZnO = 2ZnS + CO2; COS + ZnO = ZnS +CO2; RSH + ZnO = ZnS + ROH. Температура очистки 350-400 оС. Адсорбент не регенерируется. Остаточное содержание серы в газе не превышает 1 мг/м3. В мировой практике для этой цели используют поглотители на основе оксида цинка, нанесенного на носитель (цемент и др.).
Вопрос №9 Термодинамические основы производства водорода каталитической конверсией углеводородных газов. Выбор условий проведения процесса. Общие требования к катализаторам химико-технологических процессов. Конверсию углеводородных газов для получения водорода ведут, применяя в качестве окислителя водяной пар или кислород. Взаимодействие метана с вод. паром, кислородом, диоксидом углерода протекает по след. Реакциям: CH4 + H2O = CO +3H2 (-206кДж); CH4 + 0,5O2 = CO + 2H2 (+35кДж); CH4 + CO2 = 2CO + 2H2 (-248кДж). Далее осуществляется конверсия оксида углерода с водяным паром по реакции: CO + H2O = CO2 +H2 (+41 кДж). Суммарно процесс конверсии метана с водяным паром протекает в поглощением тепла: CH4 +2H2O = CO2 + 4H2 (-165кДж). Выбор условий проведения процессов. Реакция окисления метана водяным паром протекает со значительной скоростью при 1350 оС. Из-за трудности ведения эндотермического при столь высоких температурах в промышленных условиях процесс паровой конверсии часто ведут на катализаторе. Увеличение соотношения CH4: H2O c 1:1 до 1:2 увеличивает конверсию метана. Процесс конверсии выгодно проводить при повышенном давлении для увеличения скорости реакции, так как при этом растет концентрация вещества в единице объёма. При повышенном давлении уменьшаются так же объёмы теплообменных и контактных аппаратов и трубопроводов, что очень важно. К катализаторам паровой конверсии легких углеводородов предъявляют жесткие требования по термоустойчивости и механической прочности. Оцениваются они по комплексу свойств: активности, прочности, гидравлическому сопротивлению, устойчивости при длительной эксплуатации и др. Хороший катализатор должен работать не менее 4-5 лет. Главной особенностью катализатора является высокая каталитическая активность. Активность никелевого катализатора уменьшается при наличии в газе сернистых соединений. Среди зарубежных кат хорошими показателями обладают кат фирмы ICI Katalco, устойчивые при температурах до 1000 С. В наст время в РФ исп кат ГИАП-3-6Н, ГИАП-8, ГИАП-16, -19 и КСН. Активность никелевого кат уменьшается при наличии в газе сернистых соединений. Итак, конверсия легких углеводородов протекает при 760-900 оС (на выходе из реактора), при повышенном (до 4 МПа) давлении в присутствии избытка водяного пара.
Вопрос №10 Конверсия оксида углерода в процессе производства водорода. Выбор условий проведения процесса. Высокотемпературные и низкотемпературные катализаторы. Сопутствующая процессам конверсии метана реакция CO + H2O = CO2 +H2 (+41 кДж) - конверсия СО водяным паром – в конверторе метана протекает частично. Эта реакция является желательной. Условия равновесия этой реакции определяются уравнениями
Вопрос №11 Вопрос №12 Очистка технологических газов от монооксида и диоксида углерода, азота, метана. Каталитическое гидрирование (метанирование). Короткоцикловая адсорбция (PSA). Каталитическое гидрирование применяется для удаления небольших количеств СО, СО2, О2, CH4 и N2 порядка долей процента, например 0,2-4 % для СО или СО2. В основе метода лежат следующие реакции: CO +3H2 = H2O + CH4; CO2 + 4H2 = 2H2O + CH4; O2 + 2H2 = 2H2O; Первые две реакции называются реакциями метанирования. Условия процесса: давление 32 МПа, температура 300-350 оС (с катализатором типа Fe) и 200 оС (с катализатором типа Ni-Cr или Ni-Al). Часто каталитическое гидрирование используется только как дополнительная или тонкая очистка, проводимая в агрегате предкатализа от CO и следов СО2. Короткоцикловая адсорбция. PSA – это короткоцикловая адсорбция получения водорода с чистотой товарного продукта 99, 5 – 99,999% об. Очистка осуществляется на молекулярных ситах при переменном давлении. Циклы адсорбции примесей и десорбции чередуются через короткие промежутки времени. В качестве материалов используются алюмосиликатные молекулярные сита. Стадия адсорбции проходит при повышенном давлении. На стадии десорбции происходит выделение примесей. Процесс PSA позволяет изменить параметры работы печи паровой конверсии, а, следовательно, снижен расход пара и улучшена энергетика установки в целом. Кроме того, отсутствует стадия поташной очистки, дающая вредные стоки и требующая периодического добавления поташа.
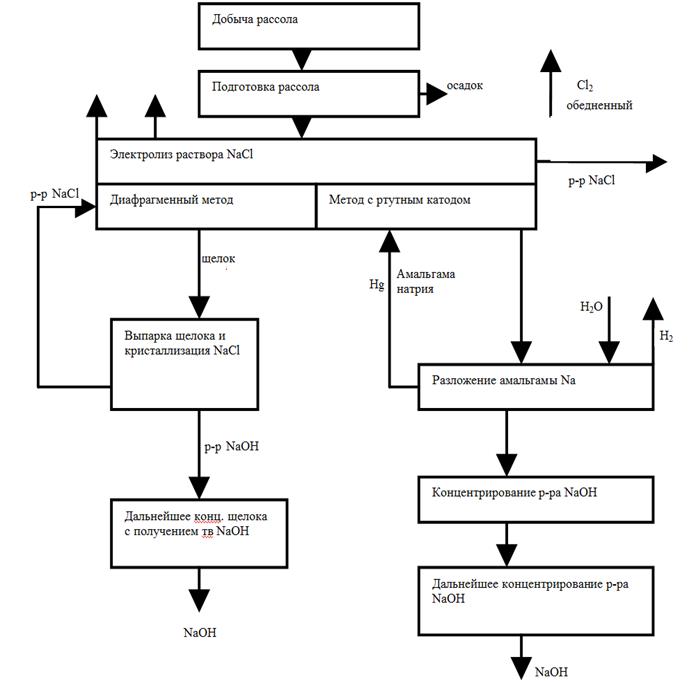
Вопрос № 13 Вопрос № 14 Вопрос № 15 Вопрос №16 Вопрос №17 Вопрос №18 Вопрос № 19 Вопрос №20 Вопрос №21 Вопрос №22 Вопрос № 24 Вопрос № 25 Вопрос №26 Вопрос № 27 Вопрос № 28 Вопрос № 29 Вопрос № 30 Производство едкого натра и хлора электрохимическим способом. Электролиз хлоридов натрия в ваннах с фильтрующей диафрагмой. Блок-схема промышленного производства едкого натра и хлора. К электрохимическим производствам относят химические процессы, протекающие в водных процессах или расплавах под действием постоянного электрического тока. Путем электролиза возможно получение химических продуктов высокой чистоты. К недостаткам электролитических процессов следует отнести высоких расход энергии при электролизе, что увеличивает себестоимость получаемых продуктов. Оценить эффективность электрохимического процесса позволяет выход по току (η
Практически в современных ваннах выход по току составляет 94-97%. При электролизе помимо основного процесса, протекает ряд побочных, также связанная с затратами энергии. Мерой эффективности использования энергии при электролизе служит коэффициент использования энергии (μ), который равен отношению количества энергии, теоретически необходимой для выделения единицы продукта (Wт), к действительно затраченной (Wпр): μ= (Wт/ Wпр)*100%; μ=(Vr/Vпр)*η где: Vт- теоретическое напряжение на электролизе, В; Vпр- практическое напряжение в ванне В. На практике всегда стремятся иметь максимальный коэффициент использования энергии. Для этого создают условия, при которых напряжение в ванне невелико, выход по току большой. Электролиз хлоридов натрия в ваннах с фильтрующей диафрагмой. Ванна с фильтрующей диафрагмой изображена на рис. 10.1. Она представляет собой цилиндрический сосуд (1), внутри которого находится асбестовая диафрагма (2) железный катод (3) в виде сетки и графитовый анод (4). В водном растворе NaCl диссоциирован на ионы Na+ и Cl-. Вода, хотя и слабо, но также диссоциирована на ионы Н+ и ОН-. При пропускании постоянного электрического тока на аноде происходит разряд ионов хлора и образуются молекулы газообразного хлора: 2С1- -2е = С12 (10.6) На катоде разряжаются ионы водорода: 2Н+ +2е = Н2 (10.7) и выделяется водород. Ионы гидроксила и натрия образуют едкий натр: Na+ + OH- = NaOH (10.8) Подготовленный раствор NaCl подается в анодное пространство (5) ванны, где при прохождении электрического тока при температуре около 800 С происходит выделение Сl2 на аноде. Раствор хлорида натрия фильтруется через диафрагму (2) водород в катодном пространстве (6) выделяется на катоде и выводится из катодного пространства. Образовавшийся NаОН вместе с неразложившейся поваренной солью стекает на дно катодного пространства и выводится из нижней части ванны. Этот раствор, называемый электролитическим щелоком, имеет Ванна с фильтрующей диафрагмой изображена на рис. 10.1. Она представляет собой цилиндрический сосуд (1), внутри которого находится асбестовая диафрагма (2) железный катод (3) в виде сетки и графитовый анод (4). В водном растворе NaCl диссоциирован на ионы Na+ и Cl-. Вода, хотя и слабо, но также диссоциирована на ионы Н+ и ОН-. При пропускании постоянного электрического тока на аноде происходит разряд ионов хлора и образуются молекулы газообразного хлора:
2С1- -2е = С12 (10.6) На катоде разряжаются ионы водорода:
2Н+ +2е = Н2 (10.7) и выделяется водород.
Ионы гидроксила и натрия образуют едкий натр: Na+ + OH- = NaOH (10.8) Подготовленный раствор NaCl подается в анодное пространство (5) ванны, где при прохождении электрического тока при температуре около 800 С происходит выделение Сl2 на аноде. Раствор хлорида натрия фильтруется через диафрагму (2) водород в катодном пространстве (6) выделяется на катоде и выводится из катодного пространства. Образовавшийся NаОН вместе с неразложившейся поваренной солью стекает на дно катодного пространства и выводится из нижней части ванны. Этот раствор, называемый электролитическим щелоком, имеет следующий состав: NaOH-110- 120 г/л, NaCl- 170-180 г/л. На переносе тока от катода к аноду наряду с ионом С1- принимает участие и ОН- -ион: он либо реагирует с растворенным в электролите хлором (Cl2) либо непосредственно разряжается на аноде, образуя кислород. Материал анода (графит) взаимодействует с кислородом в момент его выделения по реакции: C + O2 = CО2 (10.9) При этом наряду с химическим взаимодействием происходит и механическое разрушение анода. Т.о. в результате побочных процессов выход по току падает, усиливается износ анодов, увеличивается содержание О2 и СО2 в хлоре. Чтобы уменьшить участие ОН- -ионов в переносе тока и связанные с эти нежелательные процессы, устанавливают обратный поток электролита из анодного в катодное пространство через диафрагмы - фильтрующие перегородки. Диафрагма предотвращает контакт выделяющегося хлора с водородом или с одновременно образующейся щелочью. Диафрагмы в современных электролизерах изготовляются из асбестового волокна или асбестовой бумаги. Их толщина составляет 1-1,5 мм. Они непосредственно примыкают к катоду, представляющему собой перфорированный стальной лист или стальную сетку. Для увеличения нагрузки на ванну (силы питающего тока) и повышения еёпроизводительности стремятся в данном объеме ванны получить возможно более развитую поверхность катода и диафрагмы и полнее использовать поверхность анода. Это приводит к усложнению формы катода. С усложнением конфигурации катода становится затруднительным нанесение на него асбестового картона. В этом случае наносят диафрагму насасываннем её на сложную поверхность катода из суспензии (взвеси) асбестового волокна в соляном растворе. Используются также асбополимерные диафрагмы. Такого типа ванны называют ваннами с осажденной диафрагмой. Срок службы диафрагмы составляет от 0,8 до 1,4 лет.
рис. 10.1 Ванна с фильтрующей диафрагмой:
1 – цилиндрический сосуд; 2 – асбестовая диафрагма; 3 – железный катод; 4 – графитовый анод; 5 – анодное пространство; 6 – катодное пространство.
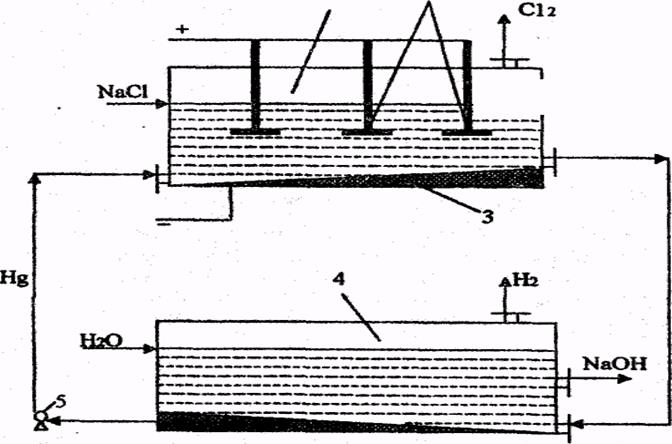
Вопрос № 31 Производство едкого натра и хлора электрохимическим способом. Электролиз хлоридов натрия в ваннах с ртутным катодом. Блок-схема промышленного производства едкого натра и хлора. Основные показатели процесса электролиза. См. вопрос 30. Электролиз хлоридов натрия в ваннах с ртутным катодом. Ванна с ртутным (жидким) катодом изображена на рис. 10.2 и состоит из двух частей - электролизера и разлагателя, соединённых друг с другом. Электролизер (1) представляет собой длинный закрытый ящик. В него опущены графитовые аноды (2) катодом служит ртуть (З) которая течёт по слегка наклонному дну ванны. Раствор NaСl концентрацией 310-315 г/л непрерывно подается в электролизер. При прохождении постоянного тока на анодах выделяется хлор по реакции (10.6). На ртутном катоде перенапряжение выделения водорода очень велико и Н+-ионы не разлагаются; а происходит разряд ионов натрия, т.к. потенциал выделения натрия на ртутном катоде значительно ниже потенциала выделения водорода и незначительно возрастает при увеличении плотности тока. В результате образуется натрий: Na+ + e = Na (10.10) который реагирует со ртутью, образуя амальгаму натрия; Na + nHg = NaHgn (10.11) Температура электролита 70-800 С. Из верхней части электролизера непрерывно выводится обедненный раствор NaCl (около 270 г/л), а снизу - амальгама натрия, которая поступает в разлагатель (4), где она обрабатывается водой. При этом происходит образование NaOH, водорода и ртути: NaHgn + Н2O = NaOH + 0,5 Н2O + nHg (10.12) Амальгама натрия разлагается на специальных насадках из соединений различных металлов (цирконий, вольфрам). Выделившуюся ртуть с помощью насоса (5) возвращают в электролизер. Таким образом, ртуть находится в замкнутом цикле (электролизер - разлагатель - электролизер). Обедненный раствор NaCl донасыщают хлоридом натрия и вновь возвращают на электролиз. Из разлагателя выводится раствор очень чистой щелочи.
Рис. 10.2. Ванна с ртутным катодом: 1 - электролизер; 2 - графитовые аноды; 3 - ртутный катод; 4 - разлагатель; 5 - насос
Преимущества ванны с ртутным катодом - высокая концентрация полученной щелочи, что уменьшает расход топлива на её упаривание, и высокая степень чистоты получаемой щелочи. Недостатками этих ванн по сравнению с ваннами с фильтрующей диафрагмой является повышенный расход энергии на единицу продукции (табл. 10.1); значительные капитальные затраты на строительство ванн; необходимость большого количества ртути, вредные условия труда, возможность попадания ртути в окружающую среду, образование вредных отходов. Расход ртути составляет 0,7 кг/т хлора, т.к. имеет место образование различных ртутьсодержащих отходов. Неконтролируемые выделения хлора составляют 1-5 т хлора на 100 т производимого хлора при диафрагменном методе производства и 2-8 т хлора при ртутном методе. Несмотря на перечисленные недостатки, применение ванн с ртутным катодом возрастает, т.к. многие производства требуют чистой щелочи, не содержащей хлоридов. Недостатком диафрагменного метода является необходимость применения стадии выпарки щелока с отделением соли. Растворы щелочи, полученные из как ванн с фильтрующей диафрагмой, так и из разлагателей ванн с ртутным катодом, подвергают упариванию вначале в вакуум-выпарных аппаратах, а затем в котлах до концентрации NaOH 92-94%. При этом в случае концентрирования щелоков из ванн с фильтрующей диафрагмой, которые содержат не только NaOH, но и NaCl, при их упаривании происходит кристаллизация NaCl. Однако, несмотря на использование многоступенчатого процесса, полностью удалить NaCl не удается, поэтому едкий натр содержит в качестве примеси 2-3% NaCl. Хлорид натрия, выделяющийся при упаривании щелоков, возвращают в электроизёр. Процесс упаривания примерно на 30% удорожает себестоимость каустической соды диафрагменным методом. Блок-схема процессов производства NaOH, хлора и водорода представлена на рис. 10.3. Крупнейшие установки в мире, работающие по диафрагменному методу, имеют мощность 1000-1300 т/сутки каустической соды. Хлор, получений при электролизе, насыщен водяными парами. Его в ряде случаев перерабатывают в жидкий хлор. При этом сначала путём охлаждения из газообразного хлора удаляется влага (конденсация). Затем для окончательной осушки его подают в башни, орошаемые концентрированной серной кислотой. Хлор переводят в жидкое состояние при сжатии до 0,3-0,6 МПа и охлаждением до – 250 C.
Вопрос №32 Вопрос №1 Содержание, особенности и тенденции развития химической технологии. Химико-технологические системы (ХТС). Иерархия химического производства. Технология – наука, изучающая способы и процессы переработки сырья в предметы потребления и средства производства. Способ переработки – это совокупность всех операц ий, которые проходит сырье до получения из него продукта. Химическая технология изучает процессы, сопровождающиеся изменением энергии, химического состава и внутренней структуры вещества. Пример: синтез аммиака из азота и водорода. Химическая технология изучает совокупность физических и химических процессов, пути их осуществления в промышленном производстве, их экономическую целесообразность. Все процессы хим. тех. можно свести к пяти основным процессам: гидродинамические, тепловые, массообменные, механические, химические. Особенности: 1.Массовый характер производства, многостадийность и неразрывность технологических процессов. 2. Вредное воздействие химического комплекса на окр. среду. 3. Быстрые темпы развития. Главные тенденции технического прогресса химической промышленности на ближайшие годы: 1) Продолжение перехода на агрегаты более крупной единичной мощности там, где не достигнут оптимум. 2) Реконструкция и модернизация химических производств с внедрением энергосберегающих, ресурсосберегающих и более экологически чистых технологий. 3)Повышение селективности процессов. 4)Концентрация, специализация и комбинирование производства. 5) Экономия сырья и его комплексное использование. 6) Повышение качества химической продукции. 7) Внедрение технологических операций, интенсифицирующих процесс или экономящих энергию. Система – сложный объект, состоящий из взаимосвязанных и взаимодействующих между собой и с внешней средой элементов или подсистем. Элемент – самостоятельная и условно неделимая единица. В ХТ это чаще всего аппарат, в котором протекает какой-либо типовой процесс. Подсистема – группа элементов (агрегат),обладающая определенной целостностью и целенаправленностью. Это самостоятельно функционирующая часть системы. Химико-технологическая система – это совокупность физико-химических процессов, происходящих в системе и средств для их реализации. ХТС включает в себя: химический процесс, протекающий в системе; аппараты, в которых этот процесс протекает; средства контроля и управления процессом; связи между элементами системы. Любое химическое производство представляет последовательность 4 основных стадий: подготовка сырья, собственно хим превращение, выделение целевого продукта, его очистка. Эти операции реализуются в виде единой сложной ХТС. ХТС, соответствующие хим производствам, обладают характерными признаками: 1- существование общей цели функционирования – выпуск продукции 2- большие размеры системы – велико число элементов, входящих в систему, число связей между ними 3- большое число параметров, характеризующих работу системы 4- сложность поведения системы – изменение режима в одном аппарате может влиять на работу всего производства 5- высокая степень автоматизации процессов управления производством 6- необходимость создания потоков осведомительной и управляющей информации между элементами ХТС и управляющими устройствами. Иерархия химического производства см. рис.
I. Типовой химико-технологический процесс – это отдельная единица 1ой ступени иерархической структуры химического производства, т.е. низшая ступень этой структуры. К типовым процессам хим. технологии относятся: гидродинамические, тепловые, диффузионные, химические, биохимические, механические, а так же локальные системы управления ими, в основном САР. II. На второй ступени испол. систем автоматизированного управления для решения задач оптимальной координации работы аппаратов и оптимального распределения потоков между ними (АСУТП). III. Третья ступень иерархии включает химические производства, состоящие из нескольких цехов, где получают целевые продукты, а так же АСУ технологического и организационного функционирования производства. IV. Химии. предприятие в целом и АСУП. Между уровнями сущ. отношения соподчиненности. Вопрос №2 Основные технологические понятия: производительность, интенсивность, расходные коэффициенты, конверсия, селективность, выход. Химический процесс. Технологический режим. Производительность агрегата (n) – это количество выработанного продукта или переработанного сырья (G) за единицу времени (T): Интенсивность работы аппарата (Y) – это производительность отнесенная к объёму аппарата V (м3) или площади его сечения S (м2): Расходный коэффициент (B) – это расход Q (сырья, воды, электроэнергии, реагентов), отнесенные к единице целевого продукта: Конверсия – это величина, характеризующая превращение сырья в результате реакции. Она представляет собой отношение количества сырья, вступившего в реакцию, к количеству сырья, взятому для проведения реакции: Выходом целевого продукта от стехиометрического выхода в расчете на взятое в реакцию сырьё является отношение количества фактически полученного целевого продукта к количеству целевого продукта, которое можно получить в соответствии со стехиометрическими коэффициентами при 100% конверсии сырья. Селективностью процесса по данному целевому продукту называется отношение количества фактически полученного продук
|
||||
|
Последнее изменение этой страницы: 2016-06-22; просмотров: 847; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.211.71 (0.013 с.) |

 Между подсистемами существует соподчинение, которое характеризуется иерархической структурой, состоящей из трех-четырех ступеней.
Между подсистемами существует соподчинение, которое характеризуется иерархической структурой, состоящей из трех-четырех ступеней. . Степень использования тепла в химико-технологическом процессе выражается тепловым КПД процесса nT – это отношение количества тепла, использованного непосредственно на осуществление основных химических реакций QТ, к общему количеству затраченного тепла Qпр:
. Степень использования тепла в химико-технологическом процессе выражается тепловым КПД процесса nT – это отношение количества тепла, использованного непосредственно на осуществление основных химических реакций QТ, к общему количеству затраченного тепла Qпр:  .
.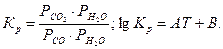 Из этих уравнений следует, что сдвиг равновесия в сторону образования водорода и, следовательно, увеличение его выхода, могут быть достигнуты повышением концентрации исходных реагентов и снижением температур. В промышленных условиях конверсию проводят при атмосферном и повышенном давлении. Увеличение содержания водяного пара в газовой смеси способствует более полному протеканию конверсии СО. Повышение температуры смещает влево равновесие реакции конверсии СО, однако при низких температурах реакция протекает очень медленно даже в присутствии катализаторов и выбор температуры зависит от типа применяемого катализатора. В РФ сегодня используются катализаторы двух типов: 1) Катализатор на основе оксида железа с добавлением оксидов хрома (СТК-1). При температурах 320-470 оС, когда скорость реакции достаточна, содержание СО в газовой смеси составляет 2-4 %, что требует сложной и громоздкой медноаммиачной очистки от остатков оксида углерода. Это высокотемпературные катализаторы. Лучшие зарубежные кат такого типа(фирмы ICI Katalco) работают при более низких темп 350-370 С и даже до 300 С, что позволяет минимизировать окончательный уровень СО и увеличивает срок службы кат. 2) низкотемпературные цинк-хромовомедные и цинк-хроммедноаллюминевые катализаторы позволяют проводить процесс при 190-250 оС и получать остаточное содержание СО в газах 0,2-0,4%. В этом случае становится возможным применение каталитической очистки методом гидрирования остаточного СО до СН4. Однако этот кат оч чувствителен к серосодержащим соединениям, что требует высокой степени очистки газа. Высокоактивными низкотемп кат явл в РФ НТК-4, -8, СНК-2. Лучшие зарубежные кат также работают при низких темп 195-250С.
Из этих уравнений следует, что сдвиг равновесия в сторону образования водорода и, следовательно, увеличение его выхода, могут быть достигнуты повышением концентрации исходных реагентов и снижением температур. В промышленных условиях конверсию проводят при атмосферном и повышенном давлении. Увеличение содержания водяного пара в газовой смеси способствует более полному протеканию конверсии СО. Повышение температуры смещает влево равновесие реакции конверсии СО, однако при низких температурах реакция протекает очень медленно даже в присутствии катализаторов и выбор температуры зависит от типа применяемого катализатора. В РФ сегодня используются катализаторы двух типов: 1) Катализатор на основе оксида железа с добавлением оксидов хрома (СТК-1). При температурах 320-470 оС, когда скорость реакции достаточна, содержание СО в газовой смеси составляет 2-4 %, что требует сложной и громоздкой медноаммиачной очистки от остатков оксида углерода. Это высокотемпературные катализаторы. Лучшие зарубежные кат такого типа(фирмы ICI Katalco) работают при более низких темп 350-370 С и даже до 300 С, что позволяет минимизировать окончательный уровень СО и увеличивает срок службы кат. 2) низкотемпературные цинк-хромовомедные и цинк-хроммедноаллюминевые катализаторы позволяют проводить процесс при 190-250 оС и получать остаточное содержание СО в газах 0,2-0,4%. В этом случае становится возможным применение каталитической очистки методом гидрирования остаточного СО до СН4. Однако этот кат оч чувствителен к серосодержащим соединениям, что требует высокой степени очистки газа. Высокоактивными низкотемп кат явл в РФ НТК-4, -8, СНК-2. Лучшие зарубежные кат также работают при низких темп 195-250С. ). Выход по току - отношение количества выделяющегося на электроде вещества (Gпр) к теоретически возможному количеству (Gт), рассчитанному по законам Фарадея:
). Выход по току - отношение количества выделяющегося на электроде вещества (Gпр) к теоретически возможному количеству (Gт), рассчитанному по законам Фарадея: (10.1)
(10.1)

 . Для производства, где количество выработанного продукта измеряется объёмом (Vn):
. Для производства, где количество выработанного продукта измеряется объёмом (Vn):  .
. ;
;  ;
; 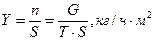 ;
;  .
.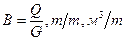 .
. .
.


