
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Производство водорода. Сырьевые источники. Способы получения водорода. Краткая характеристика и сравнение методов производства водорода.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Ежегодно в мире производится свыше 40 млн т водорода. Почти весь получаемый в промышленности водород образуется в результате реакций окисления углеводородов или углерода связанным или свободным кислородом. Не более 2% водорода получается в результате электролиза воды и другими методами. Способы получения водорода: 1) Паровая каталитическая конверсия легких углеводородов с подводом тепла. Этим способом конвертируются природный газ, сжиженные газы и бензиновые фракции с температурой кипения до 200оС. Смесь углеводородов и паров воды подаётся в реакционные трубы, находящиеся в топке печи и воспринимающие от неё тепло. Процесс ведется под давлением до 2-4 МПа и при температуре газа на выходе 760-900 оС на никелевом кат. Преимущества – низкие энергетические затраты. Недостатки – большие капитальные вложения. 2) Автотермическая каталитическая конверсия легких углеводородов. Этим способом перерабатываются природный, коксовый и некоторые другие газы. Процесс осуществляется в шахтном реакторе с неподвижным слоем никелевого катализатора, куда подается предварительно перемешанная смесь газа, пара и кислорода. Температура на выходе из реактора 800-860 оС. Преимущества – низкие удельные капитальные вложения. Недостатки – энергетические затраты. 3) Высокотемпературная кислородная конверсия углеводородов. Процесс представляет собой неполное окисление углеводородов с образованием водорода и оксида углерода. Реакция происходит в свободном объёме при 1300-1500 оС под давлением 8-9 МПа. Преимущества – низкие кап. затраты. Недостатки – использование высоких температур и давлений и образование сажи. 4) Газификация твердых топлив (угля, сланцев, торфа). Процесс проводится с подачей в реактор с неподвижным слоем мелкозернистого топлива воздушного, кислородного, паровоздушного и парокислородного дутья под давлением до 0,4 МПа при 1300-1500 оС Процессы значительно уступают первым трем названным выше способам, однако используют в качестве сырья неограниченные на сегодня источники. 5) Конверсия биомассы растительного сырья с водой. Конверсия в присутствии кат. протекает по реакции: CxHyOz + xH2O = xH2 + yCO2. Температура процесса 500-700 оС, давление 0,1 МПа. Преимущества – низкие энергозатраты. Недостатки – уступает по энергетическим показателям. 6) Электролиз воды и растворов солей. Преимущества – простота и надежность технологической схемы. Недостаток – большая энергоёмкость. 7) Извлечение водорода как побочного продукта.
Вопрос №7 Блок-схема производства водорода и азотоводородной смеси парокислородовоздушной конверсией метана. Технология получения водорода обычно включает очистку сырья от серосодержащих соединений, каталитическую конверсию УВ с водяным паром и 4-хстадийную очистку конвертированного газа от оксидов углерода. Такую схему можно назвать классической. Рассмотрим процессы паровой и автоматической каталитической конверсии легких УВ. Конкретным сырьем могут служить любые УВ газы (прир,попутные), нафта и т.п. Для получения 1 т водорода требуется 3,5:4,5 (5 – 6,6 тыс. м3) прир газа в зависимости от производства (аммиак, метанол, водород).
Обессеривание сырья – удаление газообразных сернистых соединений, поскольку они являются сильными каталитическими ядами. Это стадия подготовки сырья для производства водорода и АВ смеси.
Вопрос №8 Подготовка сырья для производства водорода парокислородовоздушной конверсией легких углеводородов: «сухие» методы очистки от сернистых соединений. Стадией подготовки сырья для производства водорода и азотоводородной смеси является обессеривание сырья – удаление газообразных сернистых соединений, поскольку они являются сильными каталитическими ядами. Обычно газ, поступающий на установки по производству водорода,до этого проходит предварительную очистку и не содержит большого количества серы. Однако для проведения ряда послед процессов кол-во серы в прир газе не должно превышать 0,5 мг/м3. Очистка оксидом цинка. Большинство современных установок паровой конверсии природного газа снабжены системой очистки поглотителями на основе оксида цинка, способного реагировать помимо сероводорода со многими сернистыми соединениями: H2S + ZnO = ZnS + H2O; CS2 + 2ZnO = 2ZnS + CO2; COS + ZnO = ZnS +CO2; RSH + ZnO = ZnS + ROH. Температура очистки 350-400 оС. Адсорбент не регенерируется. Остаточное содержание серы в газе не превышает 1 мг/м3. В мировой практике для этой цели используют поглотители на основе оксида цинка, нанесенного на носитель (цемент и др.).
Вопрос №9 Термодинамические основы производства водорода каталитической конверсией углеводородных газов. Выбор условий проведения процесса. Общие требования к катализаторам химико-технологических процессов. Конверсию углеводородных газов для получения водорода ведут, применяя в качестве окислителя водяной пар или кислород. Взаимодействие метана с вод. паром, кислородом, диоксидом углерода протекает по след. Реакциям: CH4 + H2O = CO +3H2 (-206кДж); CH4 + 0,5O2 = CO + 2H2 (+35кДж); CH4 + CO2 = 2CO + 2H2 (-248кДж). Далее осуществляется конверсия оксида углерода с водяным паром по реакции: CO + H2O = CO2 +H2 (+41 кДж). Суммарно процесс конверсии метана с водяным паром протекает в поглощением тепла: CH4 +2H2O = CO2 + 4H2 (-165кДж). Выбор условий проведения процессов. Реакция окисления метана водяным паром протекает со значительной скоростью при 1350 оС. Из-за трудности ведения эндотермического при столь высоких температурах в промышленных условиях процесс паровой конверсии часто ведут на катализаторе. Увеличение соотношения CH4: H2O c 1:1 до 1:2 увеличивает конверсию метана. Процесс конверсии выгодно проводить при повышенном давлении для увеличения скорости реакции, так как при этом растет концентрация вещества в единице объёма. При повышенном давлении уменьшаются так же объёмы теплообменных и контактных аппаратов и трубопроводов, что очень важно. К катализаторам паровой конверсии легких углеводородов предъявляют жесткие требования по термоустойчивости и механической прочности. Оцениваются они по комплексу свойств: активности, прочности, гидравлическому сопротивлению, устойчивости при длительной эксплуатации и др. Хороший катализатор должен работать не менее 4-5 лет. Главной особенностью катализатора является высокая каталитическая активность. Активность никелевого катализатора уменьшается при наличии в газе сернистых соединений. Среди зарубежных кат хорошими показателями обладают кат фирмы ICI Katalco, устойчивые при температурах до 1000 С. В наст время в РФ исп кат ГИАП-3-6Н, ГИАП-8, ГИАП-16, -19 и КСН. Активность никелевого кат уменьшается при наличии в газе сернистых соединений. Итак, конверсия легких углеводородов протекает при 760-900 оС (на выходе из реактора), при повышенном (до 4 МПа) давлении в присутствии избытка водяного пара.
Вопрос №10 Конверсия оксида углерода в процессе производства водорода. Выбор условий проведения процесса. Высокотемпературные и низкотемпературные катализаторы. Сопутствующая процессам конверсии метана реакция CO + H2O = CO2 +H2 (+41 кДж) - конверсия СО водяным паром – в конверторе метана протекает частично. Эта реакция является желательной. Условия равновесия этой реакции определяются уравнениями
Вопрос №11
|
||||
|
Последнее изменение этой страницы: 2016-06-22; просмотров: 779; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.145.37 (0.008 с.) |


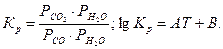 Из этих уравнений следует, что сдвиг равновесия в сторону образования водорода и, следовательно, увеличение его выхода, могут быть достигнуты повышением концентрации исходных реагентов и снижением температур. В промышленных условиях конверсию проводят при атмосферном и повышенном давлении. Увеличение содержания водяного пара в газовой смеси способствует более полному протеканию конверсии СО. Повышение температуры смещает влево равновесие реакции конверсии СО, однако при низких температурах реакция протекает очень медленно даже в присутствии катализаторов и выбор температуры зависит от типа применяемого катализатора. В РФ сегодня используются катализаторы двух типов: 1) Катализатор на основе оксида железа с добавлением оксидов хрома (СТК-1). При температурах 320-470 оС, когда скорость реакции достаточна, содержание СО в газовой смеси составляет 2-4 %, что требует сложной и громоздкой медноаммиачной очистки от остатков оксида углерода. Это высокотемпературные катализаторы. Лучшие зарубежные кат такого типа(фирмы ICI Katalco) работают при более низких темп 350-370 С и даже до 300 С, что позволяет минимизировать окончательный уровень СО и увеличивает срок службы кат. 2) низкотемпературные цинк-хромовомедные и цинк-хроммедноаллюминевые катализаторы позволяют проводить процесс при 190-250 оС и получать остаточное содержание СО в газах 0,2-0,4%. В этом случае становится возможным применение каталитической очистки методом гидрирования остаточного СО до СН4. Однако этот кат оч чувствителен к серосодержащим соединениям, что требует высокой степени очистки газа. Высокоактивными низкотемп кат явл в РФ НТК-4, -8, СНК-2. Лучшие зарубежные кат также работают при низких темп 195-250С.
Из этих уравнений следует, что сдвиг равновесия в сторону образования водорода и, следовательно, увеличение его выхода, могут быть достигнуты повышением концентрации исходных реагентов и снижением температур. В промышленных условиях конверсию проводят при атмосферном и повышенном давлении. Увеличение содержания водяного пара в газовой смеси способствует более полному протеканию конверсии СО. Повышение температуры смещает влево равновесие реакции конверсии СО, однако при низких температурах реакция протекает очень медленно даже в присутствии катализаторов и выбор температуры зависит от типа применяемого катализатора. В РФ сегодня используются катализаторы двух типов: 1) Катализатор на основе оксида железа с добавлением оксидов хрома (СТК-1). При температурах 320-470 оС, когда скорость реакции достаточна, содержание СО в газовой смеси составляет 2-4 %, что требует сложной и громоздкой медноаммиачной очистки от остатков оксида углерода. Это высокотемпературные катализаторы. Лучшие зарубежные кат такого типа(фирмы ICI Katalco) работают при более низких темп 350-370 С и даже до 300 С, что позволяет минимизировать окончательный уровень СО и увеличивает срок службы кат. 2) низкотемпературные цинк-хромовомедные и цинк-хроммедноаллюминевые катализаторы позволяют проводить процесс при 190-250 оС и получать остаточное содержание СО в газах 0,2-0,4%. В этом случае становится возможным применение каталитической очистки методом гидрирования остаточного СО до СН4. Однако этот кат оч чувствителен к серосодержащим соединениям, что требует высокой степени очистки газа. Высокоактивными низкотемп кат явл в РФ НТК-4, -8, СНК-2. Лучшие зарубежные кат также работают при низких темп 195-250С.


