Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
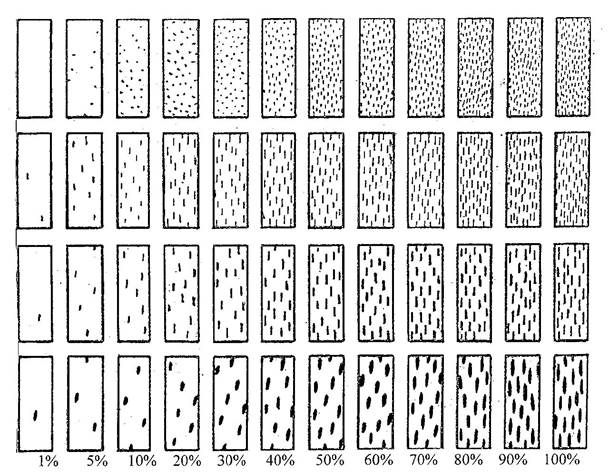
Шкалы учета болезней сельскохозяйственных культурСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Рис.9. А – интенсивность развития септороиоза на листьях; Б - интенсивность развития септороиоза на стеблях (W.C. James, 1971). А Б
Рис.10.А – интенсивность развития мучнистой росы злаков; Б - интенсивность развития септороиоза на колосе (W.C. James, 1971).
Рис.12. Шкала оценки степени поражения злаковых видами корневой гнили (А) и фузариозного поражения колоса (Б), в баллах. Баллы: 1 – поражено до 25% поверхности органа; 2 – поражено 26-50%; 3 - поражено 51-75%; 4 - поражено свыше 75% поверхности (А.Е.Чумаков, Т.И. Захарова, 1990)
Глава 7 ФИТОЭКСПЕРТИЗА СЕМЯН СЕЛЬСКОХОЗЯЙСТВЕННЫХ КУЛЬТУР СОГЛАСНО ГОСТ 12044 - 93 Макроскопический метод Отбор проб семян на зараженность проводится по ГОСТ 12036 - 85; выделение навесок по ГОСТ 12037 - 81. Метод применяют для визуального обнаружения в семенах головневых образований, склероциев спорыньи и других грибов, а также галлов пшеничной нематоды. Анализ проводят одновременно с определением чистоты семян по ГОСТ 12037 - 81. Метод обмывки семян (суспензии спор) и центрифугирования Метод применяют для определения наличия спор головни на поверхности семян злаковых культур и лука; спор возбудителей болезни пасмо на семенах льна; спор рамуляриоза - на семенах кориандра; спор ржавчины на клубочках свеклы и семенах аниса; спор и мицелий церкоспороза на семенах фенхеля. На зерновых культурах этим способом можно определить зараженность семян ржи стеблевой и твердой головней, пшеницы - стеблевой и твердой головней, ячменя- каменной и черной (ложной пыльной) головней, кукурузы - пыльной головней, проса - обыкновенной мелкоспоровой головней, риса - гельминтоспориозом, фузариозом, головней. Для проведения анализа из семян основной культуры отсчитывают подряд две рабочие пробы по 100 семян в каждой. Каждую рабочую пробу помещают в пробирку, заливают 10 см3 воды и взбалтывают. Семена с гладкой поверхностью (пшеница, рожь) взбалтывают в течение 5 мин, семена с шероховатой поверхностью (свекла и др.) - 10 мин, семена льна - 1 мин. Полученные суспензии можно обследовать непосредственно под микроскопом для идентификации патогенов или можно выделить споры путем центрифугирования. В случае центрифугирования промывную воду от каждой пробы семян сливают в отдельные пробирки центрифуги и центрифугируют в течение 10-15 мин. при скорости 2000-2500 об/мин. Если в центрифуге не все пробирки заняты суспензией, то свободные заполняют для равновесия чистой водой до того же уровня. По окончании центрифугирования из пробирок осторожно отбирают 9 см3 над осадочной жидкости. Оставшийся осадок взмучивают пипеткой и из каждой пробирки готовят по пять препаратов. Для установления вида гриба препараты просматривают под микроскопом. Количественный учет спор проводят в камере Горяева. Метод отпечатков Метод применяют вместо центрифугирования для определения поверхностей заспоренности семян зерновых культур головневыми грибами. Из семян основной культуры отсчитывают 10 семян. Каждое семя обертывают отрезком прозрачной клейкой ленты размером 1 см2, плотно прижимая его по всей поверхности семени. Затем с помощью пинцета ленту отклеивают и помещают на предметном стекле под микроскоп для идентификации патогена и подсчета спор. Подсчет спор проводят в 10 полях микроскопа в соприкасавшихся с семенем частях отрезка ленты и устанавливают среднеарифметическое количество спор в одном поле зрения микроскопа. Для пшеницы и ячменя с помощью окуляр-линейки под микроскопом при однократном увеличении объектива измеряют длину и ширину семени с точностью до 0,1 мкм.
Рис.13. 1 – колос ржи, пораженный спорыньей; рожки спорыньи: 2 - ржи; 3 – пшеницы; 4 – ячменя; 5 - злаковых трав; 6 - склероции белой и серой гнили; 7 – здоровое семя клевера; 8 – склероции рака клевера; 9 – склероции тифуля.
Рис.14. Головня злаков: 1 – здоровое зерно пшеницы; 2 – головневый мешочек (зерно пшеницы, пораженное твердой головней); 3 – здоровое зерно ржи; 4 - головневый мешочек (зерно ржи, пораженное твердой головней ржи); 5 - здоровое зерно ячменя: 6, 7, 8 - головневые комочки (колоски и зерновки ячменя, пораженные твердой головней ячменя); 9 – здоровое семя овса; 10 – семя овса, пораженное твердой головней; 11 – здоровое семя сорго; 12 – семя сорго, пораженное твердой головней.
На основании данных измерения длины и ширины определяют площадь поверхности семени. Для семян других зерновых культур площадь поверхности семени измеряют наложением отпечатка на миллиметровую бумагу или посредством окулярной сетки микроскопа. 7.4. Метод анализа зародышей (эмбрионов) Метод применяют для обнаружения мицелия пыльной головни (Ustilago sp.) в эмбрионах семян пшеницы и ячменя, отделенных от эндосперма. Для анализа используют семена основной культуры, выделенные из навески массой 100 г для пшеницы и 120 г для ячменя. Перед отделением зародышей (эмбрионов) семена ячменя для отделения пленок помещают на 40 мин в 50 %-ный раствор серной кислоты. (Концентрированную химически чистую кислоту разбавляют вдвое, наливая кислоту в воду). Затем семена тщательно перемешивают, промывают проточной водой, а остатки пленок оттирают на решете капроновой щеткой. Эмбрионы семян пшеницы и ячменя отделяют от эндосперма двумя способами. Второй способ. Семена помещают в эмалированную или стеклянную посуду, заливают 3 %-ным раствором щелочи и кипятят около 1 ч до полного отделения зародышей от эндосперма. Затем содержимое из посуды пропускают через набор лабораторных решет с диаметром отверстий 5, 3 и 1 мм с последующей промывкой их проточной водой. Зародыши, оставшиеся на последнем решете, переносят в колбу вместимостью 250 см3 и кипятят 40 мин в 15-20 %-ном растворе щелочи, взятой в количестве 200 см3, после чего их тщательно отмывают от щелочи. Отмытые зародыши помещают в стеклянный бюкс или колбу, где налито небольшое количество раствора анилинового синего или трипанового синего красителя в концентрации 0,1 %, доводят до кипения на электроплитке или спиртовке и кипятят в течение 10-20 с. При работе с химикатами следует соблюдать меры предосторожности. Потеря зародышей после всех операций не должна превышать 20 %. Зародыши можно хранить в 50 %-ном водном растворе глицерина. После кипячения каждый зародыш просматривают под микроскопом или бинокулярной лупой при увеличении (12х-15х). В поле зрения должен быть виден один зародыш. Покровным стеклом зародыш накрывать не следует.
Рис.15. Устоспоры головневых грибов (К.В. Попкова, 1988): Tilletia caries; 2 – T. foetida; 3 – T. controversa; 4 – Telletia indica; 5 – Urocystis tritici; 6 – Ustilago tritici; 7 – Urocystis occulta; 8 – Ustilago hordei; 9 – Ustilago nuda; 10 – Ustilago zeae; 11 – U. avena; 12 – U. levis; 13 – Sphacelotheca panici-miliacei Зародыши располагают в рядки, очерченные восковым карандашом, с помощью препаровальных игл или небольшого скальпеля, и просматривают под микроскопом на предметном стекле или в чашках Петри. Зародыши необходимо просматривать в основном со стороны зародышевой почки, корешков и колеоптиля, где может располагаться мицелий, и со стороны щитка. Грибница головни при малом увеличении микроскопа представляет собой комочки спутанных гифов мицелия. Гифы окрашены в сине-голубой цвет, имеют толщину 3 мкм. Встречаются редкие случаи, когда в ткани щитка находятся другие грибы помимо головни, но они имеют другое строение и ясно различимы. Подсчитывают все инфицированные зародыши независимо от места локализации мицелия в органах эмбриона и вычисляют их содержание в процентах к числу просмотренных зародышей. Биологический метод Метод применяют для выявления внешней и внутренней зараженности семян болезнями. Он основан на стимуляции развития и роста микроорганизмов в зараженных семенах. Зараженность семян определяют при проращивании их во влажной камере, на питательных средах, песке или в рулонах фильтровальной бумаги.
|
||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1021; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.23.110 (0.011 с.) |